Triton WR-1339致小鼠高脂血症模型的脂代谢与炎症变化探讨
李钰婷,蔡大可,占心佾,郑柳怡,杨九妹,黄雪君,黄丹娥,陈玉兴,甘海宁
(1.广州中医药大学第五临床医学院,广东 广州 510405; 2.广东省中医药工程技术研究院, 广东 广州 510095; 3.广东省中医药研究开发重点实验室,广东 广州 510095)
高脂血症是一系列心血管疾病发病的重要原因,其发病机制复杂,目前公认的发病原因主要包括炎症因子、氧化应激、内质网应激、肠道菌群及基因多态性等方面[1]。因此,不同的高脂血症动物模型因发病机制的差异性,会导致降脂药物药效评价的差异性。最新研究发现,高脂血症的形成、发展甚至并发症中均可引发炎症反应[2],由此可见,在降脂药物的筛选中,抗炎作用是一重大攻破点。但是炎症与脂代谢之间的关系仍不明确,需要在特定的模型进行阐述,从而为降脂药物的评价提供参考。
Triton WR-1339所致的高脂血症模型是常用的急性高脂血症动物模型。其所致的高脂血症具有造模时间短、致内源性脂质代谢紊乱的特点,主要用于降血脂药物的筛选[3]和脂质代谢机制的探索。该模型具有多种致病机制:包括抑制肝脏脂蛋白水解酶HPL和血清的脂蛋白水解酶LPL活性[4],促进HMG-CoA的活性[5]等,且其具有显著的炎症病变特点[5],但炎症与Triton WR-1339所致脂质代谢紊乱的相关性并未充分阐述清楚。与调控脂代谢密切相关的Kupffer细胞是肝脏中固有的巨噬细胞,可通过先天免疫反应促进肝脏炎症反应。Kupffer细胞的激活,会使肝脏产生促炎因子如IL-1β、IL-6和MCP-1等[6-8],其对肝细胞的调控作用,亦是脂代谢紊乱的一个重要原因。本实验通过对不同时间点及多次注射Triton WR-1339研究炎症与高脂血症之间的关系及发生的先后顺序。
1 材料与方法
1.1 主要仪器
BS224S电子天平(1/万),购自德国SARTORIUS公司;JJ3000动物电子秤,购自G&G公司;5424型小型高速离心机,购自德国Eppendorf公司;Bio-RAD全自动酶标仪,购自美国伯乐公司;DP72显微镜购自日本OLYMPUS;-80 ℃超低温冰箱,购自美国Thermo公司。
1.2 试剂
Triton WR-1339(批号:Lot#MKCC6730),购自美国Sigma-Aldrich公司;总胆固醇(TC,批号:20180722)和总三酯甘油(TG,批号:20180822),购自上海科欣生物技术研究所;即用型SABC法免疫组化试剂盒,购自武汉博士德生物工程有限公司;IL-1β、IL-6、MCP-1 ELISA试剂盒,均购自天津安诺瑞康生物技术有限公司;4%组织细胞固定液,购自北京鼎国昌盛生物技术有限责任公司。
1.3 药物配制
称取相应量的Triton WR-1339,加入相应量的生理盐水,用玻璃棒直接搅拌溶解成质量浓度为0.12 g/mL的溶液。
1.4 实验动物
SPF级C57BL/6小鼠60只,雄性,体质量18~22 g,广东省医学实验动物中心提供,实验动物合格证号:44007200056604;动物饲养环境:广东省第二中医院(广东省中医药工程技术研究院)SPF级动物实验室,使用许可证号:SYXK(粤)2015-0059。
1.5 方法
1.5.1 动物模型的建立 在实验室环境下常规饲养3 d后,将60只C57BL/6雄性小鼠随机分为6组,每组10只,分别为正常组(0 h)、4 h组、8 h组、36 h组、2T组、3T组。除正常组外,其他小鼠肌肉注射Triton WR-1339溶液(0.1 g/mL);正常组、4 h组、8 h组和36 h组在对应的时间点进行取材;在前4组取材的同时对2T组和3T组进行第2次注射,36 h后将2T组取材,同时对3T组进行第3次注射,36 h后将3T组小鼠取材。取材操作为对小鼠进行摘眼球取血,后将其处死,取约100 mg肝脏置于4%组织细胞固定液中,待检测相应指标。
1.5.2 血清TC、TG含量的检测 将6组血样进行10 000 r/min离心5 min,取血清,按照试剂盒说明书分别测定血清中TC、TG的含量。
1.5.3 ELISA检测血清中IL-1β、IL-6和MCP-1的含量 用上述制备的血清,根据ELISA试剂盒的说明书,用多功能酶标仪在A450下检测A值,再根据公式算出IL-1β、IL-6和MCP-1在血清中的含量。
1.5.4 肝脏病理形态学观察 将置于4%组织细胞固定液的肝脏进行包埋,切片,进行苏木青-伊红染色,染色切片在显微镜下观察肝脏病理变化并随机选取拍照视野,采用Image-pro plus 6.0软件分析图片中炎症细胞浸润面积,计算百分比。
1.5.5 免疫组化 用上述蜡片依照SABC免疫组化试剂盒,将切好的石蜡切片常规脱蜡至水,热修复抗原,血清封闭,加一抗、二抗、SABC液,DAB显色,苏木素轻度复染,脱水,显微镜下镜检,随机选取拍照视野,采用Image-pro plus 6.0软件对肝脏组织CD68、IL-1β阳性表达面积进行半定量分析。
1.6 统计学处理
2 结果
2.1 Triton WR-1339对小鼠血清TC和TG的影响
如表1所示,小鼠血清TC和TG的含量在造模4 h和8 h均无明显变化,36 h开始明显增加(P<0.05或0.01),随着注射次数增加,呈现上升趋势。
2.2 Triton WR-1339对小鼠血清IL-1β、IL-6和MCP-1的影响
如表2所示,造模8 h后小鼠血清中IL-1β和MCP-1的含量开始明显升高(P<0.05),随着注射次数增加呈上升趋势(P<0.05或0.01);IL-6在3T时含量明显增加(P<0.05)。
表1 小鼠血清TC和TG的含量变化

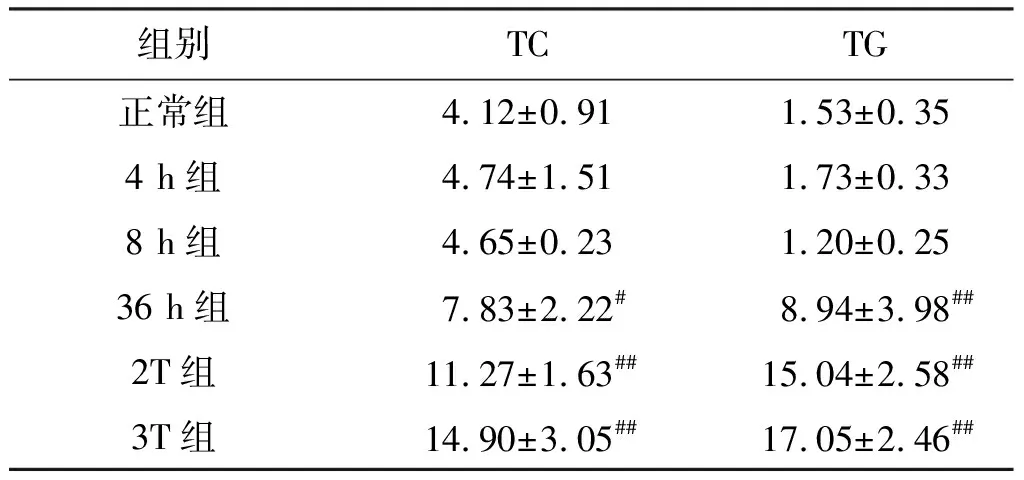
组别TCTG正常组4.12±0.911.53±0.354 h组4.74±1.511.73±0.338 h组4.65±0.231.20±0.2536 h组7.83±2.22#8.94±3.98##2T组11.27±1.63##15.04±2.58##3T组14.90±3.05##17.05±2.46##
与正常组比较:#P<0.05,##P<0.01。
表2 小鼠血清IL-1β、IL-6和MCP-1的含量变化
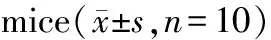
组别IL-1βMCP-1IL-6正常组57.57±1.1338.61±3.9453.28±3.204 h组59.10±1.1743.50±8.4760.27±6.348 h组60.22±2.06#62.69±17.98#47.83±7.7936 h组60.73±2.28#65.16±14.10#49.35±8.242T组63.07±3.44##59.68±14.17#55.81±5.233T组72.20±5.17##80.43±17.93##64.93±8.88#
与正常组比较:#P<0.05,##P<0.01。
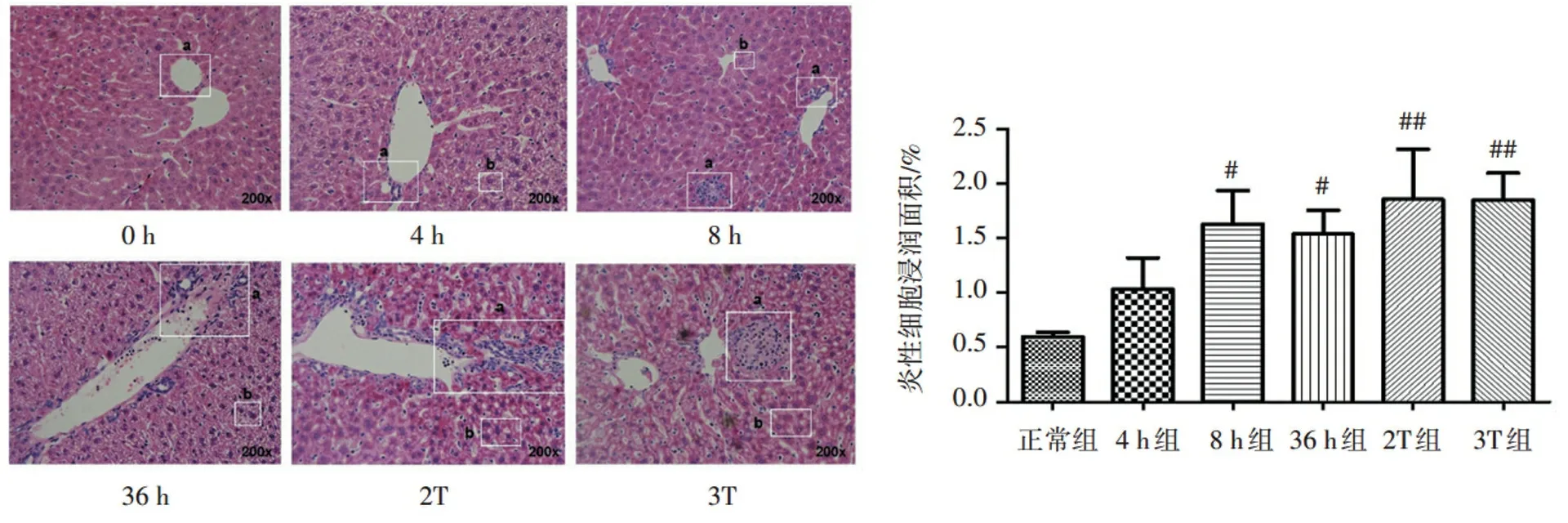
2.3 Triton WR-1339对小鼠肝脏病理形态学的影响
如图1所示,与正常组比较,4 h后肝细胞出现空泡样病变(a)和炎性浸润(b),8 h后炎性细胞浸润面积明显增加(P<0.05);而在注射Triton WR-1339 2次后,炎性细胞浸润面积显著性增加(P<0.01),且由脂质堆积所致的细胞空泡样病变明显。
2.4 Triton WR-1339对小鼠肝脏IL-1β和CD68蛋白表达的影响
从图2免疫组化结果可发现,小鼠肝脏正常组IL-1β和CD68的表达都较少。与正常组比较,肌注Triton WR-1339 4 h后肝脏IL-1β的阳性表达显著增加(P<0.05或0.01);8 h后肝脏CD68的阳性表达明显增加(P<0.05),2次以上注射显著增加(P<0.01),均呈棕黄色,多分布于胞质。

与正常组比较:#P<0.05,##P<0.01。
与正常组比较:#P<0.05,##P<0.01。
图2各组小鼠肝脏CD68、IL-1β表达比较
Figure2Comparison of the expression of liver CD68 and IL-1βin each group (200×)
3 讨论
高脂血症的治疗是预防心脑血管疾病发生的关键点,因而对于降脂药物的研究是当前一大热点。但由于高脂血症的诱因及其发生机制有所不同,为了更有针对性地筛选降脂药物,在药理实验研究中,有各种不同诱因导致的高脂血症动物模型:高脂饲料喂养、脂肪乳剂灌胃法、复合因素造模法等[9]。Triton WR-1339是常用的急性高脂血症模型,其通过给实验动物尾静脉或肌肉注射或腹腔注射的方式,抑制脂蛋白酯酶的活性及极低密度脂蛋白与其他脂蛋白交换,从而增加血浆TG和TC的含量[10]。由于Triton WR-1339所致的高脂血症模型是一种急性反应,通过体内自身代谢后即会消退,能够体现机体对炎症及脂代谢的自愈调节作用。本课题组前期研究[11]发现,肌肉注射Triton WR-1339后36 h,血浆中TG和TC含量达到峰值。所以采用36 h为注射间隔时间点,考察其多次注射对血脂的影响。
高脂血症一般均伴随着炎症反应,有学者推测是由于高脂血症患者血脂代谢紊乱,血脂在血管内皮积存,从而对血管内皮产生损伤作用,因而出现一系列炎症反应[12]。本实验结果发现,注射Triton WR-1339 36 h后模型小鼠血脂相比于正常组小鼠明显升高,且随着注射次数增加,血清中TC和TG显著升高,而在还未出现高脂血症前,注射后8 h血清IL-1β和MCP-1已明显升高,且与血脂的变化呈正相关。MCP-1属于CC趋化因子家族的一个小细胞因子,目前已知的单核细胞、巨噬细胞、成纤维细胞等在受到某些刺激下可被诱导分泌MCP-1,MCP-1对单核/巨噬细胞具有特异性趋化激活作用[13],巨噬细胞(Kupffer细胞)在激活状态下可分泌IL-1β、IL-6等炎症因子,产生炎症反应。本研究发现,8 h时,肝脏的炎性浸润面积开始明显增加,与MCP-1增加的时间点一致,说明MCP-1在招募巨噬细胞,且巨噬细胞标记物CD68[14]和M1型巨噬细胞分泌的炎症因子IL-1β[15]的表达量在8 h后明显增加。由以上结果推测,Triton WR-1339所致的高脂血症后于炎症反应的发生,且与巨噬细胞的招募和极化分型有关。
本实验结果提示,Triton WR-1339可刺激血清中MCP-1的分泌,进而激活和招募巨噬细胞,继而分泌炎症因子,其与该模型所致的急性高脂血症呈正相关,但炎症与高脂血症之间的关联还需进一步考究。本研究旨在探索Triton WR-1339所致脂代谢紊乱与炎症反应的关系,为研究降脂药物的动物模型筛选提供了参考。

