白酒生产用L-乳酸的发酵工艺
韩经,肖冬光*
1(天津科技大学 生物工程学院,天津,300457)2(工业发酵微生物教育部重点实验室,天津,300457)
乳酸乙酯作为白酒四大酯之一[1],是白酒中重要的呈味物质[2-3],其含量的高低直接影响酒的风格[4],在水味重酒味淡薄的酒中,能对酒的后味进行缓冲和平衡,消除酒的水味,增加浓厚感[5]。白酒生产中乳酸乙酯是由乳酸菌代谢产生的L-乳酸和酿酒酵母发酵产生的乙醇经化学反应或在酯化酶的作用下生成[6-8],经研究发现其中主要以化学合成为主[9-10],且合成速度非常缓慢[11]。
众所周知,乳酸不同于其他有机酸,其含有一个不对称的碳原子,因此具有旋光性,分为L-乳酸和D-乳酸,而在自然界中有很多微生物都同时生成L-乳酸和D-乳酸[12-13],且不同菌种,不同工艺所产L/D-乳酸的比例不尽相同[14],而在白酒生产中相较于L-乳酸,D-乳酸因其不易被酯化利用而造成发酵酸度较高,从而影响酒醅正常的糖化发酵[15],同时近年来随着白酒清洁化生产的推进[16],出现了基酒中乳酸乙酯含量不足的问题,这给白酒生产的质量带来很大影响。本文通过黑曲酯化酶对L/D-乳酸酯化能力的比较,并对7株乳酸菌在不同原料,不同初始糖度的乳酸发酵培养基上产L-乳酸性能比较[17],初步确定白酒用L-乳酸的发酵工艺,为今后乳酸菌强化发酵和高乳酸乙酯调味酒中的制备奠定基础[18],改善酒的质量,提升酒的品质。
1 材料与方法
1.1 材料与试剂
1.1.1 试剂与原料
L-乳酸、D-乳酸、乙醇(分析纯),天津市永大化学试剂有限公司;液化酶、糖化酶、酸性蛋白酶,诺维信有限公司;玉米、大米、麦根,超市。
1.1.2 菌种
黑曲霉(Aspergillusniger)T103、干酪乳杆菌(Lactobacilluscasei)L1、乳酸片球菌(Pediococcusacidilactici)P1、戊糖片球菌(Pediococcuspentosaceus)P5、短乳杆菌(Lactobacillusbrevis)L3、保加利亚乳杆菌(Lactobacillusbulgaricus)L5、植物乳杆菌(Lactobacillusplantarum)L8、凝结芽孢杆菌(Bacilluscoagulans)B1,取自本实验保藏菌种。
1.1.3 培养基
麸曲固体培养基(g):(1)试管培养(一级种):称取一定量的麸皮,加水65 %(质量分数)左右,拌匀后分装试管,厚度为2.0 cm,121 ℃灭菌20 min。(2)三角瓶培养(二级种):称取一定量的麸皮,加水80 %,充分拌匀,装入500 mL角瓶内,厚度为2.0 cm,121 ℃灭菌20 min。
MRS培养基(g/L):葡萄糖20.0、蛋白胨10.0、牛肉膏10.0、酵母膏5.0、柠檬酸二胺2.0、K2HPO42.0、乙酸钠8.0、MgSO4·7H2O 0.2、MnSO4·4H2O 0.05、Tween-80 1.0 mL,自然pH,115 ℃高压灭菌20 min。
乳酸发酵培养基:
(1)大米300 g,麦根30 g,加水1 L,以原料总量添加液化酶5 U/g,于90 ℃水浴液化30 min,之后煮沸30 min,待冷却到60 ℃时加入糖化酶150 U/g,60 ℃保温糖化4 h,待冷却到40 ℃,加入活化好的酸性蛋白酶5 U/g,调节糖度,自然pH,115 ℃高压灭菌20 min。
(2)玉米300 g,麦根30 g,加水1 L,以原料总量添加液化酶5 U/g,于90 ℃水浴液化30 min,之后煮沸30 min,待冷却到60 ℃时加入糖化酶150 U/g,60 ℃保温糖化4 h,待冷却到40 ℃,加入活化好的酸性蛋白酶5 U/g,调节糖度,自然pH,115 ℃高压灭菌20 min。
1.2 仪器与设备
EL20实验室pH计,梅特勒仪器(上海)有限公司;手持糖度折光仪WYT-1,上海精密仪器仪表有限公司;DHP恒温培养箱,上海智诚分析仪器制造有限公司;BXW-360SD-G立式压力灭菌锅,上海博讯实业有限公司;Agilent 7890B 气相色谱仪,美国安捷伦科技公司;L/D-LACTATE试剂盒,Megazyme公司。
1.3 实验方法
1.3.1 黑曲酯化酶麸曲培养
将灭菌的一级麸曲试管接种黑曲霉孢子,置于30 ℃培养48 h,菌丝体遍布麸皮,置于37 ℃培养箱烘干,振荡打散即为一级种子。待冷却后将一级种接入三角瓶二级麸皮培养基中,充分摇匀,30 ℃培养40 h,待菌丝体布满并将麸皮连成饼状时进行扣瓶,使麸皮脱离底部继续培养1 d,即可出瓶。出瓶后置于牛皮袋内,于37~40 ℃快速烘干(含水量< 12 %),充分打散并保存。
1.3.2 乳酸发酵液的制备
乳酸菌的活化:取一环保藏斜面上的乳酸菌接种于装有5 mL MRS液体培养基的试管中,30 ℃条件下静置培养24 h。
种子液的制备:将活化好的乳酸菌培养液按5 %(体积分数)的接种量转接于装有100 mL MRS液体培养基的250 mL三角瓶中,30 ℃条件下静置培养24 h。
将乳酸菌种子液按10 %的接种量转接于装有100 mL乳酸发酵培养基的250 mL三角瓶中,添加3.0 %无菌CaCO3,密封,于35 ℃条件下静置发酵。
1.3.3L/D乳酸对黑曲霉酯化酶催化活力的影响
按照1.3.1的方法制成黑曲酯化酶麸曲,并在乙醇体积分数为20 %的100 mL乙醇溶液中,实验组分别添加总量1 g的不同比例的L-乳酸,D-乳酸作为底物,加入5 g烘干麸曲,以不添加烘干麸曲为对照组,按照1.3.5.5的方法,静置酯化7 d,测定乳酸乙酯酯合成量。
1.3.4 高产L-乳酸发酵工艺的确定
1.3.4.1 不同乳酸菌在两种发酵培养基上发酵性能的比较
由于黑曲酯化酶对L-乳酸的酯化效果更好,而自然界中的各乳酸菌产L-乳酸的比例不尽相同,为黑曲酯化酶能更好地应用于高乳酸乙酯调味酒的制备与生产,因此取7株乳酸菌(干酪乳杆菌L1、乳酸片球菌P1、戊糖片球菌P5、短乳杆菌L3、保加利亚乳杆菌L8、植物乳杆菌L8、凝结芽孢杆菌B1)分别接种到糖度为10 °Bx的大米麦根培养基和玉米麦根培养基上,静置发酵5 d,每隔24 h测定乳酸含量,并在发酵5 d后测定所产乳酸中L-乳酸和D-乳酸的比例[19]。从而初步确定最适发酵培养基和高产L-乳酸菌株。
1.3.4.2 初始糖度对不同菌株发酵性能的影响
取能高产L-乳酸的菌株接种到初始糖度分别为10、12、14、16、18 °Bx最适发酵培养基上,静置发酵13 d,每隔24 h测定乳酸含量,发酵13 d后测定所产乳酸中L-乳酸和D-乳酸的比例,从而确定高产L-乳酸菌株的最适初始糖度。
1.3.5 分析方法
1.3.5.1 取样预处理
每隔24 h对发酵液取样5 mL,对发酵液进行离心(7 000 r/min,4 ℃离心10 min)后取上清液。
1.3.5.2 乳酸总量的测定
取上清液,经适当稀释后于HPLC测定乳酸总量,检测条件:Agilent 1200SL液相色谱仪,色谱柱HPX-87H(300 mm×7.8 mm×9 μm),UV检测器,流动相为5 mmol/L的H2SO4溶液,柱温60 ℃,流速为0.6 mL/min,波长210 nm,保留时间12.6 min,进样量为 20 μL。
1.3.5.3L-乳酸和D-乳酸的测定
取上清液,按照L/D-LACTATE试剂盒说明书,对发酵液中的L-乳酸和D-乳酸含量进行测定。
1.3.5.4L-乳酸、D-乳酸光学纯度的计算
按照1.3.5.3的方法分别测定乳酸菌发酵液中L-乳酸和D-乳酸的生成量,L-乳酸、D-乳酸的光学纯度计算如公式(1)、(2)所示:
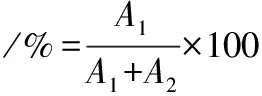
(1)
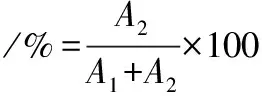
(2)
式中:A1为L-乳酸产量;A2为D-乳酸产量。
1.3.5.5 乳酸乙酯酯合成量的测定
吸取1 g乳酸和20 mL无水乙醇于100 mL容量瓶中,用蒸馏水定容至刻度,混匀后转入250 mL玻璃瓶中,加5 g烘干曲粉,调pH值为3.5,于30 ℃保温酯化7 d。然后加入50 mL蒸馏水于1 000 mL蒸馏烧瓶中加热蒸馏,并接收馏出液100 mL。取酯化馏出液进行气相色谱分析。
气相色谱检测条件:色谱柱Agilent HP-INNOWAX (30 m×320 μm×0.25 μm);载气为高纯氮气(>99.999 %);柱流速为0.8 mL/min;进样口温度200 ℃;检测器温度200 ℃;程序升温:起始温度50 ℃,保持8 min,以5 ℃/min升至150 ℃,保持15 min;进样体积为1 μL;分流进样,分流比为10∶1。
2 结果与分析
2.1 不同构型乳酸对黑曲酯化酶催化合成乳酸乙酯的影响
通过将实验室筛选得到高产乳酸乙酯酯化酶菌株黑曲霉T103对不同构型(L/D)乳酸底物进行乳酸乙酯酯合成量的测定,结果如表1所示。
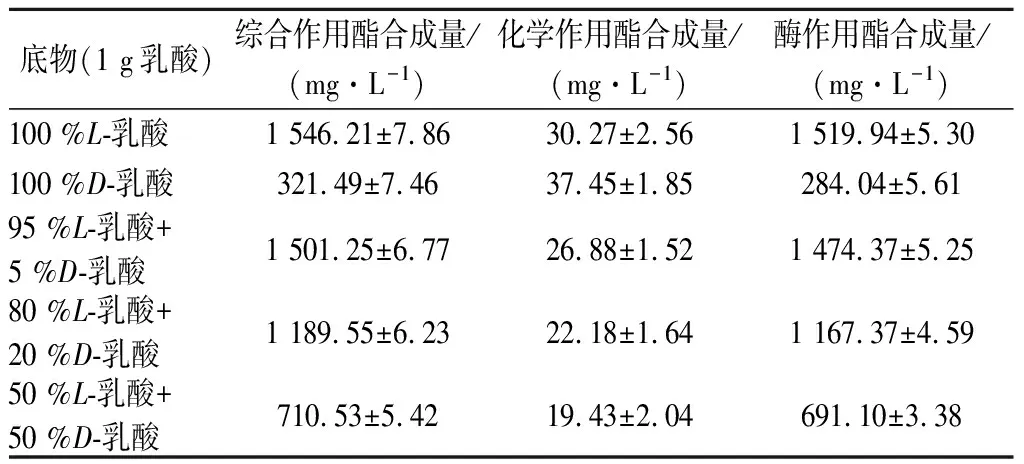
表1 不同比例L/D-乳酸对黑曲酯化酶合成乳酸乙酯的影响Table 1 Effects of different ratios of L/D-Lactic acid on synthesis of ethyl lactate by Aspergillus niger esterase
注:酶作用酯合成量=综合作用酯合成量-化学作用酯合成量,其中不加曲为化学作用,加曲为综合作用。
由表1可知,以不同比例L-乳酸,D-乳酸为底物,黑曲酯化酶催化合成乳酸乙酯的量有很大不同,当底物为100 %L-乳酸时,黑曲酯化酶酯化合成乳酸乙酯的量最高,达到1 546.21 mg/L,当底物为100 %D-乳酸时,黑曲酯化酶合成乳酸乙酯的量较低,仅有321.49 mg/L,当L-乳酸所占比例增加时,黑曲酯化酶合成乳酸乙酯的量随之增加,并且由表中数据可初步判断L-乳酸和D-乳酸并不存在竞争性抑制,黑曲酯化酶催化合成乳酸乙酯的量与L-乳酸、D-乳酸所占比例基本成对应关系。说明黑曲酯化酶对L-乳酸的酯化能力更强,而对D-乳酸的酯化能力较弱,这可能与L-乳酸和D-乳酸的化学结构有关,由于L-乳酸和D-乳酸互为旋光异构体,而且脂肪酶催化乳酸与乙醇的酯化反应为乒乓机制[20],因此根据诱导契合学说,推测有两种可能,一是相较于D-乳酸,L-乳酸对黑曲酯化酶的诱导性较强,其活性中心与L-乳酸更易形成稳定的中间复合物,并与乙醇结合后生成乳酸乙酯,二是相较于L-乳酸,黑曲酯化酶与D-乳酸形成中间复合物后,修饰变构后的中间络合物稳定性较差不能与乙醇进行充分地结合接触,从而导致黑曲酯化酶对D-乳酸的催化效果相较于L-乳酸较低。
2.2 高产L-乳酸发酵工艺的研究
2.2.1 不同菌株在两种原料(大米、玉米)发酵培养基上发酵性能的比较
2.2.1.1 不同菌株在两种原料(大米、玉米)发酵培养基上产酸量的比较
将7株乳酸菌按照1.3.2的方法接种到两种不同原料的发酵培养基上,发酵5 d,乳酸产量的变化趋势如图1、图2所示。
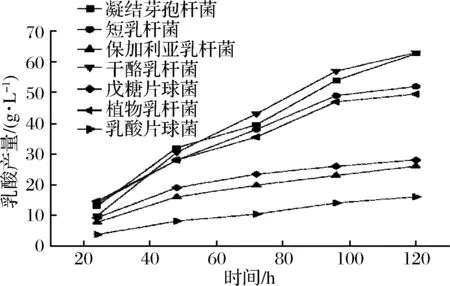
图1 不同菌株在大米发酵培养基上的乳酸产量Fig.1 Lactic acid production of various strainson rice fermentation medium
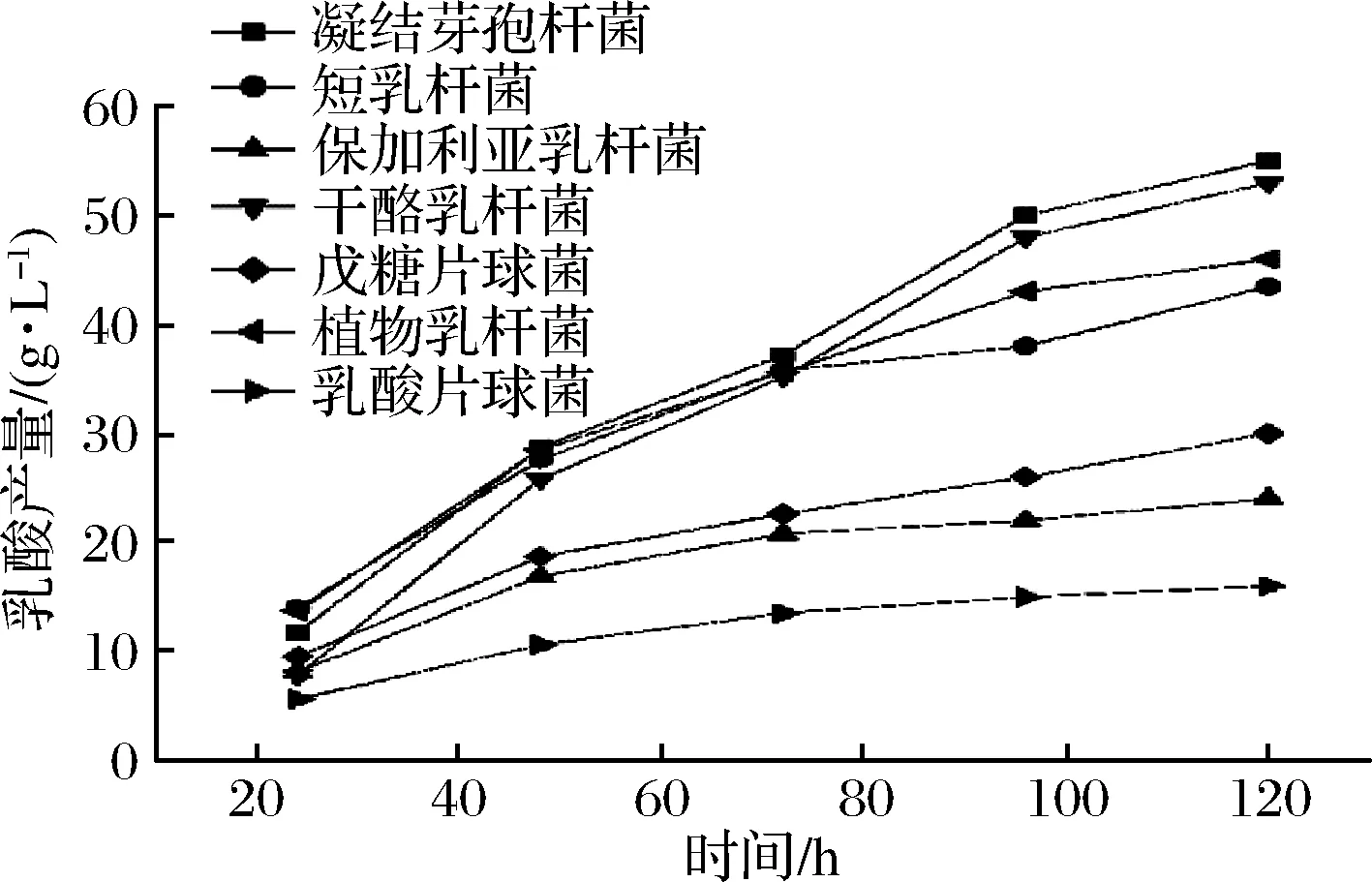
图2 不同菌株在玉米发酵培养基上的乳酸产量Fig.2 Lactic acid production of various strains on corn fermentation medium
由图1、图2可知,通过乳酸产量的变化,我们发现各乳酸菌在不同原料的发酵培养基上的发酵性能具有很大差别。其中乳酸片球菌P1,保加利亚乳杆菌L5,戊糖片球菌P5三株乳酸菌发酵5 d时乳酸产量较低,均低于30 g/L,而另外4株乳酸菌(凝结芽孢杆菌B1、干酪乳杆菌L1、短乳杆菌L3、植物乳杆菌L8)均有较高乳酸产量,其中凝结芽孢杆菌B1和干酪乳杆菌L1的产酸量最高,发酵5 d能达到63.15 g/L,这说明凝结芽孢杆菌B1和干酪乳杆菌L1相较于其他乳酸菌具有更高的发酵速度,若继续延长时间,发酵能进行彻底。而通过比较2种原料(玉米、大米)的乳酸发酵培养基,发现各乳酸菌在以大米为原料的发酵培养基上进行发酵时的乳酸产量略高于以玉米为原料的发酵培养基产酸量,但差别并不大。
2.2.1.2 不同菌株在2种原料(玉米、大米)的发酵培养基上产L/D-乳酸比例的比较
将7株乳酸菌按照1.3.2的方法接种到两种不同原料的发酵培养基上,发酵5 d,产L-乳酸、D-乳酸比例如表2、表3所示。
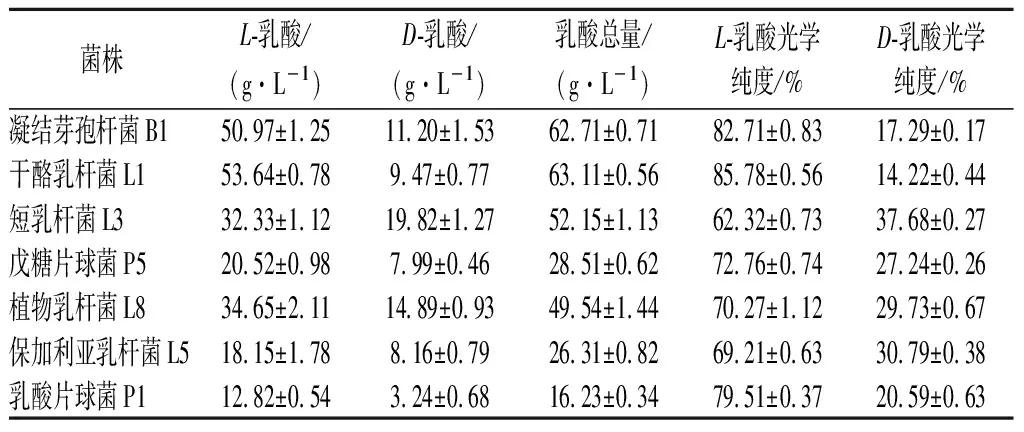
表2 不同菌在大米发酵培养上产L/D-乳酸的比例Table 2 Proportion of L/D-lactic acid produced by various strain on rice fermentation medium
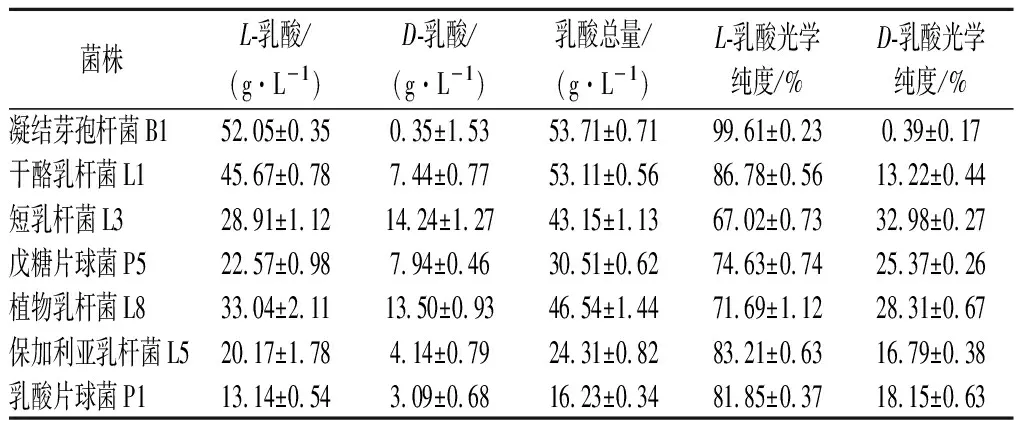
表3 不同菌在玉米发酵培养基上产L/D-乳酸的比例
由表2可知,各菌株在以大米乳酸发酵培养基上发酵5 d,对发酵液进行L-乳酸、D-乳酸的测定,各菌株都能产L-乳酸和D-乳酸,并以产L-乳酸为主,D-乳酸所占比例较小,众所周知,大多数乳酸菌中同时存在着D-LDH和L-LDH,由于ldhD和ldhL基因表达水平的不同,从而合成相应构型的乳酸。而在这7种乳酸菌中其中以凝结芽孢杆菌B1和干酪乳杆菌L1所产L-乳酸比例较高,均达到80 %以上,这与产L-乳酸菌种类型的相关报道相符。通过对比表3,各菌株在以玉米乳酸发酵培养基上进行发酵,相较于在大米培养基上发酵,我们发现各菌株还是以产L-乳酸为主,但产L-乳酸的比例均有增加,其中凝结芽孢杆菌B1产L-乳酸所占比例最高,达到了99.61 %,其次为干酪乳杆菌L1产L-乳酸比例为86.78 %,这可能与大米和玉米的营养物质有关,不同的营养物质对L-LDH和D-LDH的活力有影响,从而对ldhD和ldhL的基因表达量产生影响。综上结合产乳酸总量和L-乳酸所占比例,我们初步选择凝结芽孢杆菌B1和干酪乳杆菌L1为高产L-乳酸菌株,以玉米乳酸发酵培养基为最适培养基进行乳酸发酵,以供后续实验。
2.2.2 初始糖度对菌株发酵性能的影响
2.2.2.1 初始糖度对菌株产酸能力的影响
将凝结芽孢杆菌B1和干酪乳杆菌L1按照1.3.2的方法接种于不同初始糖度的以玉米为原料的乳酸发酵培养基,发酵13 d,乳酸产量的变化趋势如图3、图4所示。
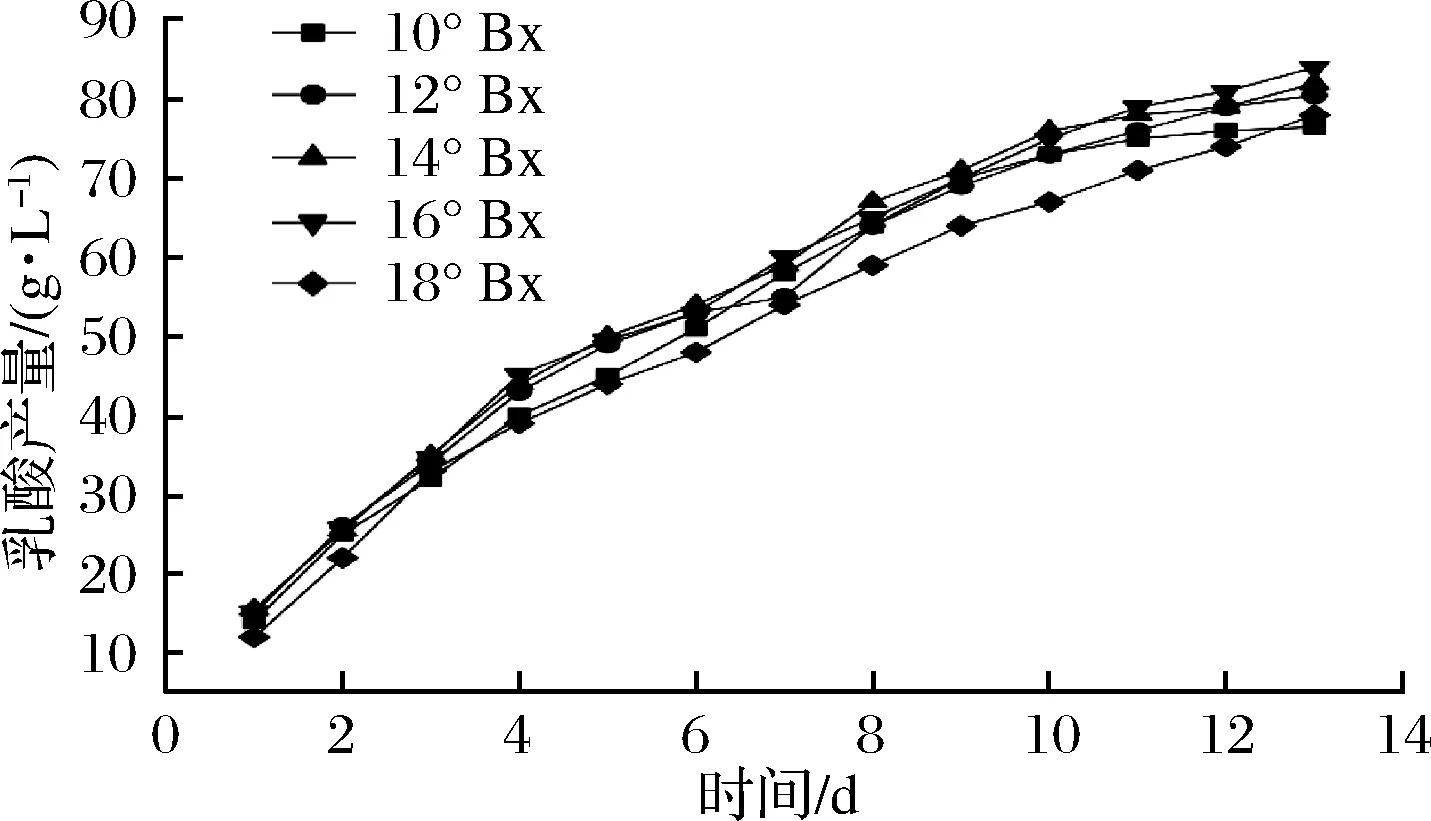
图3 初始糖度对干酪乳杆菌L1产酸量的影响Fig.3 Effect of different initial sugar content on acid yield of Lactobacillus casei L1
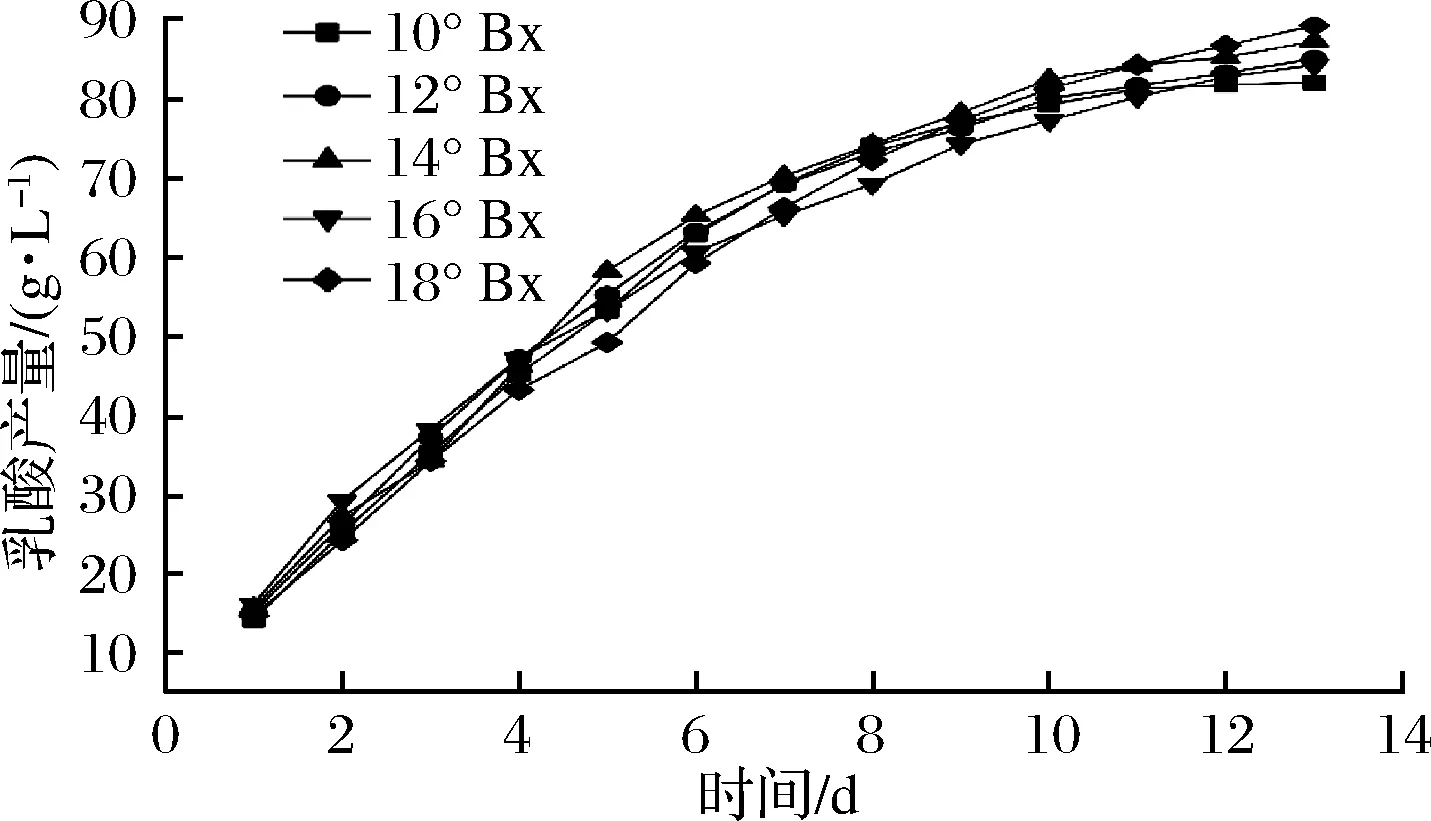
图4 初始糖度对凝结芽孢杆菌B1产酸量的影响Fig.4 Effect of different initial sugar content on acid production of Bacillus coagulans B1
由图3、图4可知,随着发酵时间的增加,产乳酸的速率逐渐减小,并且随着初始糖度的增加,发酵速率也逐渐较小,干酪乳杆菌L1与凝结芽孢杆菌B1相比,干酪乳杆菌L1的发酵速率较低,随着初始糖度的增加,凝结芽孢杆菌B1的产酸量随之增加,在初始糖度18 °Bx的发酵培养基上发酵13 d产酸量达到89.19 g/L,但发酵速率也随之减弱,可见在乳酸产量上,凝结芽孢杆菌B1相较于干酪乳杆菌L1具有更高的发酵能力。
2.2.2.2 初始糖度对菌株产不同构型乳酸的影响
将干酪乳杆菌L1和凝结芽孢杆菌B1按照1.3.2的方法接种于以玉米为原料的发酵培养基上,发酵13 d,产L-乳酸和D-乳酸比例如表4、表5所示。
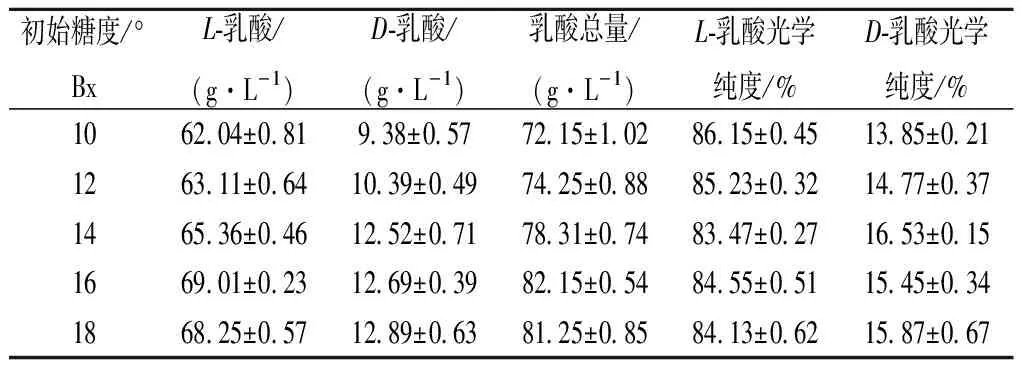
表4 初始糖度对干酪乳杆菌L1产L/D-乳酸比例的影响Table 4 Effect of different initial sugar content on the ratio of L/D-lactic acid produced by Lactobacillus casei L1
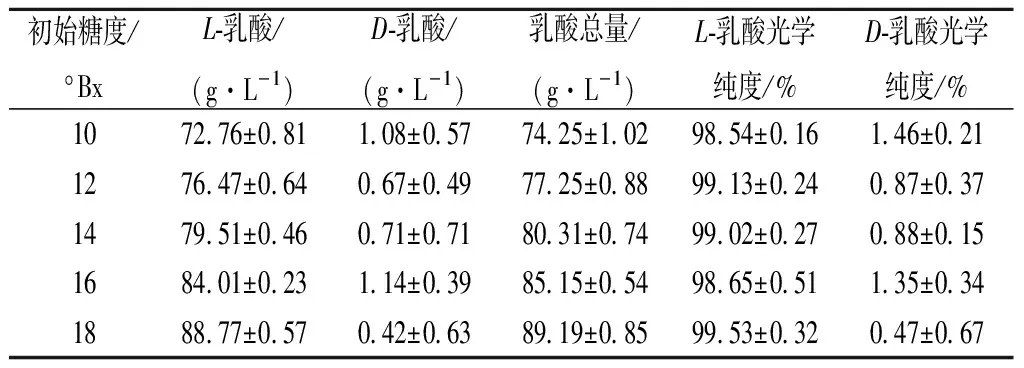
表5 初始糖度对凝结芽孢杆菌B1产L/D-乳酸比例的影响Table 5 Effects of different initial sugar content on the ratioof L/D-lactic acid produced by Bacillus coagulans B1
由表4、表5可知,随着初始糖度的增加,干酪乳杆菌L1和凝结芽孢杆菌B1所产乳酸中L-乳酸所占比例基本一致,均以产L-乳酸为主,其中干酪乳杆菌L1所产L-乳酸的比例稳定在85 %左右,而凝结芽孢杆菌B1产L-乳酸的比例稳定在99 %,说明初始糖度的变化对产L-乳酸的比例没有明显影响。
2.2.3 高产L-乳酸工艺的初步确定
通过对7株乳酸菌发酵性能和产L-乳酸比例的比较,初步确定最佳工艺为:筛选得到凝结芽孢杆菌B1接种于糖度为18 °Bx的玉米乳酸发酵培养基中,静置发酵13 d,乳酸总量可达89.19 g/L,其中L-乳酸所占比例高达99 %。
3 结论
本研究发现相较于D-乳酸,黑曲酯化酶对L-乳酸具有更强的酯化能力,通过对7株乳酸菌在不同原料,不同初始糖度的发酵培养基上发酵性能的比较,发现各菌株在玉米发酵培养基上发酵所产L-乳酸比例明显高于大米发酵培养基,进一步发现不同初始糖度对产L-乳酸的比例没有明显影响,并初步确定了白酒用产L-乳酸工艺:以凝结芽孢杆菌B1为出发菌株,接种于糖度为18 °Bx的玉米乳酸发酵培养基中,静置发酵13 d,乳酸总量可达89.19 g/L,其中L-乳酸所占比例高达99 %。为今后乳酸菌的强化发酵和高乳酸乙酯调味酒的制备奠定了基础。

