聚赖氨酸与魔芋葡甘聚糖复配对海鲈鱼片的保鲜效果
张海燕,吴燕燕,杨少玲,杨贤庆,林婉玲,黄卉
1 (中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,广东 广州,510300)2 (广东海洋大学 食品学院,广东 湛江,524088)
海鲈(Lateolabraxjaponicas)是我国重要的海水鱼类之一[1],2017年海鲈养殖产量已达15.7万t[2]。海鲈鱼肉质洁白,骨刺较少,蛋白质含量高,且必需氨基酸和鲜味氨基酸含量丰富,也含有较高的不饱和脂肪酸及微量元素[3-4],是人类获取优质蛋白质的理想食材[5-6]。然而,由于腐败微生物的生长以及内源性酶促进肌肉蛋白水解、脂肪类物质的水解及氧化等,造成新鲜的海鲈鱼极易腐败变质,所以,新鲜海鲈鱼较短的货架期阻碍了产品的流通销售,也降低了其商业价值[7]。因此,提高鲜海鲈鱼的保鲜品质,延长其货架期是当前产业急需解决的问题。ε-聚赖氨酸(polylysine,PL),是通过羧基和ε-氨基之间的异肽键连接的一种天然存在的均聚物[8]该化合物可溶于水,可食用,对人体无毒,在酸性条件下具有热稳定性,并且对革兰氏阳性和革兰氏阴性细菌,酵母和真菌具有广谱抗菌活性[9]。在日本、韩国和美国,ε-PL被广泛应用于食品防腐剂,如方便米饭、湿熟面条、熟菜、海产品、酱类、酱油、鱼片和饼干等的保鲜防腐中[10-15]。
魔芋葡甘聚糖(konjac glucomannan,KGM)是一种从魔芋的块茎中分离出来的水溶性多糖(膳食纤维),具有降低甘油三酯,胆固醇,血糖,血压和体重,促进肠道活动和人体免疫增强功能等特点[16-19]。此外,由于具有良好的吸水性,稳定性,成膜性,增稠性和乳化性,KGM还被用作食品添加剂[20],广泛用于魔芋果冻,面条,豆、腐等药材和传统食品等[21]。同时,KGM也是一种具有良好的持水能力、流变性和抗菌性的经济、高效、天然的食品保鲜剂[22-30],在果蔬保鲜中应用广泛,鲜见于其他食品如水产品、肉制品及蛋制品等的应用。
本研究在前期试验基础上,采用ε-PL与KGM复配后用于海鲈鱼片的保鲜中,研究其对冷藏期间海鲈鱼片的保鲜效果,以期为海鲈鱼片的保鲜提供技术支持,从而为企业应用提供理论参考。
1 材料与方法
1.1 原料与试剂
鲜活海鲈鱼,购自广州华润万家超市,每尾约400~600 g,体长25~35 cm。ε-PL,购自上海麦克林生化有限公司。KGM,购自合肥博美生物科技有限公司。
高氯酸、三氯乙酸、三氯甲烷、2-硫代巴比妥酸、NaCl等,均为国产分析纯,购于广州化学试剂厂;平板计数琼脂(PCA),青岛高科园海博生物科技有限公司。
1.2 仪器与设备
SW-CJ-1FD超净工作台,苏州净化设备有限公司;SQ510C立式压力蒸汽灭菌锅,日本YAMATO;SPX-320生化培养箱,宁波江南仪器厂;BS124S型电子天平,德国Sartorius公司;THZ-D台式恒温振荡器,太仓实验设备厂;T50型均质机,德国IKA工业设备公司;IS126pH计,上海仪迈仪器科技有限公司;3K30台式高速冷冻离心机,德国Sigma公司;UV2550型紫外-可见分光光度计,日本SHIMADZU公司。
1.3 实验方法
1.3.1 样品处理
选取大小规格差不多的海鲈鱼,去除鱼鳞与内脏后,沿着脊椎骨剖开取出鱼片,鱼片用水冲洗干净,沥水,并对样品进行分组处理。
ε-PL与KGM复配处理组组(P+K组):经过ε-PL与KGM复配液浸泡(经前期预实验,复合保鲜液制备为:含0.4%(质量分数)的ε-PL与含0.3%的KGM);PL组:仅使用0.4%(质量分数)的ε-PL浸泡;KG组:仅使用0.3%(质量分数)的KGM浸泡;对照组:在蒸馏水中浸泡。
各组在(4±1)℃下,料液比为1∶3下浸泡15 min后,将鱼样单独装袋并放置于4 ℃恒温冰箱中冷藏,随后分别在第0、3、6、9、12 天取样测定其微生物与各项理化指标。
1.3.2 汁液流失率测定
汁液流失率是在贮藏过程中流失的汁液重量占鱼片初始重量的百分比,按照公式(1)计算:
(1)
式中:M′,汁液流失率,%;M0,包装袋的质量,g;M1,包装袋、汁液和鱼肉的质量,g;M2,包装袋和汁液的质量,g。
1.3.3 感官评定
根据文献[4]方法略有修改,对海鲈鱼片试验样品进行感官评定,样品随机编码,并选取6名品评定,评定前,先向品评员提出具体的要求,让品评员对评价标准有一致的理解,评定3次且品评员之间不互相交换意见。品评员对样品的外观、异味、色泽和质地4个方面进行评价,最后将评分进行统计分析,具体评分标准见表1。
1.3.4 pH测定
参考HE等[31]方法。称取5 g鱼肉,加入45 mL的蒸馏水,用高速离散均质机均质1 min(10 000 r/min)后,静置30 min后用pH计测定。

表1 感官评分标准Table 1 The standard of sensory score
1.3.5 硫代巴比妥酸值(TBARS)测定
参考CHAIJAN等[32]的方法。准确称取海鲈鱼片鱼肉5.00 g,加入三氯乙酸溶液(7.5%,含0.1%EDTA-Na2)25 mL,振摇 30 min后用双层滤纸过滤2次,取5 mL上清液加入 2-硫代巴比妥酸溶液(0.02mol/L)5 mL,沸水浴保温 40 min后冷却至室温,然后加入5 mL三氯甲烷充分振摇数分钟后静置,待溶液分层后测上清液在 532 nm处的吸光值,以5 mL蒸馏水代替5 mL上清液作为空白对照。丙二醛(malondialdehyde,MDA)含量通过 1,1,3,3-四乙氧基丙烷标准曲线标定计算得出,用以表征TBARS,结果表示为mg/kg。
1.3.6 挥发性盐基氮值(TVB-N)测定
按照GB 5009.228—2016《食品中挥发性盐基氮的测定》进行测定[33]。
1.3.7 菌落总数的测定
按照GB 4789.2—2016《食品微生物学检验-菌落总数测定》进行测定[34]。
1.3.8 质构测定
参考徐军方等[35]方法。将样品切成20 mm×20 mm×10 mm肉块。采用TexturePro质构分析仪,每个样品平行测定6次,测定参数:测试前速率2.00 mm/s,测试速率1.00 mm/s,测试后速率1.00 mm/s,压缩程度50%,停留时间间隔5 s,触发力5.0 g,测试探头为TA44。
1.3.9 数据分析
每个样品设 3个平行,采用Origin 8.5和SPSS 20.0 软件进行数据分析,显著性差异采用Duncan多重比较检验分析,结果以平均值±标准偏差表示,P<0.01为极显著,P<0.05 为显著,P>0.05 为不显著。
2 结果与分析
2.1 海鲈鱼冷藏期间汁液流失率的变化
汁液流失率是鱼肉在贮藏过程中衡量鱼肉蛋白持水性的重要指标[35]。由图1可知,各处理组的海鲈鱼片在贮藏过程中,汁液流失率均随时间的延长而增加,处理组鱼样的汁液流失率升幅较对照组缓慢, PL组和K+P组较其他组汁液流失率升幅最为缓慢,且在第12天时K+P组汁液流失率最小。张楠楠等[36]研究也发现了相似的趋势,他们采用ε-PL与迷迭香提取物复配液处理大黄鱼,发现贮藏期间处理组持水力显著高于(P<0.05)对照组。这主要是由于ε-PL能明显减缓微生物的繁殖速度,抑制蛋白质的降解速率,肌原纤维破坏小,能维持鱼肉较高的持水力。魔芋葡甘聚糖也具有良好的持水能力,这与桑鲁燕等[22]、陈红惠等[37]研究分析结果相似。由此说明,K+P处理能降低汁液流失,延缓鱼肉品质下降。

图1 海鲈鱼冷藏期间汁液流失率的变化Fig.1 Changes of drip loss rate during storage of Lateolabrax japonicas注:不同小写字母表示具有显著性差异(P<0.05)。下同。
2.2 海鲈鱼冷藏期间感官评分的变化
根据鱼肉的色泽、气味、肌肉弹性和组织状态来反应其感官品质的变化。由图2可知,随着贮藏时间的延长,海鲈鱼片的感官分值呈下降趋势且有所差异。贮藏前期总体分值下降缓慢,从第3天起,随微生物的繁殖速度加快,使得鱼肉中脂质氧化、蛋白质分解成低分子化合物,产生不良风味,表面黏液增加,发生色变。但处理组的感官分值始终高于对照组,在第6天时对照组已低于80分,而KGM组、PL组、K+P组分值分别为81、87、85分。在第12天时,处理组分值很接近都处于60分左右,对照组则达到最低分为35分,此时鱼肉腐烂的气味和颜色的变化使得对照组感官评分明显下降,这与后期测得的TVB-N结果吻合。类似的研究表明,经ε-PL、壳聚糖、ε-PL和壳聚糖处理的凡纳滨对虾在4℃贮藏15 d,样品的初始评分没有显著差异,但此后对照组的接受率显著下降,ε-PL和壳聚糖处理组有效延长了凡纳滨对虾的保质期。这主要与ε-PL的广谱抗菌能力有关,同时也归功于魔芋葡甘聚糖作为添加剂具有提高产品质量、增强感官品质的特点[38-39]。可见K+P处理组能有效抑制海鲈鱼微生物生长,保持较好的感官品质。

图2 海鲈鱼冷藏期间感官评分的变化Fig.2 Changes of sensory score during storage of Lateolabrax japonicas
2.3 海鲈鱼冷藏期间pH值的变化
pH值是判定水产品品质优劣的重要指标之一[40]。通过不同方式处理海鲈鱼片后,pH均有不同程度的变化,海鲈鱼片经不同方式处理pH变化如图3所示。由图3可知,各组样品的pH值呈先降后升的趋势,前期pH降低的原因是:鱼体僵硬至自溶解僵转变阶段,糖原无氧降解形成乳酸及其他途径产生酸类物质,以及ATP在酶的作用下分解产生H+,导致pH值下降。从第6天后,对照组样品的pH增长趋势比处理组样品高,且对照组pH显著高于各处理组(P<0.05)。这与张涵等研究的结果类似[41-42]。pH值升高主要是随着时间的延长,由于内源酶和微生物的作用,蛋白质分解产生胺类物质,造成碱性物质积累,从而使鱼片的pH升高。到第12天时,KGM组与K+P处理组的pH较低,这表明,ε-PL与KGM复合对于鱼肉内微生物的生长有明显的抑制作用,使得碱性产物的积累变得更加缓慢,有效地控制了pH的变化,从而达到保水保鲜效果。

图3 海鲈鱼冷藏期间pH值的变化Fig.3 Changes of pH during storage of Lateolabrax japonicas
2.4 海鲈鱼冷藏期间TBA值的变化
TBA值是评价脂肪氧化程度的重要指标,脂肪酶水解和自动氧化是引起脂肪氧化的主要因素,在新鲜鱼类的储存过程中,脂质氧化的原因很多,空气中的氧气可以通过使氧气与肌肉成分反应而成为氧化过程的促进剂,另一方面,鱼肉中的促氧化剂从各种破裂的细胞器中释放和扩散[43]。不同保水保鲜方式处理海鲈鱼片后TBA变化如图4所示。随着贮藏时间的延长,TBA值逐渐上升,且对照组上升趋势明显高于其他处理组,在贮藏前期(前3 d),各处理组的TBA值变化并不明显,但3 d后,对照组、KGM组、PL组的TBA值上升明显,而K+P组在前9 d TBA值无显著变化。其中对照组和PL组样品TBA值在冷藏9 d后分别增加至0.865 mg/kg和0.773 mg/kg,鱼肉呈现不同程度的酸败现象。对照组样品TBA值始终高于经处理的另3组,在第12天时TBA值已达到0.957 mg/kg,而KGM组、PL组、K+P组分别为0.822、0.794、0.765 mg/kg,可见K+P组样品中的TBA值显著低于其他处理样品中的TBA值(P<0.05)。其他相关研究结果表明似[44-45]。因此,ε-PL与KGM复合是一种有效的防氧保护剂,在鱼的保存中起到抗氧化作用,能减缓海鲈鱼片酸败速度,但ε-PL与KGM复合保鲜的作用机理还尚未有深入研究,有待于未来进一步研究。

图4 海鲈鱼冷藏期间TBA值的变化Fig.4 Changes of TBA during storage of Lateolabrax japonicas
2.5 海鲈鱼冷藏期间TVB-N值的变化
TVB-N是动物性食品所含蛋白质在腐败过程中受细菌和酶的作用而分解产生的碱性含氮物质,是评定水产品腐败程度的重要化学指标[35]。由图5可知,随着冷藏时间延长,各处理组样品的TVB-N值逐渐增大,这与前面的TBA值总体变化趋势相似。样品在贮藏前期,各组样品的TVB-N值增长缓慢,贮藏前期主要由于鱼肉僵直收缩释放的蛋白酶使蛋白质分解为胺类物质,使其上升缓慢。随着贮藏时间的延长,鱼肉处于自溶阶段,微生物大量繁殖,产生胞外蛋白酶,使氨基酸发生脱酸脱羧反应,生成大量胺类物质,导致其TVB-N值上升明显。从第9天开始对照组、KGM组、PL组与K+P组TVB-N值的差异变得显著,且对照组值明显上升,且高于其他处理组,到第12天时对照组的TVB-N值达到了最大35.19 mg/100g,而KGM组、PL组与K+P组处理组TVB-N值分别达到25.02、24.48、20.25 mg/100g,尤其是K+P组处理组达到了最低。这一研究结果与CAI等[3]研究结果一致[46],经ε-PL与海藻酸钠复合处理的日本海鲈在贮藏12 d时TVB-N值处于最低。ε-PL处理冷却猪肉后,挥发性盐基氮值的上升得到了一定的抑制[47]。ε-PL能够很好地抑制细菌的生长并且也降低细菌对蛋白质的分解,进而减缓了挥发性盐基氮含量的变大,因此,ε-PL和KGM显著着降低了TVB-N含量,两者复配能有效延缓海鲈鱼蛋白质品质变化。
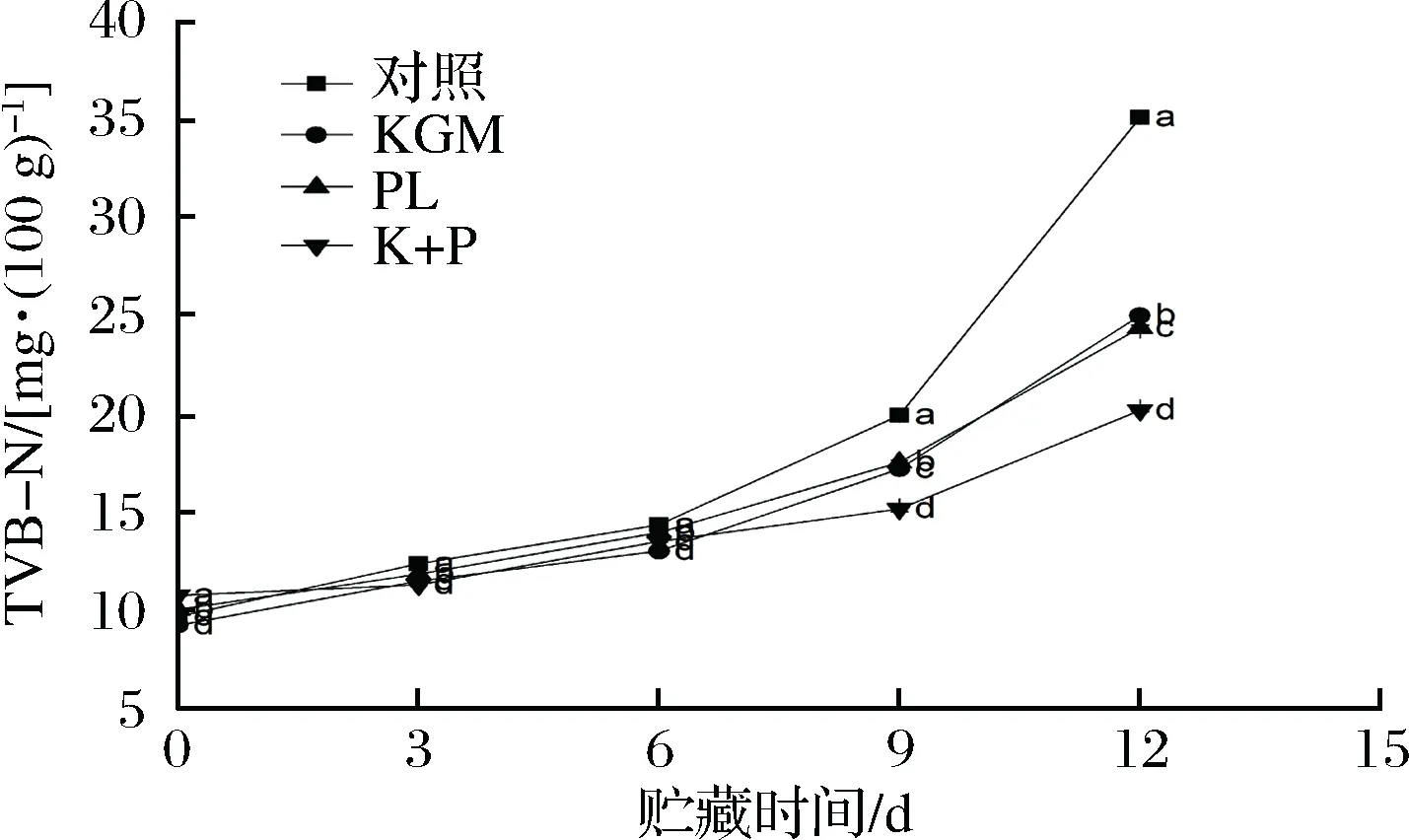
图5 海鲈鱼冷藏期间TVB-N值的变化Fig.5 Changes of TVB-N during storage of Lateolabrax japonicas
2.6 海鲈鱼冷藏期间菌落总数的变化
在贮藏过程中海鲈鱼菌落总数变化如图6所示,贮藏初期对照组与处理组样品的菌落总数差异并不明显,随着贮藏时间的延长,样品的菌落总数均呈上升趋势,其中KGM组、PL组与K+P组样品菌落总数随着冷藏时间延长而缓慢增加,数量始终低于对照组,0~6 d菌落总数基本保持不变,且数量未超过4.00 lg CFU/g,且在第6天时菌落总数分别为3.88、3.35、3.52 lg CFU/g,属于一级鲜度,在6~12 d时开始逐渐增加,而对照组在第3 d菌落总数就达到了4.00 lg CFU/g,超过了一级鲜度标准。在整个贮藏过程中对照组和KGM组样品菌落总数数量显著高于和PL组和K+P组。冷藏第9 d时,对照组菌落总数已超过6.00 lg CFU/g高达6.34 lg CFU/g超过了国家对于生鲜鱼肉的二级鲜度标准,而KGM组、PL组与K+P组样品菌落总数分别为5.61、5.06、5.36 lg CFU/g均未超过二级鲜度标准。这与CAI等的研究结果相似。表明ε-PL对微生物有明显的抑制作用,同时,KGM和ε-PL复合作用于鱼肉,在鱼体表面形成保护膜,阻止微生物的进一步侵染,更加有效的抑制微生物生长繁殖。由此表明两者复配具有较好的协同作用。

图6 海鲈鱼冷藏期间菌落总数的变化Fig.6 Changes of total bacteria count during storage of Lateolabrax japonicas
2.7 海鲈鱼冷藏期间质构的变化
海鲈鱼在贮藏过程中会迅速丧失硬度以致保质期较短。由图7可知,随着贮藏时间的延长,内源性自溶酶对鱼蛋白不断降解以及微生物的污染,导致鱼肉硬度不断下降,处理组与对照组硬度的变化趋势也有着明显的差异,贮藏期前6d,各组硬度下降缓慢,但处理组下降速度明显低于对照组,从第6天开始,各组硬度下降速度加快,但处理组的硬度始终高于对照组,对照组在贮藏第9天硬度损失了38.6%,而用KGM、PL与K+P处理的鲈鱼硬度损失程度较低。当贮藏至第12天时,对照组硬度损失达到了最大为59.4%,而KGM、PL与K+P处理组硬度损失相差不大,分别损失了39.8%、41.9%、34.5%,这里KGM组和K+P处理组的样品表现出最小的硬度损失。这一结果可能与KGM的性质有关,有研究表明KGM不仅可以减少果蔬内部水分的蒸发[39],也可以保持果蔬的硬度以达到延长保存期的目的,还可以提高肉糜的硬度、弹性和咀嚼性[29]。因此魔芋葡甘聚糖与ε-PL复合能更好地保持海鲈鱼的硬度。

图7 海鲈鱼冷藏期间质构的变化Fig.7 Changes of Hardness during storage ofLateolabrax japonicas
3 结论
在该研究中,将ε-PL与KGM复配后应用于在(4±1)℃下贮藏的海鲈鱼片,并在贮藏过程中测定pH值、汁液流失率、硬度、硫代巴比妥酸值、挥发性盐基氮值、菌落总数和感官品质等指标的变化情况。结果表明,随贮藏时间的延长,海鲈鱼片的综合品质呈下降趋势。其中经ε-PL与KGM(K+P)复合处理的海鲈鱼片冷藏第9天时,对照组菌落总数高达6.34 lg CFU/g超过了国家对于生鲜鱼肉的二级鲜度标准,而K+P组样品菌落总数为5.36 lg CFU/g未超过二级鲜度标准,TVB-N和TBA值分别为15.20 mg/100g和0.598 mg/kg,未经处理的样品在6d后出现腐败现象,TVB-N值达14.40 mg/100g,TBA值达0.755 mg/kg。因此,ε-PL与KGM组成的复配液能明显抑制海鲈鱼片在贮藏期间的氧化变性与微生物的繁殖速率,具有较好的抑菌和抗氧化的保鲜效果。所以,ε-PL与KGM复配可为海鲈鱼的保鲜提供一种新的方法。

