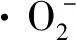双歧杆菌BB12胞外多糖发酵条件优化及抗氧化活性研究
谢莹,蔡国林,刘逸凡,陆健
1(吉林化工学院 生物与食品工程学院,吉林 吉林,132022) 2(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122) 3(江南大学 生物工程学院,江苏 无锡,214122) 4(粮食发酵工艺与技术国家工程实验室(江南大学),江苏 无锡,214122)
双歧杆菌作为益生菌,其营养性和治疗作用已被广泛认可。主要包括平衡肠道菌群,改善乳糖耐受性,降低血液中的胆固醇水平及促进维生素B族的生物合成等[1-3]。迄今为止,一些细菌胞外多糖(exopolysaccharides, EPS)已经进行了商业化生产,并用于食品、药品及保健品等领域,如黄原胶、结冷胶、右旋糖苷和透明质酸等[4],但双歧杆菌等常用益生菌的胞外多糖还鲜有商业化应用的报道。研究表明双歧杆菌具有益生功能的主要分子机制依赖于自身分泌的胞外多糖[5]。益生菌胞外多糖具有调节肠道菌群、抗氧化[6-7]、改善和提高免疫力[8]、抗炎症[9]、抗肿瘤[10-11]以及降低胆固醇等益生功能[12]。本研究主要对双歧杆菌BB12胞外多糖的发酵条件进行了优化,并通过体外试验进行了胞外多糖抗氧化活性的研究,为开发益生菌胞外多糖在医药、食品和保健品中的应用提供理论依据。
1 材料与方法
1.1 菌种
双歧杆菌(Bifidobacteriumanimalsssp.lactis)BB12,江南大学食品学院提供。
1.2 培养基
改良MRS培养基:胰蛋白胨20 g,葡萄糖20 g,柠檬酸三铵2 g,乙酸钠5 g,吐温-80 1 mL,K2HPO42 g,MgSO4·7H2O 0.2 g,MnSO4·H2O 0.05 g,L-半胱氨酸盐酸盐1 g,加蒸馏水定容至1 L,醋酸调pH值为7。
1.3 主要试剂
酵母提取物、蛋白胨,上海生工生物工程有限公司;FeCl3、三氯乙酸、FeSO4、K3Fe(CN)6、KH2PO4、K2HPO4均为分析纯,北京化工有限公司;邻苯三酚、蒽酮、H2O2、Tris等试剂,国药集团化学试剂有限公司。
1.4 双歧杆菌胞外多糖发酵单因素试验
1.4.1 初始pH值对双歧杆菌胞外多糖发酵的影响
将双歧杆菌接种于改良MRS培养基中,调节培养基的初始pH值分别为6、6.5、7、7.5、8和8.5,37 ℃培养96 h,透析除去发酵液中的单糖和寡糖后测定发酵液胞外多糖的产量。采用蒽酮-硫酸比色法测定,方法参照《生物化学实验》执行[13]。
1.4.2 培养温度对双歧杆菌胞外多糖发酵的影响
将双歧杆菌接种于改良的MRS培养基中,分别在25、30、33、37和41 ℃培养96 h,测定发酵液胞外多糖的产量,方法同上。
1.4.3 培养时间对双歧杆菌胞外多糖发酵的影响
将双歧杆菌接种于改良的MRS培养基中,在37 ℃分别培养48、60、72、84、96和108 h,测定发酵液胞外多糖的产量,方法同上。
1.5 响应面法优化双歧杆菌胞外多糖发酵条件
在单因素实验的基础上,选择初始pH(A)、培养温度(B)、培养时间(C)作为响应变量,以双歧杆菌胞外多糖含量作为响应值,设计3因素3水平响应面试验,利用Design Expert 8.0.6软件中的Box-Behnken Design(BBD)方法设计试验,并对试验数据进行分析,通过拟合得到二阶响应面模型,确定最优试验条件。
1.6 双歧杆菌胞外多糖的体外抗氧化活性研究
1.6.1 还原能力测定
参考WANG等[14]的方法并进行了改进。将10 g/L的K3Fe(CN)61 mL、0.2 mol/L磷酸盐缓冲液1.5 mL(pH 6.6)和纯化后的多糖样品(0.05、0.25、0.5、0.75、1 mg/mL)1 mL混匀后,50 ℃水浴20 min,向混合物中加入体积分数20%三氯乙酸1 mL,5 000 r/mim离心10 min,取上清,加入新鲜的1 g/L FeCl30.25 mL,混匀,700 nm波长处测定吸光度。去离子水和Vc分别作空白和阳性对照。
1.6.2 ·OH的清除作用
用H2O2-FeSO4体系研究胞外多糖对·OH的清除作用。将25 mmol/L FeSO41 mL、2 mmol/L水杨酸钠1 mL、6 mmol/L H2O21 mL和纯化后的多糖样品(0.05、0.25、0.5、0.75、1 mg/mL)1 mL混合均匀,于37 ℃水浴30 min,8 000 r/min离心3 min,510 nm波长处测定吸光度,用相同质量浓度的Vc作阳性对照[15]。·OH清除率的计算如公式(1)所示:
(1)

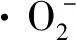
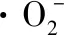
(2)
数据采用SPSS 17.0分析,重复3次实验取平均值,在图中以平均值±标准偏差表示,并进行单因素方差分析数据差异的显著性(P<0.05)。
2 结果与分析
2.1 单因素试验
2.1.1 初始pH值的影响
将双歧杆菌BB12接种于不同pH值的改良MRS培养基中,37 ℃培养96 h,发酵液胞外多糖的产量如图1所示。初始pH值在6~7.5时,发酵液胞外多糖产量升高显著(P<0.05),在7.5~8时,升高不显著(P>0.05)。当初始pH值为8时,胞外多糖的产量达到最大值(129.5±5) mg/L,然后略有下降。虽然pH值在7.5~8.5时胞外多糖产量变化不显著,但产量较高,可以通过后续的响应面试验进行优化,并对多因素间的显著性进行分析。
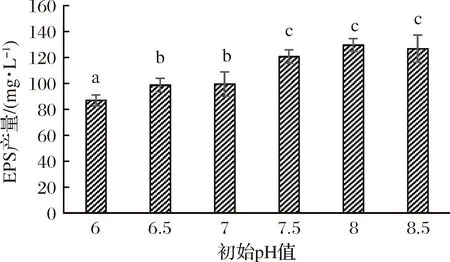
图1 不同初始pH对EPS产量的影响Fig.1 Effects of different initial pH on EPS yield注:不同的字母表示差异显著(P<0.05),下同。
2.1.2 培养温度的影响
双歧杆菌BB12在不同温度下培养96 h,发酵液胞外多糖的产量如图2所示。

图2 不同培养温度对EPS产量的影响Fig.2 Effects of different incubation temperature on EPS yield
培养温度对胞外多糖的产量具有双重影响。温度从25 ℃升高到37 ℃时,胞外多糖产量增加显著(P<0.05),当培养温度达到37 ℃,胞外多糖的产量最高为(109.8±4.9) mg/L,随后下降不显著(P>0.05)。因此,选择37 ℃为响应面优化试验的中心点。当培养温度较低时,胞内酶促反应速率下降,导致菌体生长和代谢缓慢。培养温度过高,细胞内酶活性又重新受到抑制,使代谢产生的多糖含量降低。
2.1.3 培养时间的影响
双歧杆菌BB12在37 ℃培养不同时间,发酵液胞外多糖的含量见图3。培养时间从48 h增加到96 h,胞外多糖的产量增加显著(P<0.05),培养96 h产量最高,为(125.8±6.5) mg/L,此时生长达到稳定期,代谢活跃,不断积累代谢产物。随着培养时间延长,产量反而下降,但不显著(P>0.05),可能由于双歧杆菌利用了自身产生的胞外多糖。因此,选择96 h为后续响应面优化试验的中心点,进一步研究不同因素间的交互作用。
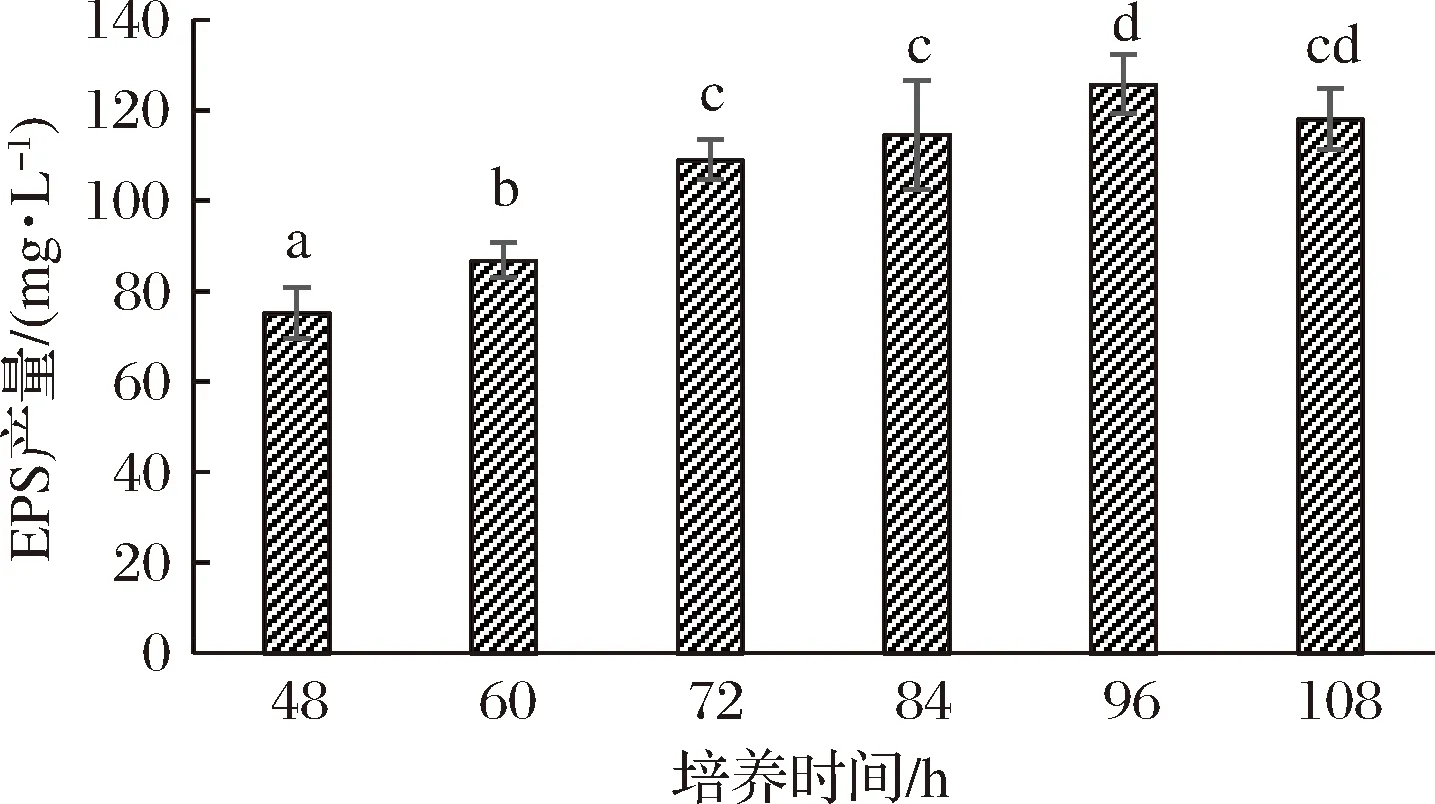
图3 不同培养时间对EPS产量的影响Fig.3 Effects of different incubation time on EPS yield
2.2 双歧杆菌BB12胞外多糖发酵条件的优化
在单因素试验的基础上,以初始pH值、培养温度和培养时间为自变量,胞外多糖产量为响应值,进行响应面优化,采用Design Expert 8.0.6软件设计试验方案,其结果见表1。
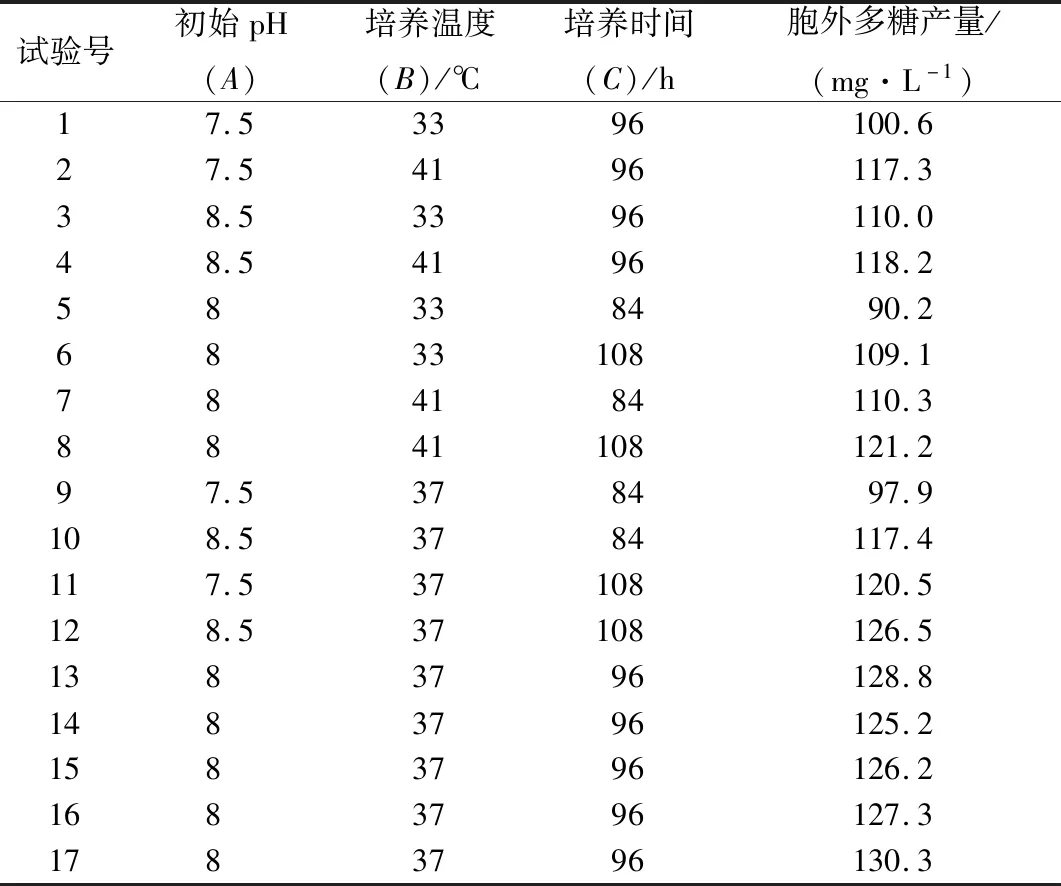
表1 响应面设计方案及结果Table 1 Design and results of response surface experiments
对表1数据进行分析,得到胞外多糖的产量与初始pH值(A)、培养温度(B)及培养时间(C)的二次多项回归方程:Y=127.56+4.48A+7.14B+7.69C-2.13AB-3.38AC-2.00BC-4.08A2-11.96B2-7.91C2。对回归模型进行方差分析和可信度分析,结果如表2所示。

表2 回归模型的方差分析Table 2 Variance analysis of regression model
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
由表2可知,模型F=31.74,P<0.000 1,说明该回归方程是极显著的。失拟项不显著,说明该模型模拟性较好,且R2分别为0.976 1和0.945 3,说明该模型具有较好的回归性。模型数据显示,一次项A、B、C及二次项B2、C2影响极显著(P<0.01),A2交互项AC影响显著(P<0.05),各因素的影响主次顺序:C>B>A,即培养时间>培养温度>初始pH值。利用Design Expert 8.0.6软件获得了各因素的最佳培养条件为:初始pH值为8.11、培养温度37.38 ℃、培养时间101.39 h,在此条件下获得的胞外多糖产量预测值为130.308 mg/L。为了验证响应面模型的有效性,考虑到实际操作的方便性,将各因素修正为初始pH值为8.0、培养温度37 ℃、培养时间101 h,在此修正的最佳培养条件下进行3次平行试验,得出双歧杆菌BB12胞外多糖的产量为(131.6±0.82) mg/L,经显著性分析,与响应面中心点的5组平行试验得到的胞外多糖产量(127.56±2.03) mg/L相比具有显著性(P<0.05),虽然只改变了培养时间,但培养时间为主要影响因素,而且初始pH与培养时间交互项影响显著,因此该优化条件是可行的。
2.3 双歧杆菌BB12胞外多糖的体外抗氧化活性
2.3.1 还原能力测定
粗胞外多糖分别经DEAE-Sepharose Fast Flow阴离子交换色谱柱和Sepharose CL-6B凝胶柱纯化后,得到1个吸收峰,收集对应的糖液冻干,进行体外抗氧化活性研究(该试验结果图没有在本论文中列出)。胞外多糖的还原力如图4所示,随着多糖含量的增加,还原力呈线性增加,当多糖初始质量浓度为0.75 mg/mL时,还原力趋于平稳,但低于Vc的还原力。

图4 EPS和Vc的还原能力Fig.4 Ferric reducing power of EPS and Vc
2.3.2 ·OH的清除作用
如图5所示,双歧杆菌BB12胞外多糖对·OH的清除效果较强,随着多糖浓度的增加清除率升高,多糖初始质量浓度在0~1 mg/mL的范围内,·OH的清除率高于Vc,50%清除浓度(IC50)为 0.47 mg/mL,比Vc低。
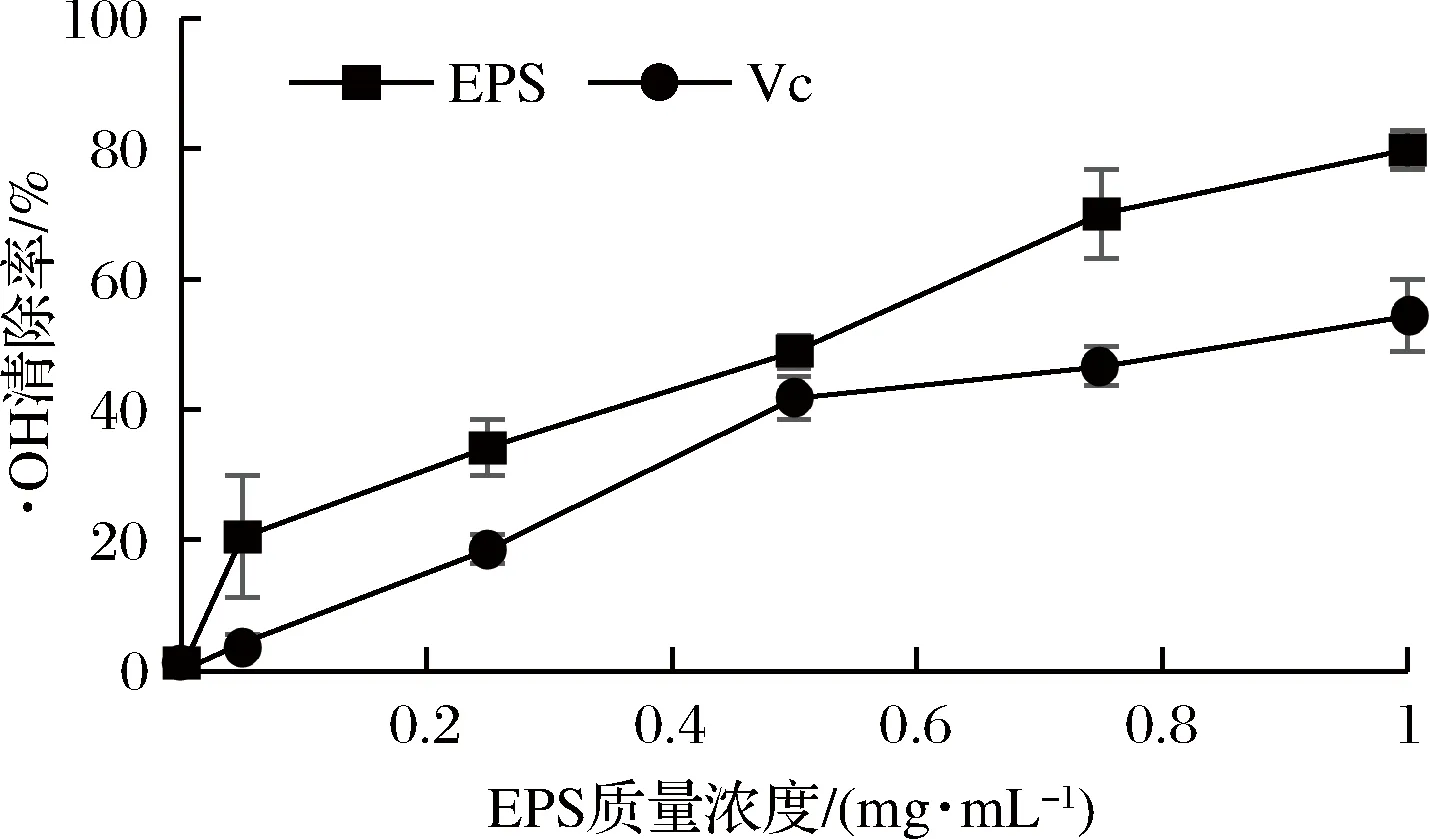
图5 EPS和Vc的·OH清除率Fig.5 ·OH scavenging activity of EPS and Vc



图6 EPS和Vc的清除率 scavenging activity of EPS and Vc
3 结论