个体化营养支持治疗对肿瘤患者营养状态及预后的影响分析
郝清源
(河南省驻马店市中心医院 临床营养科,河南 驻马店 463000)
肿瘤是一种临床常见病,多种致癌因素导致机体细胞异常增殖,从而形成局部肿块,其发病率及死亡率高,采用营养治疗可改善治疗效果及预后[1]。相当一部分的临床医生并不重视营养治疗,而且传统的营养支持方案单一,效果不尽如人意[2-3]。本次研究旨在观察个体化营养支持治疗对肿瘤患者的营养状态及预后的影响。
1 资料与方法
1.1 一般资料
选取本院住院部2018 年1 月至2018 年 4 月的恶性肿瘤患者80 例进行研究。纳入标准:①因恶性肿瘤于本院住院者;②经医院伦理委员会批准,且患者签署知情同意书。排除标准:①意识不清、言语障碍者;②合并其他严重的全身性疾病者。随机将80 例患者分为对照组与观察组,每组40 例。对照组男24 例,女16 例;年龄25~60 岁,平均 (48.32±2.67) 岁;病程为 2~7 年,平均(4.62±1.38)年;体重指数(body mass index,BMI)为 15.3~19.6,平均(16.42±2.53);其中肝癌 7 例,食管癌10 例,胃癌4 例,鼻咽癌6 例,直肠癌6 例,结肠癌3 例,乳腺癌4 例。观察组男22 例,女 18 例;年龄 27~61 岁,平均(49.28±2.54)岁,病程 2~8 年,平均 (4.57±1.52) 年;BMI 为14.5~19.1,平均(16.35±2.48);其中肝癌 6 例,食管癌9 例,胃癌6 例,鼻咽癌4 例,直肠癌5 例,结肠癌2 例,乳腺癌8 例。两组患者一般资料差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
对照组实施常规的营养支持,肠内营养(enteral nutrition,EN)采用能全力肠内营养液(纽迪希亚制药有限公司生产,国药准字H20030011),肠外营养(parenteral nutrition,PN)采用固定配方的营养袋,成分包括20%的脂肪乳250 mL、复方氨基酸注射液500 mL、10%的葡萄糖500 mL、肠溶性维生素、水溶性维生素及微量元素。
观察组采用个体化营养支持治疗,具体如下:①入院调查。采用整体营养状况主观评估(patient-generated subjective global assessment,PGSGA)[4]判断患者的营养状况,主要了解患者的体质、症状、活动能力及饮食习惯,计算每天通过饮食所获得的热量、蛋白质、脂肪、维生素以及微量元素的含量,热量需要=体温系数×活动系数×应激系数×基础代谢热量消耗(basic energy expenditure,BEE),利用 Harris-Benediet 计算 BEE;然后依据PG-SGA 表评估患者的营养状态,所有项目均为4 级评分法,计算总分判断患者是否需要营养支持以及进行何种营养支持。②营养教育。对患者进行营养知识科普,尤其是口腔进食无障碍者,通过聊天、视频、宣传手册等多种方式,对患者进行一定的膳食知识科普,帮助患者改正不良饮食习惯,树立正确科学的营养理念。③制定营养方案。根据患者的营养状况,依照按需补充的原则,主治医生与营养医生共同制定营养方案,主要是通过EN 支持及PN 支持补充营养,EN支持采用自配的营养液,其热量摄入中,糖类占50%~60%,脂肪占 20%~25%,氨基酸占 10%~15%,依照中国居民膳食营养素推荐摄入量表(Recommended Nutrient Intakes,RNIs)[5]中的标准摄入维生素和微量元素;PN 支持采用自配的营养袋,营养袋的组成为:50% 的葡萄糖注射液、20% 的脂肪乳注射液、8.5% 的复方氨基酸注射液、注射用脂溶性维生素、注射用水溶性维生素、注射用多种微量元素,所有营养液的使用均需保证卧床患者每日获取的热量达20~25 kcal/kg,有活动能力及放疗的患者达25~30 kcal/kg,同时根据患者的营养不良程度,加用精氨酸、核苷酸制剂等免疫营养制剂,行较大腹部手术者术前1 周采用EN 支持,特别是实施精氨酸、脂肪酸、核苷酸等进行免疫增强的EN 支持。④实施营养方案。所有的营养液均需当日配、当日用,依据患者耐受力及症状调整营养液的成分,根据调整液体总量,尽量使用EN 支持,必须使用PN 支持,随着病情变化,EN 由少到多、由稀到浓,PN 支持则逐渐停止。
1.3 观察指标
①生化指标:治疗前后采集患者静脉血,双缩脲法检测血清总蛋白(total protein,TP)、溴甲酚绿法检测血清白蛋白(albumin,ALB)、免疫扩散法检测前清蛋白(prealbumin,PA)和血清转铁蛋白(transferrin,TFN)。②营养状况:预后营养指数(prognostic nutritional index,PNI)、营养危险指数(nutritional risk index,NRI)、 营养评定指数(nutrition assessment index,NAI) 评估患者的营养状况。③预后情况:随访1 年,比较两组患者的生存率。
1.4 统计学方法
所得数据选用SPSS 19.0 软件进行统计学分析处理,计量资料以均数±标准差()表示,组间比较采用独立样本t检验,组内比较采用配对t检验;计数数据采用χ2检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 两组生化指标结果比较
治疗后,两组TP、ALB、PA 及TNF 水平均有显著升高(P<0.05),组间治疗后的上述指标差异有统计学意义(P<0.05)。见表1。
2.2 两组的营养状况结果比较
治疗后两组PNI、NRI 与NAI 水平均显著升高(P<0.05),组间治疗后的上述指标差异有统计学意义(P<0.05)。见表2。
2.3 两组预后情况比较
随访1 年,对照组死亡8 人,生存率为80%,观察组死亡5 人,生存率为87.5%,组间差异无统计学意义(χ2=0.827,P>0.05)。
表1 两组生化指标结果比较 ()
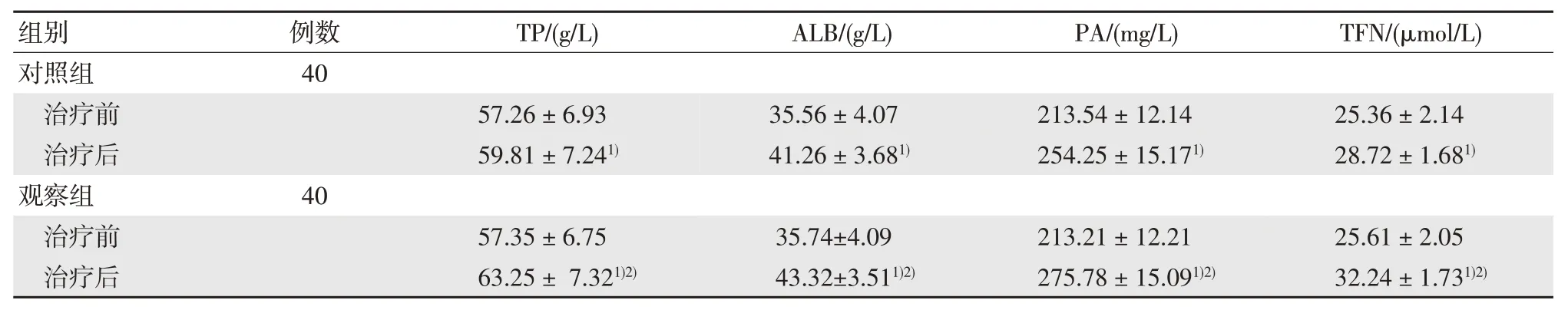
表1 两组生化指标结果比较 ()
注:1)与治疗前相比,P<0.05;2)与对照组相比,P<0.05。
?
表2 两组营养状况结果比较 ()
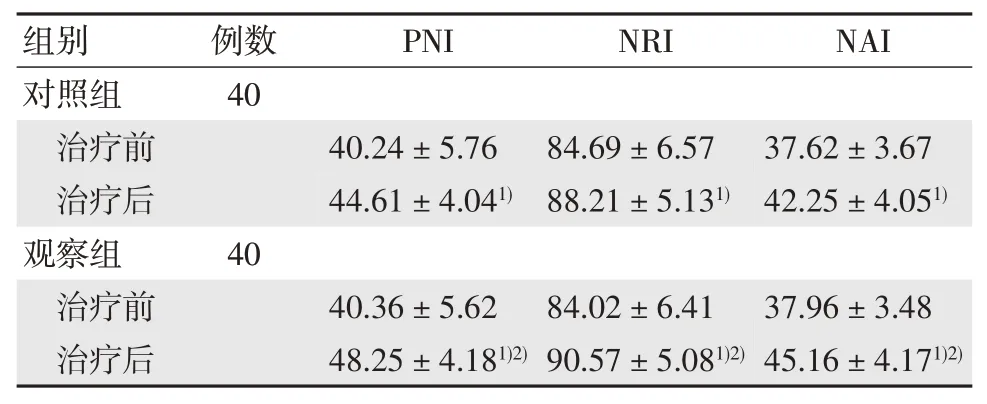
表2 两组营养状况结果比较 ()
注:1)与治疗前相比,P<0.05;2)与对照组相比,P<0.05。
?
3 讨论
肿瘤患者常出现营养不良症状,一方面是由于营养摄入不足,体内脂肪、蛋白质及碳水化合物等含量不足,另一方面,肿瘤的增殖会消耗机体的营养,使机体代谢异常,摄取营养的能力下降[6]。营养不良患者的生活质量较差,甚至延误手术时机,影响手术治疗效果,因此实施有效的营养治疗具有重要意义[7]。营养支持贯穿治疗前后,甚至会影响治疗方案,主要是肠内营养(EN)与肠外营养(PN),常规的营养支持治疗方案简单,配方固定,不能及时有效地补充机体营养需要[8]。本文中对照组实施常规营养支持,治疗后,TP、ALB、PA 及 TNF 水平均显著升高,PNI、NRI 与NAI 水平均显著升高,1 年生存率为80%,但观察组优于对照组,与其实施个体化营养支持有关。
个体化营养支持治疗是根据患者的自身病情,针对性制定营养方案,并根据病情变化及时调整,从而改善患者肠道功能与调节代谢,满足机体营养需要[9]。本文中观察组实施个体化营养支持,具体过程中,首先是进行营养不良的筛查与评估,掌握患者的饮食状况及营养情况,有助于准确判断患者是否需要营养支持治疗或怎样进行营养支持治疗,更好、更快地满足机体营养需要;其次是制定营养方案,依据患者的具体情况制定详细科学的营养方案,确保患者代谢平衡,能够获得充足的维生素、微量元素,从而提高身体状况,而主治医生与营养医生配合,可有效提高方案的科学性和可行性;第三,EN 支持是以口服或鼻饲的方式输入营养,安全性好,费用较低,PN 支持适用于胃肠道功能衰竭者,但PN 支持费用较高且可能增加感染风险,因而尽量使用EN 支持[10]。个体化定制营养液及营养剂,根据病情调整成分比例及用量,有益于保护胃肠道中的肠道菌群,调节肠道内的细胞分泌,缓解营养不良状况[11]。故观察组治疗后,TP、ALB、PA 及TNF 水平均显著升高,PNI、NAI 与NRI 均显著升高,上述指标组间差异显著,且1 年生存率为87.5%,证实个体化营养支持对改善肿瘤患者的营养状况及预后作用显著,安全性好。
综上所述,个体化营养支持治疗对肿瘤患者的营养状况及预后效果显著,值得在临床中进一步推广使用。

