蝉花提取物促进酿酒酵母寿命延长的机制研究
杨 力, 闫孟利, 刘 科
(四川大学生命科学学院 生物资源与生物环境重点实验室, 成都 610065)
1 引 言
活性氧(ROS)在细胞呼吸过程中被认为是分子氧的代谢物, 由于其不成对的电子而具有很强的反应活性[1-2].活性氧参与许多重要的细胞活动, 包括基因转录, 信号转导和免疫应答[3].低水平的ROS可能对机体产生有益作用, 但其过量产生涉及到各种慢性疾病和退行性疾病的发展, 例如癌症, 呼吸系统疾病, 神经退行性疾病和消化系统疾病[4-5].在生理条件下, ROS的浓度受到抗氧化剂的微妙调节.通过补充抗氧化剂能够减少内源性抗氧化剂消耗, 从而在一些临床研究中减轻相关的氧化损伤[6].天然抗氧化剂具有清除ROS功能, 对肿瘤、心脑血管疾病、神经退行性疾病等都有明显的防治作用[7-8].
该文选取了我国传统的中草药蝉花, 探究其作为一种天然抗氧化剂的潜力, 研究蝉花提取物(CCE)在促进酿酒酵母的氧化胁迫应答, 抑制H2O2诱导的细胞衰老中的作用[9], 研究发现CCE能够通过诱导抗氧化防御基因SOD2、CTT1的转录, 增强酿酒酵母的抗氧胁迫能力, 降低胞内活性氧的水平, 从而延长酿酒酵母的时序性寿命.该研究对以蝉花为代表的我国传统中药的开发和应用具有参考意义.
2 材料与方法
2.1 材 料
2.1.1 试剂 野生型酿酒酵母BY4742 (本实验室提供), 蝉花干粉(浙江泛亚生物医药股份有限公司), 氨基酸(Biotopped), 无水葡萄糖(成都科龙试剂), YNB(BD公司, 291930), 酵母提取物(OXODID), 胰蛋白胨(Solarbio), 琼脂粉(Biofroxx), DCFH-DA(Sigma公司), RNA 提取试剂盒(TIANGEN)、逆转录试剂盒(碧云天生物公司), 实时荧光定量试剂盒 (碧云天生物公司).
2.1.2 主要仪器和设备 气浴恒温振荡器(鸿科仪器), SW-CJ-1C超净工作台(中国苏州安泰), 一次性0.22 μM除菌滤器(Millipore 公司), 倒置荧光显微镜(Leica DMi8), CFX manager real-time PCR系统(美国 Bio-Rad), 超纯水处理系统(美国 Millipore 公司), pH计(中国上海康仪), 立式压力蒸汽灭菌锅(中国上海申安医疗).
2.2 实验方法
2.2.1 蝉花提取物的制备 将2 g蝉花干粉, 20 mL 95% 乙醇放入带磨口塞的50 mL锥形瓶中(盖上塞子), 混匀, 于30 ℃ 200 r/min振荡48 h, 过滤后收集滤液.40 ℃ 旋转蒸发滤液, 得到淡黄色粉末状的CCE.将CCE溶于无水乙醇, 配成50 mg/mL CCE醇溶液置于4 ℃ 冰箱备用[8].
2.2.2 酵母细胞的培养 将野生型酿酒酵母BY4742于YPD固体培养基活化, 挑取单菌落接种于SDC-2% Glucose液体培养基, 30 ℃、200 r/min恒温培养.
2.2.3 酿酒酵母时序性寿命(CLS)的测定 将活化的酵母细胞接种到20 mL SDC液体培养基, 使其在波长600 nm处的吸光度为0.005.接种时向CCE 处理组中加入终浓度为1.000 mg/mL 的CCE.30 ℃, 200 r/min恒温振荡培养.每个样品3个平行样, 培养至饱和后, 取菌液稀释10万倍.取适量菌液均匀涂布于YPD固体培养基, 倒置于30 ℃ 培养箱生长2~3 d, 统计YPD固体培养基上的菌落数(A).之后每隔1天重复以上步骤, 依次获得菌落数(B、C...).A/A、B/A、C/A...则表示存活菌落所占的比例, 以存活菌落所占比例为纵坐标、时间为横坐标所绘制的曲线代表酿酒酵母的时序性寿命.
2.2.4 酿酒酵母抗氧化胁迫能力的测定 将活化的酵母细胞接种到10 mL SDC液体培养基, 使其在波长600 nm处的吸光度为0.005.接种时向CCE 处理组中加入终浓度为1.000 mg/mL的CCE.30 ℃, 200 r/min恒温振荡培养24 h.然后取2 mL, 波长600 nm处吸光度为0.5的酵母细胞于离心管中, 离心后弃掉培养基.加入995 μL新鲜的SDC液体培养基, 混匀.向H2O2处理组中加入5 μL 10 mol/L H2O2, 分别处理30 min和60 min后逐级稀释10倍, 稀释4次.然后按浓度由低到高, 从右往左依次点样于YPD固体培养基上, 最后将培养基倒置于30 ℃ 培养箱生长2~3 d.
2.2.5 酿酒酵母细胞内 ROS 水平的测定 将活化的酵母细胞接种到20 mL SDC液体培养基, 使其在波长600 nm处的吸光度为0.005.接种时向CCE处理组中加入终浓度为1.000 mg/mL的CCE.30 ℃, 200 r/min恒温振荡培养24 h.然后取2 mL, 波长600 nm处吸光度为0.5的酵母细胞于EP管中, 离心后弃掉培养基.每个样品中加入含有10 μmol/L DCFH-DA探针的PBS缓冲液1 mL, 于30 ℃ 避光孵育.1 h后弃去探针孵育液, 用PBS缓冲液洗涤两遍.然后向H2O2处理组中加入2 mmol/L H2O2, 其余实验组中加入等体积的PBS缓冲液作为对照, 孵育1 h.然后在荧光显微镜下观察ROS的变化(激发波长为488 nm, 发射波长为525 nm).做三组独立重复实验.
2.2.6 实时荧光定量PCR检测CAT、SOD1、SOD2、GPX2 基因表达 将活化的酵母细胞接种到10 mL SDC液体培养基, 使其在波长600 nm处的吸光度为0.005.接种时向CCE处理组中加入终浓度为1.000 mg/mL的CCE.于30 ℃, 200 r/min恒温振荡培养24 h后用RNA提取试剂盒提取总RNA, 然后用逆转录试剂盒将mRNA逆转录为cDNA, 再用实时荧光定量试剂盒分别检测基因SOD2、CTT1、GPX2的表达量.其中, β-actin基因的上游引物为5′-CGTTCCAATTTACGCTGGTT-3′, 下游引物为5′-AGCGGTTTGCATTT- CTTGTT-3′;SOD2基因的上游引物为 5′-TTTGGCAAAGGCAATCGACG-3′, 下游引物为 5′-CGCCTGCTAGCTTTGTGTTG-3′;GPX2基因的上游引物为5′-TAATGTTGCCTCCAAGTGCG-3′, 下游引物为 5′-GGTTCCTGCTTCCCGA ACTG-3′;CTT1基因的上游引物为 5′-AGAAAGAGTTCCGGAGCGTG-3′, 下游引物为 5′-ACATTCTGGTATGGAGCGGC-3′.采用20 μL反应体系, 反应条件为95 ℃ 1 min;95 ℃ 15 s, 60 ℃ 30 s, 75 ℃ 1 min, 总共进行40个循环反应, 采用2-△△Ct计算基因表达的相对变化, 以β-actin作为内参进行归一化处理.做三组独立重复实验.
3 实验结果
3.1 CCE延长酿酒酵母寿命
通过对比加药处理组与不加药对照组的时序性寿命, 发现分别加入0.050 mg/mL CCE和0.100 mg/mL CCE都会对酵母的时序性寿命产生有益的影响, 其延长作用随着CCE浓度的增加而增强, 结果如图1所示.
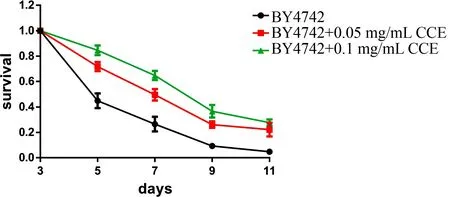
图1 CCE 延长酿酒酵母寿命Fig.1 CCE extends the lifespan of Saccharomyces Cerevisiae
3.2 CCE 增强酿酒酵母的抗氧化胁迫能力
通过对比加药处理组与不加药对照组对H2O2引起的氧化胁迫抵抗能力, 发现当加入H2O2后反应30 min, 其抗氧化胁迫能力增强的不明显;当加入H2O2后反应60 min, 其加药组0.050 mg/mL CCE和0.100 mg/mL CCE 都能一定程度的增强酿酒酵母的抗氧化胁迫能力, 并且其增强效果随着CCE浓度的增加而增强, 结果见图2.

图2 CCE 增强酿酒酵母的抗氧化胁迫能力Fig.2 CCE enhances the anti-oxidant capacity of Saccharomyces Cerevisiae
3.3 CCE 抑制H2O2诱导的ROS产生
使用DCFH-DA荧光探针检测细胞内的ROS, 其原理是DCFH-DA进入细胞后经过酶切反应生成DCFH, DCFH能与ROS反应生成发绿色荧光的DCF, 其荧光强度与ROS的含量成正比.实验结果表明, 加入0.100 mg/mL CCE处理组中的细胞内ROS含量弱于不加药对照组(Control)细胞, Control+H2O2组细胞内的ROS含量对比Control组细胞显著增加;虽然CCE + H2O2组细胞内的ROS含量也比CCE组细胞高, 但却远远低于Control+H2O2组细胞内的ROS含量, 如图3所示.证明CCE可明显抑制酿酒酵母中由H2O2诱导的ROS产生.
3.4 CCE 对 SOD2 、GPX2和 CTT1基因表达的影响
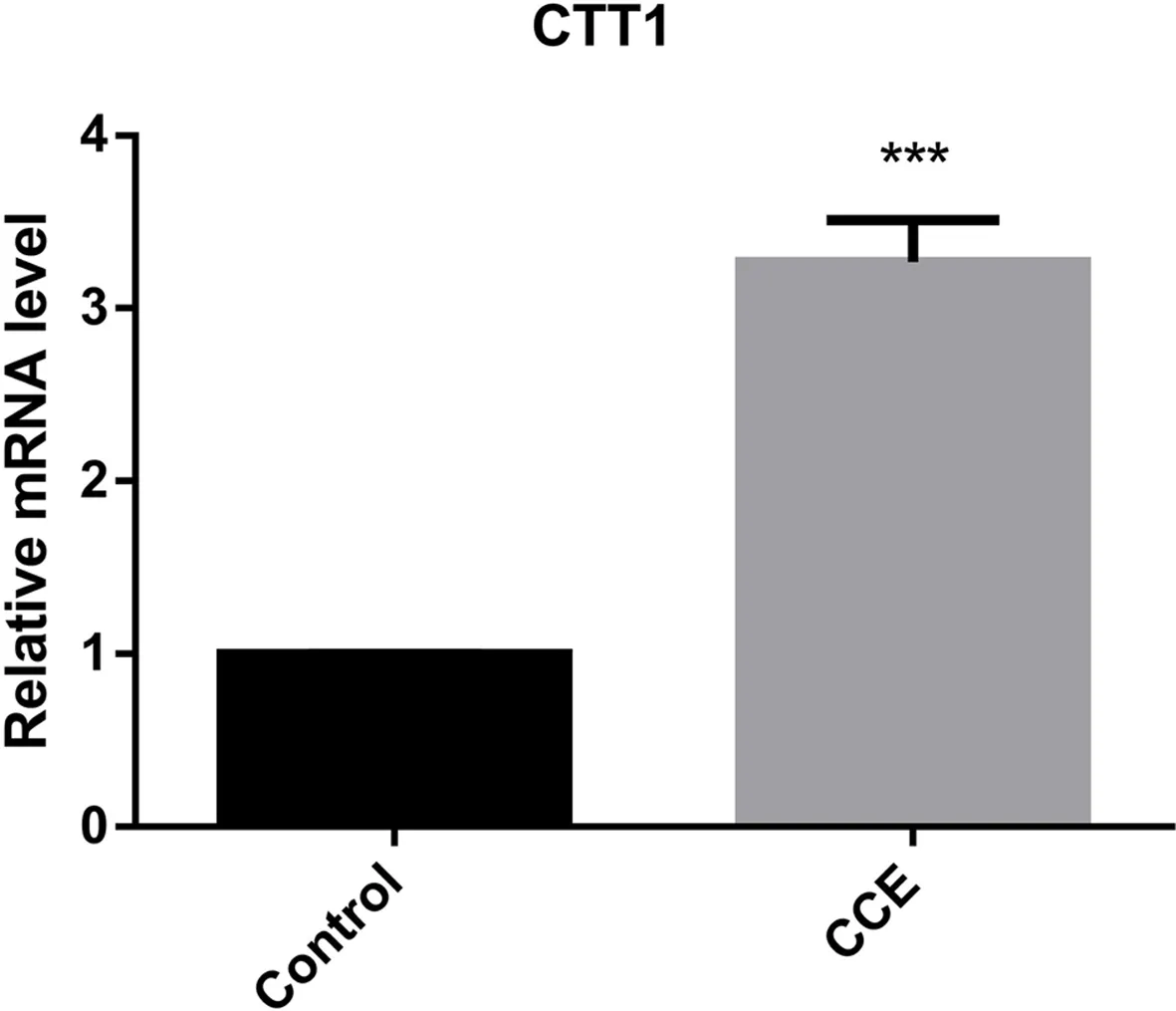
SOD2、GPX2和CTT1基因的相对表达量如图4所示, 0.100 mg/mL CCE处理组中SOD2和CTT1的mRNA 水平都上调了3倍左右, 可知CCE可以明显提高酿酒酵母SOD2和CTT1基因在mRNA水平的表达;而CCE对GPX2基因在mRNA水平的表达没有明显影响.证明CCE的抗氧化活性主要是通过上调SOD2和CTT1的表达所致.
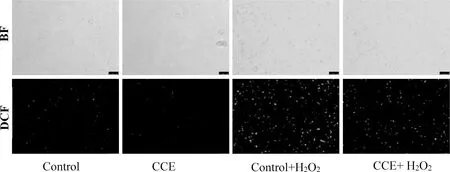
图3 CCE 抑制 H2O2 诱导的 ROS 产生
酵母细胞经0.100 mg/mL的CCE处理24 h, 之后孵育DCFH-DA探针1 h, PBS 洗涤两遍之后, 加入2 mmol/L H2O2处理1 h, 在荧光显微镜下观察ROS水平
Fig.3 CCE inhibits H2O2-induced ROS production
Yeastcells were pre-treated with CCE at 0.100 mg/mL for 24 h,and then were stained using DCFH-DA for 1 h, washed twice with PBS. Yeast cells were treated with 2 mmol/L H2O2for 1 h, and the ROS level were detected under a fluorescence microscope.
4 讨 论
很多研究表明衰老是源自于氧化胁迫所导致的有机体在氧化防御、免疫功能、代谢调控等方面所产生的损伤[10-12], 固而增强生物体的抗氧化能力是抵抗衰老的一种有效手段.蝉花作为一种在我国已经有上千年药用历史的传统中药, 具有增强人体抗氧化的能力, 但其有效活性成分一直不甚明确, 因此将蝉花活性成分进行萃取, 进而检测它们对细胞的作用效果是一种行之有效的方法.本文从抗氧化胁迫的角度出发, 以酿酒酵母为研究模型, 检测CCE对酵母细胞氧化胁迫应答的影响.结果显示, CCE处理能够延长酿酒酵母的时序性寿命.进一步研究发现, CCE处理能够增强酿酒酵母的抗氧化胁迫能力并且其增强效果随着 CCE浓度的增加而增强, CCE处理还显著的降低了由H2O2诱导的细胞内ROS的上升;通过对细胞内具有抗氧化能力的一些基因SOD2、CTT1、GPX2的表达进行检测发现, CCE能够显著地促进CTT1和SOD2基因在mRNA水平的表达.最后我们得出结论:蝉花提取物(CCE)能够通过诱导抗氧化防御基因CTT1和SOD2的表达, 增强酿酒酵母的抗氧化胁迫能力, 降低胞内活性氧的水平, 延长酿酒酵母的时序性寿命.

