大黄花虾脊兰种子特性及无菌播种
刘海平, 陈秀萍, 李 珺, 吴沙沙, 何碧珠, 兰思仁, 翟俊文
(1.福建农林大学园林学院,福建 福州 350002;2.福建农林大学兰科植物保护与利用国家林业和草原局 重点实验室,福建 福州 350002;3.广东市林业和园林科学研究院,广东 广州 510405)
大黄花虾脊兰(CalanthestriataR.Br.,常用异名C.sieboldii)隶属于兰科(Orchidaceae)虾脊兰属(Calanthe),台湾地区称其黄根节兰[1-2].大黄花虾脊兰花开时花香淡雅,花色纯黄,具有极高的观赏价值,是优良的育种亲本,因而受到园艺育种界的广泛追捧.目前在英国皇家园艺学会(RHS)已登录的虾脊兰新品种约有449个,其中约28个品种是以大黄花虾脊兰作为亲本,几乎涵盖所有黄色品种,大黄花虾脊兰的育种潜力巨大,具有良好的商业开发价值.
大黄花虾脊兰野生个体数目极少,并且分布狭窄,属于典型的大陆—岛屿间断分布,据现有文献报道主要分布于中国南部(湖南新宁艮山、永州阳明山、江西井冈山、安徽泾县)[3-6]、日本南部(本州、四国岛、九州岛,其中,琉球群岛为模式标本产地)以及韩国南部一些岛屿(郁陵、Heuksan、Gageo、Hong、济州岛)[7].正是由于野生个体极少,分布狭窄,因此被列入《中国高等植物红色名录》极危类群,又被国家林业和草原局列为“极小种群保护物种”[8-9].不仅在中国,世界范围内大黄花虾脊兰的形势同样不容乐观,日本已将大黄花虾脊兰列入日本濒危植物红色名录,濒危等级定位EN[10];韩国在1997年也将其列入稀有植物[11].因此,大黄花虾脊兰被形象地称为“植物界的金丝猴”.
基于大黄花虾脊兰的观赏价值、育种潜力以及生存现状,亟需建立大规模繁殖技术和科学有效的保护方法.本试验以大黄花虾脊兰成熟未开裂的蒴果为研究材料,探讨种子特性并对无菌播种过程进行观察,建立其初步的繁殖体系.用无菌播种快繁技术,可以在保持比无性繁殖更可变的基因库的同时,产生大量的种苗[12],为今后的育种工作和重新引入自然栖息地提供参考.
1 材料与方法
1.1 材料
于2016年4—5月每天对安徽野生大黄花虾脊兰居群花期进行观察和记录,以柱头上有花粉块为标准确定自然授粉日期,用自然授粉后120~150 d成熟未开裂的蒴果作为研究材料.
1.2 方法
1.2.1 自然授粉有胚率统计及种子活力观察 随机选取授粉后120~150 d成熟未开裂的蒴果56个,解剖取出粉末状种子,在Nikon-SMZ18型体视显微镜(日本Nikon公司)下统计一个视野内的种子总数和有胚种子数(观察到种子中部有黑色圆点的,即为有胚),计算种子有胚率.取视野内种子总数大于50的数据为有效数据,6个重复.
分别从120、130、140和150 d(花开放时挂牌记录时间)的蒴果中随机取出3个,取出种子,用2,3,5-三苯基氯化四氮唑(TTC)进行染色处理.染色过程中用锡纸包裹种子,于30 ℃避光条件下放置3 d,体视显微镜下随机选取6个有效数据视野,对种子活力进行观察.在观察种子活力时,将被TTC染色的种子分为无色、浅黄色、橙红色和红色4个范围,将橙红色和红色确定为有活力的种子.
用Excel 2013和SPSS 20.0软件分析数据,分别统计蒴果有胚率和种子活力.有胚率和种子活力/%=有胚数(有活力种子数)/种子总数×100.
1.2.2 种子表面灭菌、播种与培养 将筛选出的最佳活力的种子,即140 d的蒴果作为研究对象.蒴果用洗衣粉清洗5 min后置自来水下冲洗30 min,转入超净工作台上,用75%酒精表面消毒30 s,再用10%次氯酸钠消毒15 min,最后用无菌水漂洗3次后放在无菌滤纸上吸干表面水分.纵向切开果荚,将种子均匀播种在萌发培养基表面,在黑暗条件下培养,记录种子萌发时间,至种胚明显膨大为白色透明圆球体后转至光照度为1 000~1 500 lx的日光灯下进行培养,培养温度为(24±2) ℃,平均光照时间为12 h·d-1.
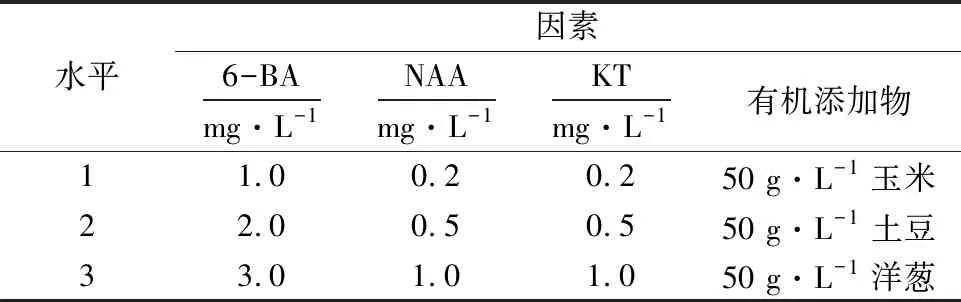
表1 大黄花虾脊兰种子萌发培养B系列配方 L9(34)正交设计1)Table 1 Orthogonal design scheme L9(34) for series B media used for the seed germination of C.striata
1)其他培养基成分为:2 g·L-1Hyponex 1+1/2 MS+0.37 mg·L-1MgSO4·7H2O+25 g·L-1蔗糖+5.5 g·L-1琼脂粉+1.5 g·L-1活性炭+2 g·L-1牛肉粉蛋白胨,pH 5.7~5.8.
1.2.3 萌发培养基的配制 以6-BA(1.0、2.0、3.0 mg·L-1)、NAA(0.2、0.5、1.0 mg·L-1)、KT(0.2、0.5、1.0 mg·L-1)和有机添加物(50 g·L-1玉米、50 g·L-1土豆、50 g·L-1洋葱)进行4因素3水平正交试验(表1),以筛选较适合的培养基.为保证萌发培养基上种子基本特性一致,排除不同蒴果的种子有胚率和种子活力的差异对萌发试验的影响,故保证每一个果荚接种到9个处理的培养基中,同一个果荚每个处理接种3瓶,共用10个果荚,接种270瓶,每个处理30瓶.接种后放置在同样条件下培养,每5 d观测并记录萌发情况.
1.2.4 种子萌发的观察与统计 取样:于无菌环境下随机刮取一定量含已萌发种子的培养基于载玻片上,在体视显微镜下观察并统计.
萌发率统计:采用宏观观察法和微观观察法进行萌发情况统计.先进行表观评估,比较萌发培养基不同组别生长状况的差异,再进行微观观察,在体视显微镜下进行取样和数据统计.统计出一个视野内的种子总数、萌发种子数(以原球茎的形成视为萌发成功),并观察胚的发育情况,计算每个培养基的种子萌发率.每个种子每种培养基统计6个有效数据,用Excel 2013和SPSS 20.0软件进行数据分析.种子萌发率/%=萌发种子数/种子总数×100.
1.2.5 转接 待种苗叶片长至1 cm左右时,将其转接至预试验中筛选出的较优增殖壮苗培养基上进行培养.因大黄花虾脊兰无菌播种的难点在于萌发,故专门设计萌发培养基,而增殖壮苗只需使用普通增殖壮苗培养基即可生长,配方为:1/2MS+1.0~3.0 mg·L-16-BA+0.5~1.0 mg·L-1KT+0.2~0.5 mg·L-1NAA+25 g·L-1蔗糖+5.5 g·L-1琼脂粉+1.5 g·L-1活性炭+50 g·L-1土豆泥+3 g·L-1牛肉粉蛋白胨.
1.2.6 移栽 于2018年4月3日筛选出苗高7 cm 以上的组培苗,将装有组培苗的培养瓶放置在有遮荫条件的温室(温度20~28 ℃)中炼苗,15 d后打开盖子再炼苗2~3 d.移栽时,将取出的组培苗用自来水洗净培养基,移栽至基质中,移栽基质中的火烧土∶树皮为3∶1(体积比),移栽前将移栽基质浸泡于1 000倍的多菌灵中消毒灭菌15 min,保持基质湿度,40 d后统计成活率.成活率/%=成活组培苗数/总数×100.
2 结果与分析
2.1 种子的有胚率和活力
体视显微镜下观测显示,大黄花虾脊兰种子呈两端稍尖的纺锤状,种皮呈白色透明状有内外两层,种皮细胞呈近长条状四边形,种子中间有一个细小圆球形种胚(图1A).自然授粉后120~150 d的蒴果56个,有胚率为15.57%~95.66%,平均值为45.15%±2.68%(图2).生长120 d的蒴果未完全成熟,87%的种胚呈半透明状,无活性(图1B);130 d的蒴果有51%的种子有活性能被TTC染红;140 d的蒴果基本成熟,76%的种子有活性能被TTC染红,部分无活性,胚细小,在种腔中所占体积较小,完全成熟且有气囊(图1C);150 d的蒴果种子形态与140 d的种子无明显差别,但仅有63%的种子有活性能被TTC染红,较140 d种子活性有所降低.
2.2 种子无菌萌发过程
观测显示,种子经过120 d左右的培养,种胚吸水并膨胀变大,呈无色透明的圆球体,此时转至光照条件下培养,一周后种皮一端胀破(图1D、3A).140 d左右时胚由白色变成淡绿色球状物,继而形成原球茎,原球茎生出大量白色透明绒毛(图3B),150 d顶端分生出明显的芽生长点,底部生出肉质的不定根(图3C、3D),此时转接至新的培养基中,180 d原球茎大量增殖,210 d后长成幼苗(图3E、3F).
2.3 萌发结果
主体间效应检验结果表明:6-BA对种子萌发的影响显著(P=0.001 2);NAA、KT和有机添加物均对种子萌发的影响极显著(P=0.000,P=0.000,P=0.000).表2显示,在9组处理中,第3组的萌发率最高,为39.64%.对各因素R值进行比较的结果表明,对种子萌发的影响程度从大到小排序为:有机添加物、NAA、KT、6-BA.通过极差分析筛选出该系列的最佳萌发培养基为:2 g·L-1Hyponex 1+1/2 MS+0.37 mg·L-1MgSO4·7H2O+25 g·L-1蔗糖+1.0 mg·L-16-BA+0.2 mg·L-1NAA+1.0 mg·L-1KT+5.5 g·L-1琼脂粉+1.5 g·L-1活性炭+2 g·L-1牛肉粉蛋白胨+50 g·L-1洋葱,pH 5.7~5.8.
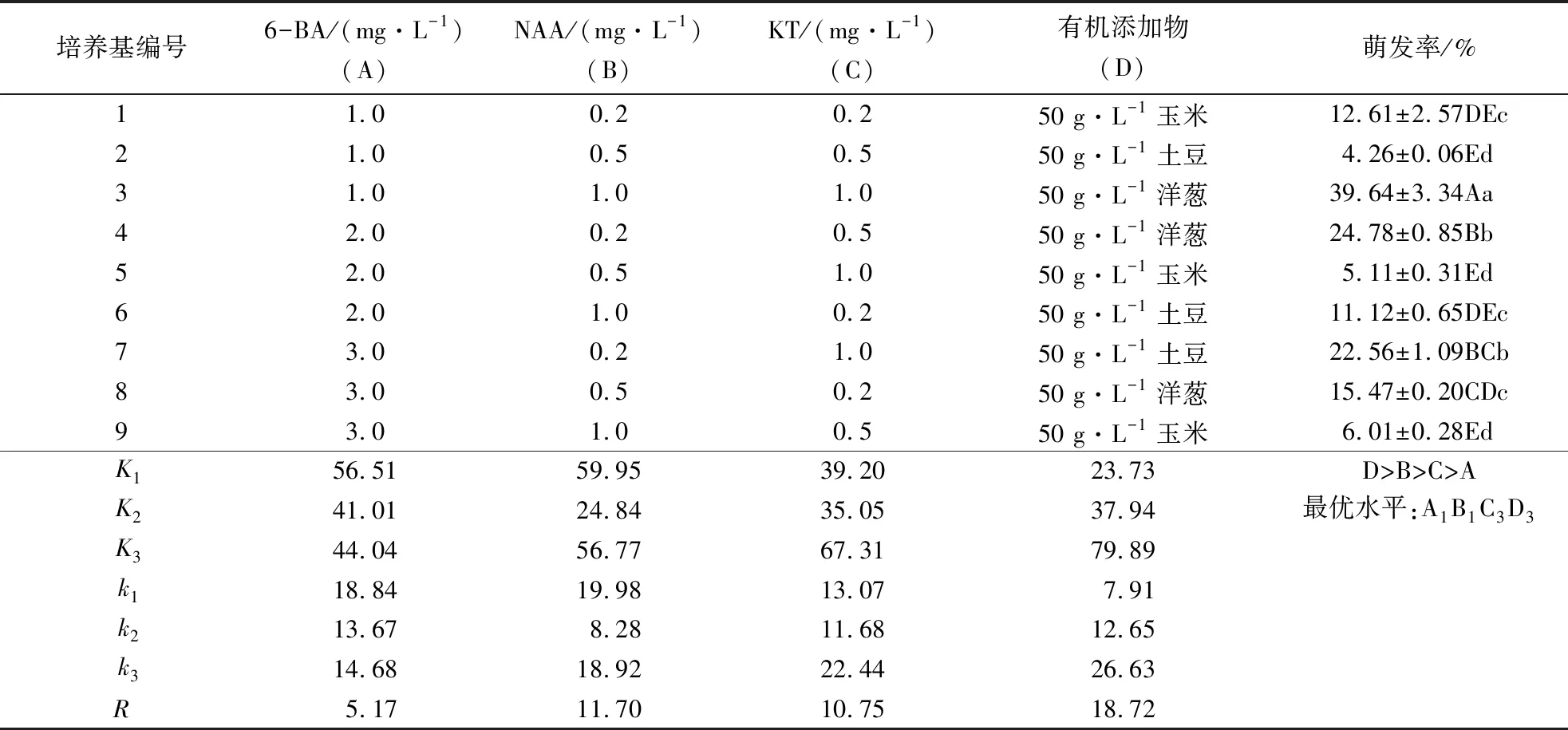
培养基编号6-BA/(mg·L-1)(A)NAA/(mg·L-1)(B)KT/(mg·L-1)(C)有机添加物(D)萌发率/%11.00.20.250 g·L-1玉米12.61±2.57DEc21.00.50.550 g·L-1土豆4.26±0.06Ed31.01.01.050 g·L-1洋葱39.64±3.34Aa42.00.20.550 g·L-1洋葱24.78±0.85Bb52.00.51.050 g·L-1玉米5.11±0.31Ed62.01.00.250 g·L-1土豆11.12±0.65DEc73.00.21.050 g·L-1土豆22.56±1.09BCb83.00.50.250 g·L-1洋葱15.47±0.20CDc93.01.00.550 g·L-1玉米6.01±0.28EdK156.5159.9539.2023.73D>B>C>AK241.0124.8435.0537.94最优水平:A1B1C3D3K344.0456.7767.3179.89k118.8419.9813.077.91k213.678.2811.6812.65k314.6818.9222.4426.63R5.1711.7010.7518.72
1)数据为平均值±标准误(n=5);同列数据后附不同大写字母者表示差异极显著(P<0.01),附不同小写字母者表示差异显著(P<0.05),附相同小写字母者表示差异不显著(P>0.05).
2.4 组培苗移栽
大黄花虾脊兰喜温暖湿润的环境,较耐寒,不耐高温和干旱.在2018年4月3日进行移栽,移栽后遮荫以避免强光直射,每隔一天浇透水一次并覆盖透气薄膜,保持土壤湿润和空气湿度,温室大棚内的温度保持在20~28 ℃.移栽40 d后的成活率为95%(图4).
3 讨论
3.1 种子活力
种子活力是种子萌发的前提因素.随机选取自然授粉不同成熟度的蒴果56个,有胚率为15.57%~95.66%,平均值为45.15%±2.68%,说明不同成熟度果实的有胚率存在差异.生长120 d的蒴果种子在TTC染色剂下部分胚呈白色透明状,无活性;140 d的蒴果种子能被TTC染红有活性,且活性最高,为76%;150 d的蒴果种子活性为63%.徐刚等[13]测定并比较虾脊兰属9种植物种子的形态和大小,发现种子完全成熟需5个月以上;曾宋君等[14]对银带虾脊兰(Calantheargenteo-striata)进行无菌播种研究,发现授粉90 d的种子还未发育成球形胚,尚不能萌发,授粉120 d的种子成熟度不高,萌发率低,授粉150 d的种子,萌发较好,说明种子成熟时间过长或过短都会影响种子的萌发,此结果与本试验结果相同.
3.2 激素和有机添加物对种子萌发的影响
一般来说,NAA和KT的主要作用是诱导根和愈伤组织的形成,促进细胞脱分化,与细胞分裂素一起应用于诱导不定芽的分化、侧芽的萌发与生长.6-BA主要是刺激细胞分裂,诱导芽的分化、叶片扩大和茎长高,打破顶端优势,促进丛生芽的形成和增殖,抑制根的生长.植物组织培养中常用的天然有机添加物有椰汁、香蕉泥、土豆泥、洋葱汁和玉米汁等,都是复杂的营养混合物,所含的化学成分不完全清楚,且成分不固定,但往往对培养的植物器官组织有一定的调节作用[15].有机添加物由于含有许多复杂、有效的成分而被广泛应用于兰科植物的离体培养[16].不同含量NAA、6-BA、KT的组合产生的作用不同[17].曾宋君等[18]研究表明,低含量的NAA可以促进墨兰(Cymbidiumsinense)种子的萌发,而当NAA和6-BA的含量大于0.5 mg·L-1时会对墨兰种子非共生萌发起抑制作用.钟雨薇[19]研究表明,6-BA对春兰(C.goeringii)种子具有减轻抑制物质抑制的作用,可打破种子休眠.张菊野等[20]研究表明,NAA有利于原球茎增殖与根的形成.一些有机添加物也有利于种子萌发和原球茎的生长.彭晓明等[21]曾报道,洋葱汁和土豆泥能促进墨兰种子的萌发;也有研究表明,玉米汁有助于垂花蕙兰原球茎根的形成[22].
本试验在大黄花虾脊兰种子萌发时使用了较高含量的6-BA(1.0~3.0 mg·L-1)和较低含量的NAA、KT(0.2~0.5 mg·L-1),结果显示,在6-BA含量为1.0 mg·L-1,NAA含量为1.0 mg·L-1,KT含量为1.0 mg·L-1时,种子萌发率最高,可达39.64%.不同有机添加物与不同配比的激素对种子萌发的影响存在一定差异,但不管与哪种激素配比,加洋葱都明显提高种子萌发率并促进原球茎生长,且洋葱具有缓冲培养基pH的作用.本试验筛选出相对较佳的培养基组合为:2 g·L-1Hyponex 1+1/2 MS+0.37 mg·L-1MgSO4·7H2O+25 g·L-1蔗糖+1.0 mg·L-16-BA+0.2 mg·L-1NAA+1.0 mg·L-1KT+5.5 g·L-1琼脂粉+1.5 g·L-1活性炭+2 g·L-1牛肉粉蛋白胨+50 g·L-1洋葱,pH 5.7~5.8.玉米、洋葱和土豆等有机添加物营养丰富,在一定程度上维持培养基的酸碱度,有利于兰科植物的增殖和分化,但其营养成分复杂,影响种子萌发的机制和具体因素值得进一步研究.
大黄花虾脊兰无菌播种的研究为离体保存提供参考,可为产业化发展提供技术支持,还可以进行原生地移栽以适度恢复种群规模.研究过程中发现的难点在于种子的萌发,无菌播种120 d后种胚突破种皮,光照下逐渐转绿时将其转接,20 d左右种胚即可正常发育成为原球茎,长叶生根.因此,种子萌发是重点要解决的问题,特别是在缩短种子萌发周期和提高萌发率上值得更进一步的深入研究.
4 结论
大黄花虾脊兰种子的有胚率为15.57%~95.66%,平均值为45.15%±2.68%,授粉后140 d的蒴果种子活性最佳;种子萌发120、140 d后种胚突破种皮生长为原球茎,150 d顶端分生出明显的芽生长点,底部长出肉质的不定根;相对较佳的培养基组合为:2 g·L-1Hyponex 1+1/2 MS+0.37 mg·L-1MgSO4·7H2O+25 g·L-1蔗糖+1.0 mg·L-16-BA+0.2 mg·L-1NAA+1.0 mg·L-1KT+5.5 g·L-1琼脂粉+1.5 g·L-1活性炭+2 g·L-1牛肉粉蛋白胨+50 g·L-1洋葱,pH 5.7~5.8,种子萌发率达39.64%±3.34%,褐化少,出苗率高.

