丹皮酚对小鼠酒精性脂肪肝中Adip/CaMKKβ/AMPK通路的影响
司远青,颜贵明
(安徽中医药大学中西医结合学院病原生物学与免疫学教研室,安徽 合肥 230012)
酒精性脂肪肝(alcoholic fatty liver disease,AFLD)是指由于长期大量饮酒导致的肝脏脂肪代谢异常的疾病。当人摄入酒精时,进入机体的大部分酒精会在肝脏被代谢,影响肝脏脂肪代谢,最终导致肝内的脂肪堆积,脂肪变性、坏死,形成脂肪肝,甚至进一步形成肝炎或肝纤维化等。
腺苷酸活化蛋白激酶(adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK)作为外周组织中能量平衡的主要传感器,当能量代谢的平衡被打破时,其将被磷酸化并激活[1]。AMPK信号一旦被激活,就会抑制能量生物合成途径和活化能量代谢途径。McCullough等[2]就提出了代谢应激可引起AMPK的变化。SREBP1c(固醇调节元件结合蛋白1c)做为AMPK其中一个下游蛋白激酶,参与脂肪酸的合成与代谢[3]。CaMKKβ(钙调蛋白激酶),涉及能量平衡调节,做为AMPK上游激酶,可以通过其磷酸化来激活AMPK。有研究将小鼠的CaMKKβ基因敲除可免受饮食引起的肥胖、胰岛素抵抗和葡萄糖耐受等的影响[4]。脂联素(adiponectin,Adip)作为脂肪细胞分泌的一种具有生物活性的蛋白质因子,可参与调节体内能量代谢[5]。丹皮酚(paeonol,Pae)是从毛茛科植物牡丹干燥根皮中提取出的一种有效的成分,具有抗炎、抗氧化、降脂质、抑制脂肪过氧化等多种作用。本课题组前期研究发现,丹皮酚对AFLD大鼠有较好的治疗作用,可以减轻酒精引起的肝细胞损伤[6],但是否通过Adip/CaMKKβ/AMPK这一通路发挥作用尚不清楚。本实验拟从该通路入手研究丹皮酚治疗小鼠酒精性脂肪肝的机制。
1 材料与方法
1.1 材料
1.1.1实验动物 8周龄健康♂ KM小鼠,SPF级,体质量(40±2)g。由常州卡文斯实验动物有限公司提供,生产许可证号: SCXK(苏) 2016-0010。小鼠自由进食、饮水,标准饲料喂养,实验室常规适应性饲养1周。
1.1.2药物与试剂 丹皮酚(paeonal,Pae),南京泽郎生物科技有限公司,批号:ZL150806;水飞蓟宾(silibinin,Sil)胶囊,天津天士力圣特制药有限公司,批号:750705069;56度永丰牌二锅头,北京二锅头酒业股份有限公司,批号:SC11511150818017;苏木素-伊红(HE)染色液,北京雷根生物,批号:0419A18;IL-6、IL-1β、TNF-α ELISA试剂盒,上海一研生物科技有限公司,批号:201812;甘油三酯(TG)和总胆固醇(T-CHO)测试盒,南京建成生物工程研究所,批号:20181208;ALT和AST试剂盒,南京建成生物工程研究所,批号:20181207;小鼠脂联素(APN/ADP)ELISA试剂盒,酶免商城,批号:MM-0547M2;小鼠乙酰辅酶A羧化酶(ACC)ELISA试剂盒,酶免商城,批号:MM-0757M2;Fast Quant RT Kit(with gDNase),天根生化科技(北京)有限公司,批号:04214;Trizol试剂盒,Invitrogen公司,批号:184608;β-actin、AMPKα、CaMKKβ、AdipR1和SREBP1c引物购于上海生工。兔抗β-actin、AMPKα、CaMKKβ、P-AMPKα、P-CaMKKβ、AdipR1和SREBP1c一抗及二抗(羊抗兔)购于Affinity公司。
1.1.3主要仪器 YD-315切片机(金华市益迪医疗设备有限公司);YD-AB生物组织摊烤片机(金华市益迪医疗设备有限公司);TS-12A生物组织自动脱水机(湖北省孝感市宏业医用仪器有限公司);YD-6L生物组织冷冻包埋机(金华市益迪医疗设备有限公司);OLYMPUSBX51正置显微镜(上海富莱光学公司);K3型酶标仪(LabServ公司);Thermo ABI 7500 实时荧光定量PCR仪(美国应用生物系统公司); FCM型凝胶成像仪(美国proteinsimple公司);基因扩增仪(杭州柏恒科技有限公司)。
1.2 方法
1.2.1AFLD小鼠模型的复制[7]110只KM ♂小鼠随机分为两组:空白对照组(Control)和模型组,前者10只,后者100只。空白对照组灌胃生理盐水,模型组灌胃56度白酒,灌胃体积为12 mL·kg-1,每天上午灌胃1次。1周后,每天取模型组小鼠2只处死,肉眼观察肝脏变化,并留取肝脏做病理切片,观察肝脏病变情况。与空白对照组小鼠相比,造模2周后,小鼠肝脏病理切片有明显的脂滴空洞,符合AFLD的特征。剩余小鼠继续下述实验。
1.2.2动物分组与给药 造模成功的小鼠随机分为以下3组:模型组(EtOH 12 mg·kg-1)、阳性药组(Sil+ EtOH 23 mg·kg-1)和丹皮酚组(Pae+EtOH 300 mg·kg-1),灌胃体积12 ml·kg-1,10只正常对照组小鼠给予等体积的生理盐水,均连续干预1周。
1.2.3小鼠活动状态观察 每日观察小鼠的外观、毛色、活动、食量、排便等状态,每隔1 d称一次体重。
1.2.4标本处理及指标检测 药物干预1周后,取材前一晚禁食不禁水。次日上午称重、麻醉、摘眼球取血。取完血后立即摘取肝脏,用冷的生理盐水清洗肝脏表面后,将肝脏分为三部分,第一部分用10%中性福尔马林浸泡用于病理检测,第二部分和第三部分于-80 ℃保存,用于后期PCR实验和Western blot蛋白印迹实验。
1.2.5血清生化指标检测 在末次给药2 h后,水合氯醛麻醉,摘眼球取血,静置2 h后,3 000 r·min-1离心10 min,取上层血清,-20℃保存。用于血清TG、TC、ALT、AST、IL-6、IL-1β、TNF-α、Adip和ACC的含量测定。上述血清学检测皆按照相应试剂盒测定。
1.2.6组织病理学检测 取出在10%中性福尔马林中固定的肝组织,脱水,常规石蜡包埋,切片,HE染色。200倍光学显微镜下观察肝组织的形态学方面的改变。
1.2.7基因水平检测
1.2.7.1 小鼠肝脏组织中的RNA提取 末次给药后,禁食不禁水18 h后麻醉,迅速取出肝脏,预冷的生理盐水清洗,研磨,按照Trizol试剂盒的要求提取小鼠肝脏的总RNA。取5 μL总RNA加入95 μL ddH2O混匀,分别测定OD260、OD280的值,OD260/OD280值均在1.8~2.0之间。再通过公式:RNA浓度(g·L-1)=(OD260×40×稀释倍数)/1 000来计算RNA的浓度,使用无菌RNase水将浓度调至一致。
1.2.7.2 cDNA合成 使用Fast Quant RT Kit(with gDNase)此试剂盒,根据说明书要求:在冰浴的nuclease-free管中分别加入total RNA 3 μL、5×g DNA Buffer 2 μL和RNase-Free ddH2O 5 μL彻底混匀,简短离心,置于42 ℃,孵育3 min。再加入以下试剂的混合物:10×Fast RT Buffer 2 μL、RT Enzyme Mix 1 μL、FQ-RT Primer MIX 2 μL 和 RNase-Free ddH2O 5 μL。充分混匀后,42 ℃,孵育15 min;95 ℃,孵育3 min,即得到cDNA;之后置于冰上放置。
1.2.7.3 引物设计 所有引物采用Primer Premier 5.0软件设计,委托上海生工生物有限公司合成,各引物序列见Tab 1。引物开盖前先4 000 r·min-1, 30~60 s离心。轻轻开盖后加入相对应体积的DEPC水混匀,得到100 μmol·L-1的引物。将其稀释10倍分装,置于-20 ℃保存备用。
1.2.7.4 半定量PCR 取nuclease-free管置于冰盒上,按照试剂盒要求配制反应体系:Easy Taq PCR SuperMix(2×)12.5 μL,引物f (10 μmol·L-1) 0.5 μL, 引物r(10 μmol·L-1) 0.5 μL, DEPC水11 μL, cDNA 0.5 μL。将混合均匀的反应体系混合液瞬时离心去除气泡后,放置于基因扩增仪上进行反应,反应程序:94 ℃ 5 min; 94 ℃ 30 s、54 ℃ 30 s、 72 ℃ 30 s,35个循环;72℃ 10 min之后进行琼脂糖凝胶电泳,电压110 V,时间27 min,于凝胶成像仪曝光成像。
1.2.7.5 实时荧光定量PCR 取nuclease-free管置于冰上,按照试剂盒要求配制反应体系:SYBR Green qPCR Master Mix(2×)12.5 μL,引物f(10 μmol·L-1) 1 μL, 引物r(10 μmol·L-1)1 μL, DEPC水10 μL, cDNA 0.5 μL。将混合均匀的反应体系混合液瞬时离心去除气泡后,放置于ABI 7500实时荧光定量PCR仪上进行反应,反应程序:95 ℃ 1 min; 95 ℃ 15 s、50 ℃ 15 s、 72 ℃ 45 s,40个循环; 95 ℃ 15 s; 60 ℃ 1 min.实验重复3次,内参基因为β-actin,目的基因为AdipR1、CaMKKβ、AMPKα和SREBP1c。分别测定上述基因的Ct值,计算各基因各组的Ct值平均值,实验结果表示为:2-△△Ct。

Tab 1 Primer sequences of PCR
1.2.8蛋白水平检测
1.2.8.1 小鼠肝组织蛋白提取 从-80 ℃冰箱中取出冰冻的肝组织,各组约100 mg,剪碎,按照试剂盒说明书对组织进行蛋白抽提,得到各组总蛋白后,用BCA试剂盒测定蛋白浓度,蛋白存于-20℃备用。
1.2.8.2 Western blot检测蛋白水平表达 采用10% SDS-PAGE胶进行电泳,湿法转模;5% BSA室温封闭2 h,TBST缓冲液洗涤4次,每次5 min;一抗分别按照β-actin(兔抗,1 ∶1 000)、AdipR1(兔抗,1 ∶1 000)、CaMKKβ(兔抗,1 ∶1 000)、p-CaMKKβ(兔抗,1 ∶500)、AMPKα(兔抗,1 ∶1 000)、p-AMPKα(兔抗,1 ∶500)、SREBP1c(兔抗,1 ∶1 000)用5%BSA稀释,把对应的膜浸没在对应的一抗中,4 ℃孵育过夜;取出后,TBST缓冲液洗涤4次,每次5 min;二抗(羊抗兔,1 ∶10 000)室温孵育2 h,TBST缓冲液洗涤4次,每次5 min;显影曝光。

2 结果
2.1 动物一般状态观察造模2周,模型组小鼠出现毛色灰暗无光泽,活动量减少,小鼠体质量减轻;正常对照组小鼠毛色光滑,活动积极,食量与排便正常;给药1周后,各给药组毛色略有改善,活动量与精神状态也略有改善。各组小鼠体质量(Fig 1)有变化,但无统计学意义。

Fig 1 Line chart of mouse weight
2.2 肝脏组织病理学变化如Fig 2显微镜所示,正常组肝细胞结构正常,内无脂滴形成,肝细胞无脂肪变性;模型组小鼠肝细胞中出现小而密的脂滴,炎性细胞浸润,肝细胞出现脂肪变性;水飞蓟宾组几乎未存在圆形的脂滴空洞和炎性细胞;丹皮酚组有较水飞蓟宾组略多的圆形脂滴空洞和炎性细胞浸润。水飞蓟宾与丹皮酚都在一定程度上减轻肝细胞的脂肪变性与炎性细胞浸润。

Fig 2 Histopathological features of liver(HE×200)
2.3 丹皮酚对血清中TG、TC 含量的影响模型组小鼠血清中TG与TC含量明显高于正常组;两个用药组皆有不同程度的改善模型组的升高情况,但就TG含量上,丹皮酚比水飞蓟宾降低;TC含量上,两用药组差异无显著性。可见丹皮酚能更有效地降低酒精诱导导致的酒精肝中甘油三酯的含量。见Fig 3。

Fig 3 Effect of Pae on TG and TC in mice with alcoholic fatty
2.4 丹皮酚对血清中IL-6、IL-1β和TNF-α含量的影响酒精诱导小鼠AFLD模型,血清中IL-6含量几乎无变化,IL-1β和TNF-α皆有升高;水飞蓟宾组与丹皮酚组调节上述3种炎症因子差异无显著性,血清中IL-6含量依然几乎无变化,IL-1β与TNF-α对酒精诱导引起的含量升高情况有明显改善。见Fig 4。
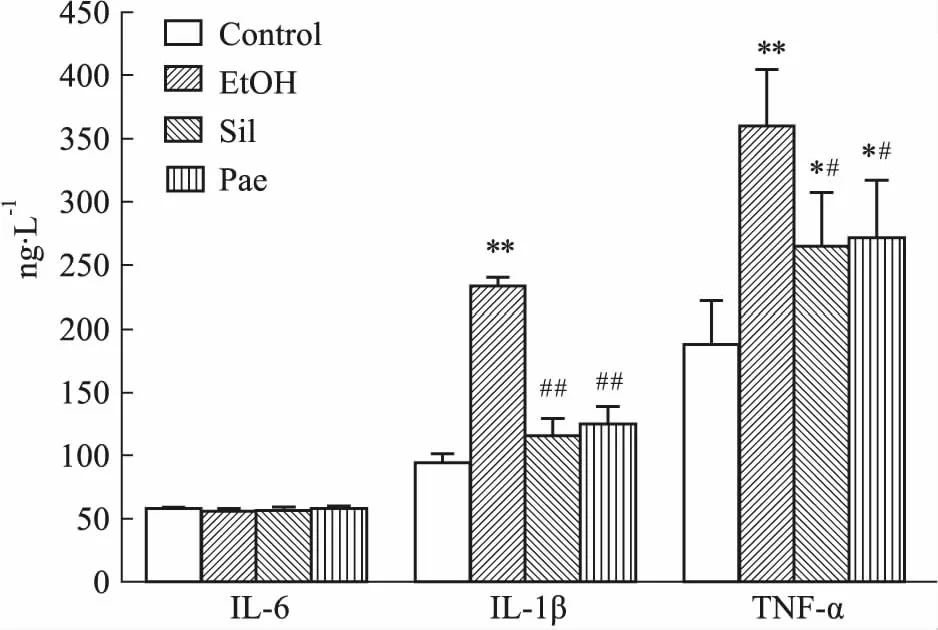
Fig 4 Effect of Pae on IL-6, IL-1β and TNF-αin mice
2.5 丹皮酚对血清中Adip和ACC含量的影响通过ELISA试剂盒检测,模型组小鼠血清中Adip含量低于正常组,给予水飞蓟宾和丹皮酚给药组可改善模型组Adip含量降低情况,但仍与正常组差异有显著性。同时对血清中ACC进行检测,相对于正常组,模型组小鼠血清中ACC含量升高,两给药组皆降低ACC含量,且水飞蓟宾组比丹皮酚组更大程度降低其含量。见Fig 5。
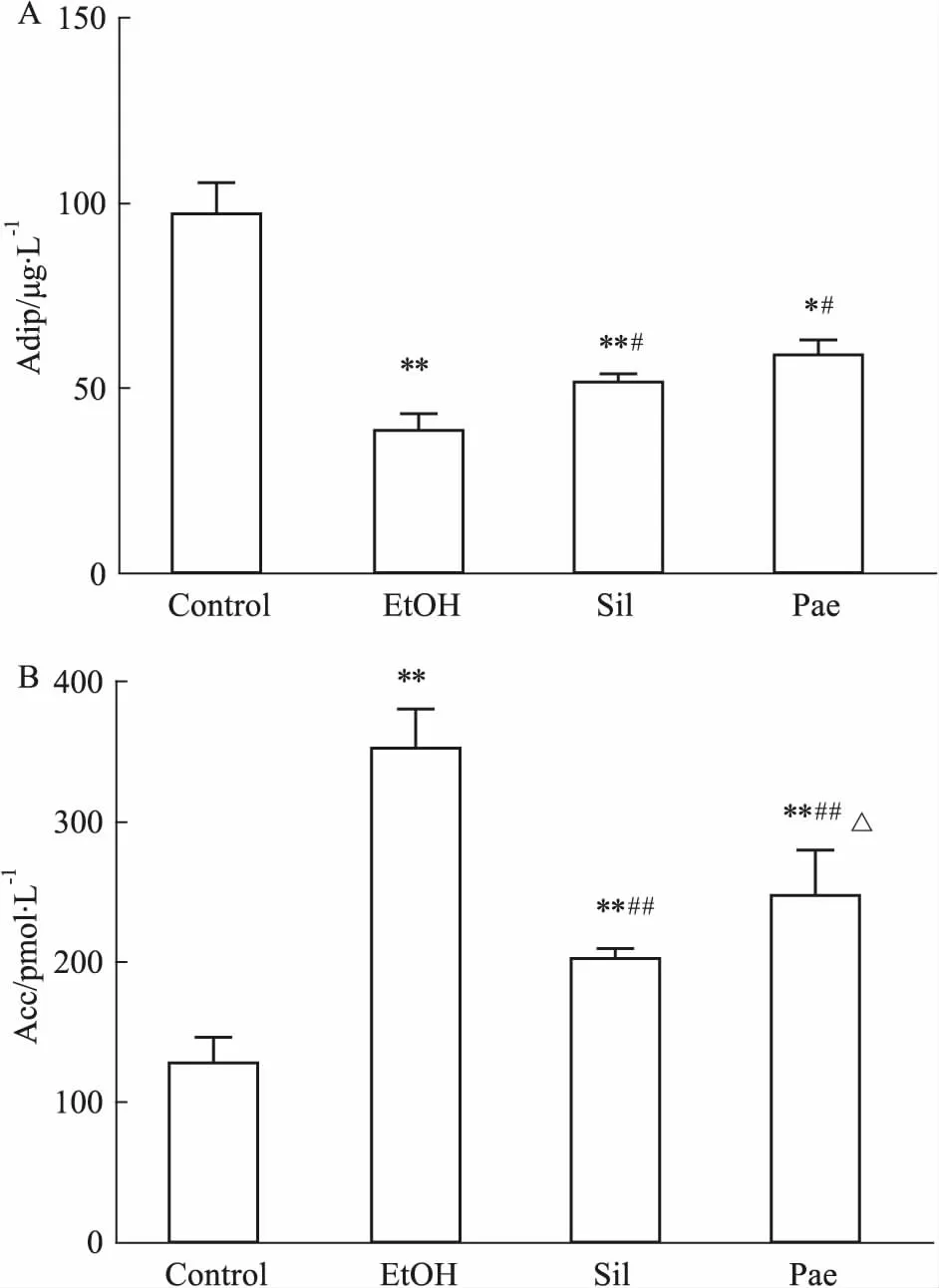
Fig 5 Effect of Pae on Adip and ACC in mice with alcoholic fatty
2.6 丹皮酚对肝脏组织中AdipR、CaMKKβ、AMPK和SREBP1c核酸水平的影响与正常组相比,模型组与两用药组AdipR1皆无差异,见Fig 6。对于CaMKKβ和AMPKα,与正常组相比,模型组皆降低(Fig 6A),分别下调6.223和5.071倍,水飞蓟宾组分别下调1.618和1.893倍,丹皮酚组分别下调2.902和2.900倍(Fig 6B),明显改善模型组下调情况。对于SREBP1c,与正常组相比,模型组皆上升(Fig 6A),上调5.702倍,水飞蓟宾组上调1.797倍,丹皮酚组下调2.779倍(Fig 6B),显著改善模型组上调情况。
2.7 丹皮酚对肝脏组织中AdipR1、CaMKKβ、AMPKα、SREBP1c蛋白水平的影响从Fig 7结果可知,与正常组相比,模型组与两用药组AdipR1皆差异无显著性。对于磷酸化CaMKKβ和AMPKα,与正常组相比,模型组皆降低;水飞蓟宾组和丹皮酚组皆改善酒精诱导引起的该蛋白磷酸化水平表达下调现象,同时,水飞蓟宾比丹皮酚更大程度改善此现象。而对于SREBP1c,与正常组相比,模型组该蛋白表达上升,水飞蓟宾组与丹皮酚组皆有一定程度下调,明显改善模型组上调情况,且两用药组差异无显著性。结合核酸水平与蛋白水平的结果(Fig 6,Fig 7),丹皮酚与水飞蓟宾皆可通过对Adip/CaMKKβ/AMPK信号转导的调节来改善小鼠酒精性脂肪肝。
3 讨论
AMPK系统是细胞能量状态的传感器,AMPK的α亚基一旦被激活,AMPK就会同时抑制能量消耗的生物合成途径和产ATP的分解代谢途径。AMPK若被抑制则促进肥胖患者的脂肪生成增加,胆固醇和糖原合成增加,糖原异生,而脂肪酸氧化和血清葡糖糖摄取过程减少[8]。有研究表明,在HeLa细胞中,增加的[Ca2+]激活CaMKKβ/AMPK通路,其参与黄芩苷对体内肝脏脂肪变性和肥胖的发展的保护作用[9]。减少脂肪细胞中的cAMP积累可改善乙醇刺激的脂肪脂解,这个过程和Ca2+/CaMKKβ/AMPK信号传导的调节相关,从而阻止脂肪酸从头合成与转运。
同时有研究称,AMPKα激活可抑制SREBP1c,有助于多酚和二甲双胍在高糖加胰岛素条件下抑制肝细胞中SREBP1c的蛋白水解切割和核转位的能力,降低饮食诱导的肝脏和血浆中TG和TC水平[9]。SREBP1c是与其靶基因(如FAS,ACC和SCD-1)结合的关键转录因子,可从而引发肝脏脂肪生成。以前有研究表明,果糖可通过上调SREBP1c,FAS,SCD-1和ACC1的表达来促进脂肪生成[10-11]。AMPKα抑制SREBP1c转位到细胞核中,以此来下调脂肪生成相关基因的表达[12]。
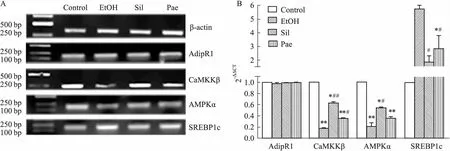
Fig 6 Expression of AdipR, CaMKKβ, AMPKα and SREBP1c genes in mice with alcoholic fatty

Fig 7B Expression of AdipR, CaMKKβ, AMPKα and SREBP1c in mice with alcoholic fatty
本次实验,我们发现在酒精诱导引起的小鼠酒精肝中,核酸水平上的CaMKKβ与AMPKα表达被抑制,SREBP1c表达却是上调;蛋白水平上,CaMKKβ和AMPKα的磷酸化被抑制,SREBP1c表达量增加。可见CaMKKβ活化后可诱导AMPK活化,而AMPK活化会抑制SREBP1c表达。在小鼠AFLD中,CaMKKβ和AMPKα表达被抑制,从而AMPK对SREBP1c表达的抑制作用就相对被减弱,导致脂肪分解代谢障碍而引起脂肪变性。这与一些文献报道的结果一致。同时,不管是核酸水平还是蛋白水平都验证了丹皮酚可一定程度的改善酒精诱导引起的上述情况。
本实验中,小鼠肝脏组织中AdipR1 的mRNA水平无变化,在蛋白水平上,仅模型组出现略微上升,而在ELISA检测中Adip水平出现明显下降。正如You等[13]提出,Adip有AdipR1和 AdipR2两个受体,作为Adip介导的信号传导,导致脂肪酸氧化增加,并减少包括肝脏在内的多个器官的脂肪积累,主要通过AdipR2,AdipR1几乎无显著性变化。在AFLD大鼠模型中,肝脏AdipoR2在mRNA和蛋白表达,以及血清总Adip表达均降低[14]。综上所述,本实验从核酸水平和蛋白水平验证了丹皮酚对AFLD小鼠的保护作用与Adip/CaMKKβ/AMPK这条信号转导调节有关。同时水飞蓟宾作为阳性对照药也可能通过干预了此信号转导来对AFLD小鼠肝损伤进行保护作用,丹皮酚与水飞蓟宾二者对上述信号转导的调节保持一致,但在甘油三酯含量上,丹皮酚比水飞蓟宾更有效降低AFLD小鼠的甘油三酯水平。
有文献报道[14],Adip可抑制脂多糖刺激Kupffer细胞和小鼠巨噬细胞中TNF-α的产生,Adip和TNF-α联合可抑制脂肪细胞中的基因表达,蛋白质合成和产生。在酒精性肝损伤早期阶段,大鼠血清中的TNF-α增加,对于Adip的酒精诱导的抑制作用可以通过增强TNF-α产生来介导,其反过来可以通过旁分泌或内分泌机制抑制脂肪组织中的Adip表达。因此,Adip产生的失调可导致多种肝脏问题,包括脂肪变性,这是酒精性肝病的早期阶段。同时有临床随机对照实验报道称[15],NAFLD患者Adip水平降低与炎症因子(如TNF-α)增加相关,姜黄素可减少脂肪组织的巨噬细胞浸润,增加Adip的产生并抑制肝脏炎症因子。本实验结果得出,AFLD小鼠血清中的Adip水平下降,TNF-α水平提高,与上述文献报道一致。因此,本实验在研究丹皮酚治疗小鼠AFLD的作用机制中,Adip/CaMKKβ/AMPK该通路参与此过程,对酒精性脂肪肝治疗提供理论依据。但本实验未在AFLD进展过程中的个时间段进行验证,未能充分确定Adip/CaMKKβ/AMPK这条信号转导和炎症因子的表达水平的变化与疾病发生发展的因果关系。因此,本实验后期将针对疾病繁盛发展过程各时间节点的此信号转导的变化来进一步验证。

