CEUS评价肝硬化门静脉高压患者TIPS术后分流道支架功能
汪靖园,薛 挥,刘梦莹,台明辉,魏 炜*
(1.西安交通大学第一附属医院检验科,2.消化内科,3.超声影像科,陕西 西安 710061)
TIPS能够有效降低门静脉压力,减少消化道出血和顽固性腹腔积液发生,己经成为微创治疗终末期肝硬化门脉高压征的有效手段[1-2];但术后由于血栓或内膜增生引起的分流道支架内狭窄或闭塞可能引起门静脉压力再次升高继而复发出血[3-4],故动态监测支架功能是TIPS术后随访的重点。CDFI可通过检测支架内血流判断分流道功能[5],但受支架深度、角度及肝脏衰减等影响,部分支架内彩色血流充盈并不理想[6]。本研究探讨CEUS评价肝硬化门静脉高压患者TIPS术后分流道支架功能的价值。
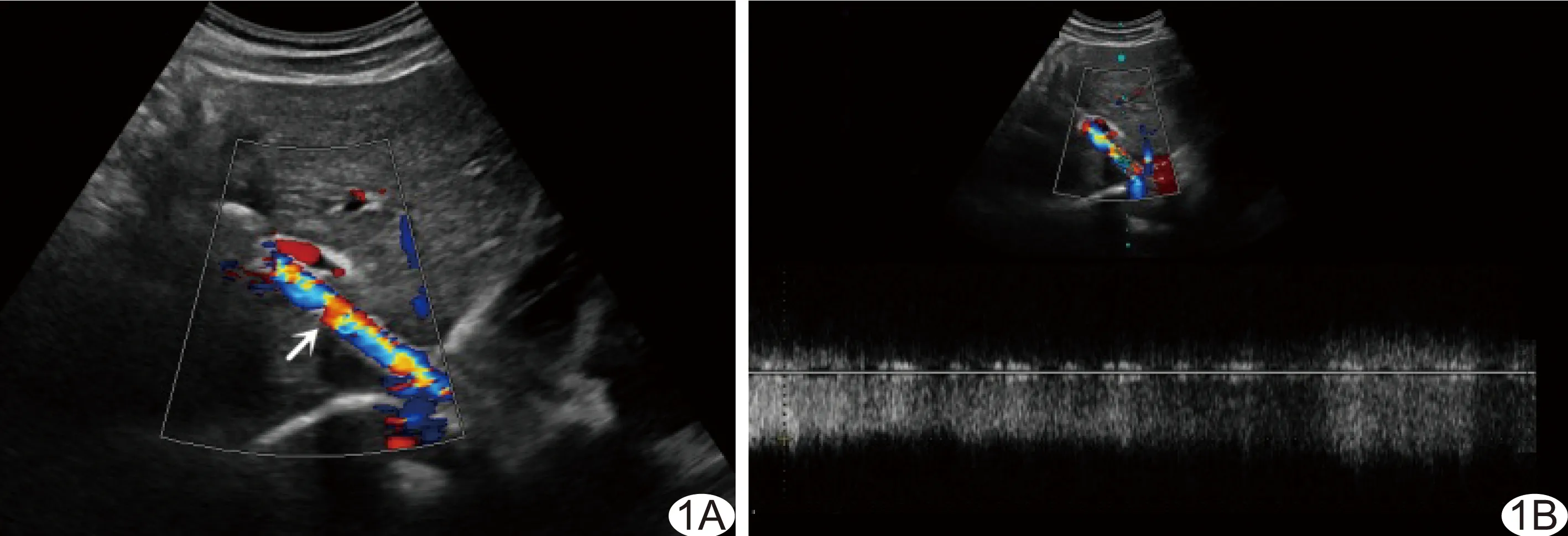
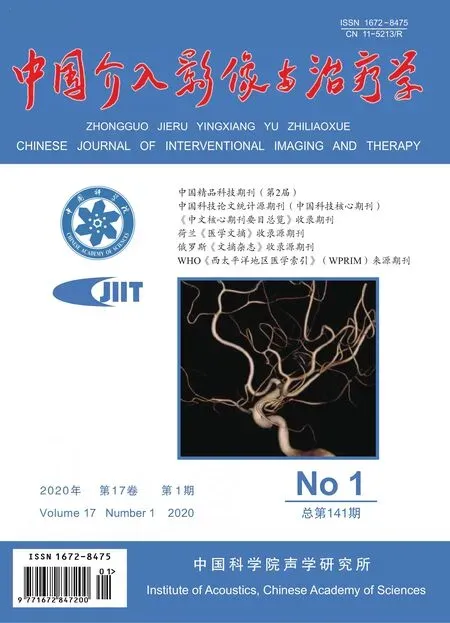
图1 患者男,46岁,TIPS术后分流道支架功能正常 A.CDFI示支架内血流全程充盈(箭),无缺损; B.CDFI示支架内血流速度为134 cm/s
1 资料与方法
1.1 一般资料 选取2016年11月—2018年9月107例于我院消化科成功接受TIPS手术的肝硬化门静脉高压患者,男64例,女43例,年龄25~61岁,平均(41.3±15.7)岁;其中单纯乙型肝炎59例、单纯丙型肝炎32例, 7例同时罹患乙型及丙型肝炎,酒精性肝硬化4例,药物性肝硬化3例,自身免疫性肝病2例。
1.2 仪器与方法 采用GE Logiq E9彩色多普勒超声诊断仪,凸阵探头C1-5,探头频率2.8~5.0 MHz。取SonoVue冻干粉(意大利Bracco公司)25 mg,注入生理盐水5 ml,快速振荡并溶解至完全分散成微泡混悬液备用。
先行常规二维灰阶超声检查,获取TIPS支架长轴切面,观察支架位置;于CDFI模式下观察支架内血流充盈情况,获得稳定血流频谱后测量血流速度,测量3次取平均值。启动CONTRAST模式,机械指数0.08~0.10。抽取已制备好的造影剂混悬液1.0 ml经肘正中静脉快速团注,同时启动计时器,重点观察支架门静脉相(20~120 s),并同步存储动态视频,监测支架增强时间、范围及有无充盈缺损,评估支架通畅情况及狭窄率。对CDFI提示支架内狭窄或闭塞病例行CEUS或DSA,CEUS提示支架内狭窄或闭塞病例均行DSA;对已复发出血或胃镜检查示复发静脉曲张病例,即使CDFI或CEUS阴性亦行DSA。
1.3 评价标准 CDFI支架通畅:支架内血流充盈完全,支架内血流速度80~240 cm/s,且支架两端血管无血栓;CDFI支架失功能:支架内血流充盈差,血流信号呈细线状、短棒状或间断分布,或流速<80 cm/s或>240 cm/s,或无血流。
CEUS支架通畅:支架内同步增强无缺损,或支架内局部少量充盈缺损,缺损处直径狭窄率<50%;CEUS支架失功能:支架内增强不均匀,局部缺损处直径狭窄率>50%,或全程均匀增强。
诊断金标准:对未接受DSA检查者,随访期6个月内未发生消化道出血或复查胃镜无静脉曲张即认为支架通畅,反之则认为支架失功能;接受DSA检查者以DSA结果为金标准。
1.4 统计学分析 采用Med Calc 12.7.0.0统计分析软件,分别计算CDFI、CEUS诊断TIPS术后支架功能的敏感度、特异度、阳性预测值及阴性预测值;以DSA结果为金标准,分别绘制CDFI、CEUS诊断TIPS术后支架功能的ROC曲线,应用Z检验比较2种检查方法的AUC。P<0.05为差异有统计学意义。
2 结果
107例患者均接受二维及CDFI超声检查,1例支架门静脉端滑脱至肝实质内,1例支架门静脉端紧贴门静脉管壁导致失功能,3例因肝脏萎缩显著及肝前肠气遮挡支架未显影;102例支架位置未见异常,其中74例CDFI提示支架通畅,血流速度(137±51)cm/s(图1),28例支架内血流充盈欠佳或无血流(图2、3),提示支架失功能。以6个月随访结果为金标准,CDFI诊断TIPS术后支架功能的敏感度、特异度、阳性预测值及阴性预测值分别为64.71%(11/17)、80.00%(68/85)、39.29%(11/28)及91.89%(68/74)。
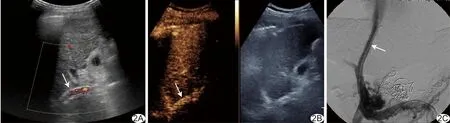
图2 患者男,51岁,TIPS术后,CDFI示分流道不全闭塞,CEUS及DSA提示分流道功能正常 A.CDFI示支架内彩色血流充盈不全,管腔内部分区域无血流信号(箭); B.CEUS示支架内腔全程均匀增强,无缺损(箭),与CDFI不符; C.DSA示支架全程显影(箭),与CEUS相符
26例接受CEUS, 17例支架全程同步均匀增强(其中11例经DSA证实支架通畅),9例支架内不均匀增强或无增强,提示支架失功能;以6个月随访结果为金标准,CEUS诊断TIPS术后支架功能的敏感度、特异度、阳性预测值及阴性预测值分别为90.00%(9/10)、100%(16/16)、100%(9/9)及94.12%(16/17);以CEUS为标准,CDFI诊断TIPS术后支架功能的敏感度、特异度、阳性预测值及阴性预测值分别为80.00%(4/5)、43.75%(7/16)、30.77%(4/13)及87.50%(7/8)。
图3 患者女,47岁,TIPS术后,CDFI、CEUS及DSA提示分流道失功能 A.CDFI示支架内彩色血流充盈不全,管腔内见细线状血流信号(箭); B.CEUS示支架内无增强(箭); C.DSA示门静脉显影,支架未显影(箭); D.DSA示支架再通后,门静脉与支架同步显影(箭)
CDFI与CEUS诊断TIPS术后支架功能的AUC分别为0.542和0.958,差异有统计学意义(Z=7.416,P<0.01)。见图4。

图4 CDFI与CEUS诊断TIPS术后支架功能的ROC曲线
3 讨论
TIPS术后保持门静脉-腔静脉分流道通畅是确保治疗效果的关键[7]。随着病程推移,各种原因引起的支架失功能可降低疗效,增加消化道出血及顽固性腹腔积液等发生危险。支架移位、支架内狭窄及闭塞是导致支架失功能的主要原因。其中支架移位造成的分流道失功能较为少见,其主要原因仍为支架内狭窄及闭塞,虽然覆膜支架的应用降低了其发生率[8],但仍有8%~20%患者发生术后支架失功能[9]。早期急性血栓或后期内膜过度增生所致支架内狭窄均为影响TIPS治疗效果的重要原因[10],而支架失功能所致门静脉压力进行性升高使患者发生再出血的风险显著增高,故尽早发现分流道失功能并及时有效处理至关重要。
DSA下分流道造影及测定门静脉-腔静脉压力梯度是临床评价支架功能的金标准,但其有创、费用高,患者依从性差,难以作为常规随诊方法。彩色多普勒超声通过血流判断支架功能,已成为术后监测分流道的主要手段[11-12],但由于支架管壁及覆膜遮挡,二维超声并不能直接判断血栓存在与否,且受超声设备彩色敏感度、肝脏硬度衰减、支架深度及角度等多种因素影响,部分病例支架彩色血流显像并不理想,可能显示为细线状、短棒状间断血流甚至无血流,造成漏诊及误诊。有学者[13]以支架内血流速度评估支架功能,但诊断标准亦不统一,且操作者手法、支架角度、患者呼吸配合度等多个因素均可能影响流速测值,尤其是当支架长轴与超声束方向垂直时,CDFI可能检测不到血流而误诊为支架失功能;而当支架内膜过度增生或血栓造成管腔狭窄时,残存管腔高速血流可能掩盖狭窄造成的总分流量下降,故仅以支架内血流充盈情况或流速评价支架功能可能并不完全可靠。本研究中部分病例CDFI结果与DSA所见相反,也印证了上述论点。
CEUS通过提高靶目标局部血流显像以获得更多信息,已广泛应用于诊断各器官及脏器病变[14]。本研究以CEUS判断支架功能,发现其诊断敏感度90.00%(9/10)、特异度100%(16/16)、阳性预测值100%(9/9)及阴性预测值94.12%(16/17)均显著高于CDFI[敏感度64.71%(11/17)、特异度80.00%(68/85)、阳性预测值39.29%(11/28)及阴性预测值91.89%(68/74)]。以CEUS结果为参照,本组CDFI诊断特异度仅43.75%(7/16),阳性预测值30.77%(4/13),且CEUS与DSA结果相近,提示CDFI相较于CEUS阳性发现可信度较低,由于不能判断支架内是否存在狭窄,部分彩色血流充盈不佳病例即使测得高速血流亦不能评估支架功能;而CEUS能够完整显示支架内通畅情况,可较为客观准确地判断支架内狭窄,有效避免假阳性误判,诊断准确率较高,与以往研究[15]相符;如CDFI显示支架内无血流信号,造影模式下亦无增强,则可以充分肯定支架闭塞诊断,提高诊断效能。本研究中仅1例CEUS提示支架近心端局部狭窄而DSA阴性,原因可能为于DSA下C2管伸入支架内团注对比剂,新鲜血栓受C2管挤压可能破裂碎解,同时短时间内团注对比剂造成的局部高压可能促进血栓进一步脱落回心,出现局部狭窄程度降低或消失,造成CEUS假阳性结果。该例患者并未出现肺栓塞症状,可能与破裂碎解血栓较小、未栓塞肺动脉主干有关。笔者据此认为DSA下介入造影过程亦可能改变支架狭窄状态,相较而言,无创的CEUS可能更能够反映真实情况。本组CEUS诊断TIPS术后支架功能的AUC高达0.958,远高于CDFI的0.542,提示CEUS的诊断效能显著优于CDFI,接近DSA。
综上所述,CEUS可较为客观地反映TIPS术后支架通畅情况,弥补常规超声对于支架管腔显示不清、彩色血流充盈不佳等缺点,避免不必要的有创操作,判断支架功能的敏感度和特异度较高。但CEUS仅能提示支架是否通畅,不能提供血流动力学信息,可能忽视流速降低导致的分流功能下降。CEUS联合CDFI能更为全面客观地综合评价支架功能。虽然CEUS诊断效能高度接近DSA,但必须以二维超声能够清晰显示支架为基础,对于肝脏显著萎缩、肝前网膜或肠气衰减导致支架不能显示者,CEUS并不能替代DSA。