磷酸三苯酯(TPP)和磷酸三(2-氯异丙基)酯(TCPP)诱导人胚肾细胞HEK293凋亡的机制研究
王晓晴,刘佳琳,李斐,*,曹天贵,吴惠丰,2,孟祥敬,吉成龙,2
1. 中国科学院海岸带环境过程与生态修复重点实验室,中国科学院烟台海岸带研究所,山东省海岸带环境过程重点实验室,烟台 264003 2. 青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室,青岛 266237 3. 中国科学院大学,北京 100049
随着溴系阻燃剂在全球范围内被逐步禁用,有机磷酸酯阻燃剂(OPFRs)被广泛应用于建筑材料、电子产品、塑料制品、家装饰品和纺织品中,降低各种材料的易燃性[1]。由于是添加型阻燃剂,OPFRs进入环境的几率较高,目前已经在大气、水体等多种环境介质及生物体中检出OPFRs,并且其浓度呈现逐年增长的趋势[2-5]。释放到环境中的OPFRs在结构上类似于具有神经毒性的有机磷杀虫剂,具有潜在的环境和健康风险[6-13],Dishaw等[1]发现,磷酸三(2-氯异丙基)酯(TCPP)、磷酸三(2-氯乙基)酯(TCEP)和磷酸三(1,3-二氯异丙基)酯(TDCPP)等通过减少细胞数量、改变神经分化等方式影响神经发育,研究表明,部分OPFRs具有与四溴联苯醚(BDE-47)和部分有机磷农药相当甚至更强的神经发育毒性。Liu等[6]研究发现,斑马鱼暴露于TCPP和TDCPP后,均能显著干扰其体内性激素的平衡,具有一定的内分泌干扰作用。此外,研究发现,室内灰尘中含有多种较高浓度的OPFRs,对人体健康具有潜在的不良影响。例如,Meeker和Stapleton[7]发现,室内粉尘中检测到的部分高浓度OPFRs包括TDCPP和磷酸三苯酯(TPP)会降低男性相关激素水平(甲状腺激素和雄性激素)和精子浓度,造成精液质量下降,甚至可能引起不孕不育等不良结局。Wang等[8]的研究显示,烷基和芳基取代的OPFRs能够显著抑制氨基酸脱氢酶的活性。因此,深入研究OPFRs的毒性机制是极为必要的,为该类化合物污染的早期防控和管理提供基础理论数据。
肾脏是生物体的重要器官,在机体进行代谢、排毒和调节内稳态等方面发挥着重要作用。若肾脏细胞(人胚肾细胞HEK293)受损,很可能干扰肾脏的正常功能,对机体造成不利影响。目前,关于OPFRs对肾细胞毒性的研究尚不充分,有必要探讨OPFRs对HEK293细胞的毒理效应机制。细胞凋亡已被认为是污染物对细胞毒性效应的重要表现。近年来,已有研究表明,OPFRs可刺激细胞诱导细胞凋亡[14-18]。线粒体作为执行细胞凋亡的主要细胞器[19],在凋亡发生过程中,伴随着线粒体功能(膜通透性改变、膜电位的降低)和形态的改变,导致胞内活性氧(ROS)水平的升高,进而通过DNA损伤的方式诱导细胞凋亡[20]。作为关键抑癌基因p53,其突变与半数肿瘤的发生相关[21-22]。当污染物小分子以较强的作用力(嵌插作用或共价结合)结合DNA时,可通过抑制DNA的复制转录或碱基错配等方式,引起DNA点突变[23-24]。目前有关OPFRs诱导细胞凋亡机制的研究工作也已展开,但凋亡效应机制尚不明晰。
本研究选取2种代表性OPFRs(TPP和TCPP),采用流式细胞仪和实时荧光定量PCR(qRT-PCR)技术,研究了TPP和TCPP对人胚肾细胞HEK293的相关基因(细胞增殖、细胞凋亡和氧化应激)表达量变化的影响,探讨其诱导细胞凋亡的机制。鉴于OPFRs对HEK293细胞中p53基因的表达水平均可造成影响,结合紫外-可见光谱和荧光光谱,进一步检测了TPP和TCPP与p53-DNA之间的结合方式并计算结合作用常数,研究TPP和TCPP诱导的细胞ROS升高、造成的DNA损伤与细胞凋亡之间的相关性,阐明TPP/TCPP与p53基因的作用机制,为OPFRs的毒性效应机理研究提供参考依据。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
仪器:SW-CJ-1FD型洁净工作台和YXQ-LS-50SII立式压力蒸汽灭菌锅(上海博迅实业有限公司);INCO2/108型二氧化碳培养箱(德国Memmert公司);XDS-1B型倒置生物显微镜(重庆光学仪器厂);5804R台式高速冷冻离心机(德国Eppendorf公司);FACSAria流式细胞仪(美国BD公司);Nanodrop2000微量紫外分光光度计(美国Thermo公司);7500Fast实时荧光定量PCR仪(美国Applied Biosystems公司)。
试剂:TPP和TCPP购自德国Dr. Ehrenstorfer公司;胎牛血清、DMEM培养基、胰蛋白酶、青霉素及链霉素溶液(双抗)以及磷酸盐溶液(phosphate buffered saline, PBS)均购自美国Hyclone公司;二甲基亚砜(dimethyl sulfoxide, DMSO),纯度>99%,购自美国MP Biomedicals公司;Annexin V-FITC细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司;2’,7’-二氯荧光素双乙酸盐(2’,7’-dichlorodihydrofluorescin diacetate, DCFH-DA)购自美国Sigma公司;TRIzol总RNA提取试剂购自日本宝生物工程株式会社;SYBR Green实时定量PCR试剂盒购自美国Applied Biosystems公司。其他试剂均为国产分析纯,实验用水为超纯水。
1.2 细胞培养及细胞增殖
将复苏的HEK293细胞培养在完全培养基(90% DMEM培养基中加入10%的胎牛血清和1%的双抗)中,培养条件为37 ℃、5% CO2和相对湿度95%。传代培养,直至细胞达到对数生长期。TPP/TCPP溶于二甲基亚砜(DMSO)制成不同浓度的暴露溶液,等量的DMSO作为溶剂对照组。
达到对数生长期的HEK293细胞,经PBS清洗、胰蛋白酶消化、培养液重悬、离心和弃上清液后,再次加入培养液,并将其接种于96孔板中,进行培养。每孔加入终浓度分别为0 (溶剂对照组)、10-10、10-9、10-8、10-7、10-6、10-5和10-4mol·L-1的TPP及TCPP暴露溶液。培养24 h后,加入培养液和CCK-8试剂,于培养箱孵育1 h,使用酶标仪测吸光度(450 nm)。
1.3 细胞凋亡及活性氧(ROS)的影响
将处于对数生长期的HEK293细胞暴露于不同浓度(10-6、10-5和10-4mol·L-1)的TPP和TCPP中,细胞培养24 h后,经染色处理(细胞凋亡测定采用Annexin V-FITC/PI凋亡试剂盒染色,ROS水平测定采用DCFH-DA荧光染料染色),上样分析。
细胞凋亡:收集暴露后的细胞用PBS缓冲液重悬,按照操作手册加入相应剂量的Annexin V-FITC和碘化丙啶(PI),分别避光孵育。使用流式细胞仪进行检测(细胞数量为1×104个),分析细胞凋亡率。
细胞内ROS水平:收集暴露后的细胞用PBS缓冲液重悬,加入5 μL 5×10-4mol·L-1的DCFH-DA溶液,避光孵育1 h。使用流式细胞仪测定细胞内DCFH荧光强度,参数设置为:激发波长488 nm,发射波长525 nm。
1.4 凋亡相关基因表达水平的检测
采用TRIzol法提取RNA。加入氯仿离心分层样品,收集上清液(含RNA),向其中加入异丙醇,用于沉淀还原RNA(实验条件≤0 ℃,用以抑制RNA酶的活性)。采用微量紫外分光光度计测定RNA浓度(浓度范围:A260 nm/A280 nm介于1.8~2.2,A260 nm/A280 nm分别为RNA于260 nm与280 nm处吸光度)。将样品浓度调至500 mg·L-1,进行cDNA反转。随后,采用SYBR Green荧光定量试剂盒进行qRT-PCR检测,检测凋亡相关基因的表达水平,2-ΔΔCt法处理数据[25]。
1.5 分子模拟
分子模拟技术被用于研究小分子配体与双螺旋DNA间的结合位点和作用模式,进而确定两者的结合作用机理。首先,通过网站(http://structure.usc.edu/make-na/server.html)获得p53基因的三维结构。采用Discovery studio 2.5(简称DS 2.5)研究TPP/TCPP与p53基因片段间的结合构象,相关参数采用默认设置。采用动力学和模拟退火方法优化和精确配体-受体构象。分子对接的结果有助于剖析OPFRs与p53基因片段间的关键相互作用。
1.6 光谱法测定TPP/TCPP与p53基因的相互作用
光谱法通过测定吸光度及荧光强度的改变,研究小分子配体与DNA间相互作用。目前广泛利用紫外-可见吸收光谱法和荧光光谱法研究污染物与DNA之间的作用。
紫外-可见吸收光谱法利用DNA碱基的光学特性,研究污染物结合DNA对吸收峰的峰位置及峰强度的影响。通过p53基因启动子区域片段(p53-DNA)的2条互补单链DNA序列合成双链p53-DNA溶液(5×10-4mol·L-1)。将p53-DNA稀释至2×10-6mol·L-1,并与TPP和TCPP溶液等体积混合,配制成一定浓度的混合溶液(混合溶液中TPP/TCPP的浓度为0、1×10-6、2×10-6、4×10-6、6×10-6、8×10-6和10×10-6mol·L-1,p53-DNA的浓度为1×10-6mol·L-1)。避光反应2 h后,进行紫外-可见吸收光谱扫描,扫描范围为190~350 nm。

图1 磷酸三苯酯(TPP)和磷酸三(2-氯异丙基)酯(TCPP)对HEK293细胞增殖的影响注:与对照组相比,* P<0.05、** P<0.01。Fig. 1 Effect of triphenyl phosphate (TPP) and tris(1,3-dichloro-2-propyl)phosphate (TCPP) on the proliferation of HEK293 cellsNote:*P<0.05, **P<0.01, compared with the control.
荧光光谱法利用溴化乙锭(EB)嵌入结合DNA产生荧光,EB本身不具备较强的荧光,与DNA结合后荧光强度大大增强。基于此特性,可通过检测不同浓度下TPP/TCPP对EB-p53-DNA体系荧光强度的影响,研究污染物小分子与DNA间的相互作用。用PBS缓冲液稀释p53-DNA溶液,p53-DNA稀释液(1×10-6mol·L-1)与EB原液(1×10-3mol·L-1)按1:100的比例混合,避光30 min,使两者充分结合,得到EB-p53-DNA体系。将不同体积的TPP/TCPP原液与EB-p53-DNA体系混合,配成终浓度为0、1×10-6、2×10-6、4×10-6、6×10-6、8×10-6和10×10-6mol·L-1的混合液。避光反应2 h后,采用荧光分光光度计进行荧光光谱扫描,参比溶液为PBS缓冲液、扫描范围为190~350 nm,发射波谱范围为500~800 nm,激发波长为480 nm。
2 结果(Results)
2.1 TPP和TCPP对HEK293细胞增殖的影响
通过CCK-8试剂盒检测TPP及TCPP对HEK293细胞增殖的影响,结果如图1(a)和1(b)所示,10-9~10-4mol·L-1TPP及TCPP对细胞增殖存在从促进到抑制的过程(P<0.05)。因此,选取后续暴露浓度10-6、10-5和10-4mol·L-1。
2.2 TPP和TCPP对HEK293细胞凋亡及ROS的影响
处于对数生长期的HEK293细胞经暴露培养24 h后,基于Annexin V-FITC/PI凋亡试剂盒及DCFH-DA荧光染料,通过流式细胞仪分别观测其细胞凋亡情况及细胞内ROS水平。图2(a)和图2(b)分别为不同浓度TPP和TCPP对HEK293细胞凋亡及胞内ROS水平的影响。
由图2(a)可知,与对照组相比,TPP暴露组的凋亡率显著上升(P<0.05),且与浓度呈正向的剂量-效应关系;TCPP浓度为10-5和10-4mol·L-1时,细胞凋亡率亦显著上升(P<0.05);在各浓度组中,TPP比TCPP造成的细胞凋亡率更高。证明一定浓度的TPP和TCPP均可诱导HEK293细胞凋亡,TPP更易诱导HEK293的细胞凋亡。由图2(b)可知,TCPP各暴露组相对于对照组ROS水平均显著上升(P<0.05),与凋亡结果相一致;而TPP则表现为:10-6和10-5mol·L-1暴露组显著提高细胞内的ROS水平(P<0.01),而在10-4mol·L-1暴露组中,ROS含量显著降低(P<0.01),这可能由于高浓度(10-4mol·L-1)的TPP导致大量细胞死亡及破碎,导致胞内ROS水平无法被检测到。Chen等[26]研究发现,TPP可以诱导氧化损伤,影响抗氧化酶和相关基因的表达,包括谷胱甘肽过氧化物酶(GPX)、过氧化氢酶(CAT)和谷胱甘肽S-转移酶(GST)。
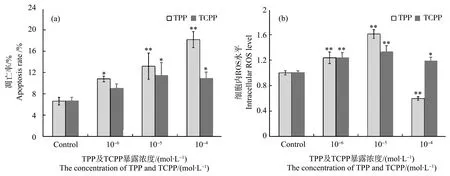
图2 TPP和TCPP对HEK293细胞凋亡和细胞内活性氧(ROS)水平的影响注:与对照组相比,* P<0.05、** P<0.01。Fig. 2 Effects of TPP and TCPP on apoptosis and reactive oxygen species (ROS) level in HEK293 cellsNote: compared with the control, * P<0.05, ** P<0.01.
2.3 TPP和TCPP对HEK293细胞凋亡相关基因表达量的影响
处于对数生长期的HEK293细胞暴露培养24 h后,采用TRIzol法提取RNA,经变性、反转后获得cDNA。采用SYBR Green荧光定量试剂盒进行实时荧光定量PCR。选取的凋亡相关基因主要包括p53、Bcl-2家族成员的编码基因(Bcl-2、Bax、Bad和Hrk)以及Caspases家族成员的编码基因Caspase7。目的基因及内参基因(HPRT1)引物设计如表1所示。对qRT-PCR数据采用2-ΔΔCt法进行处理,得到HEK293细胞中各凋亡相关基因表达水平的变化如表2所示。
与对照组相比,TPP暴露组中,除了Bax及Hrk基因的表达量,p53、Bcl-2、Bad和Caspase7基因的表达量随TPP和TCPP浓度的升高而逐渐增加。在10-6mol·L-1及10-5mol·L-1TPP暴露组中,Bcl-2表达量显著上升(P<0.05);10-4mol·L-1TPP暴露使Bad及Caspase7表达量显著上升(P<0.05),p53及Bcl-2表达量显著上升(P<0.01)。在10-5mol·L-1TCPP暴露组中,p53及Bax表达量显著上升(P<0.05),Hrk表达量显著上升(P<0.01);10-4mol·L-1TCPP暴露使p53、Bax、Bcl-2及Caspase7表达量显著上升(P<0.05),使Bad及Hrk表达量显著上升(P<0.01)。基因表达量的显著改变,指示了线粒体途径中的Bcl-2家族通过相互作用共同促使MPTP开放,进而导致HEK293细胞的凋亡。
qRT-PCR结果显示,中浓度组(10-5mol·L-1)及高浓度组(10-4mol·L-1)的TPP及TCPP暴露上调了p53基因的表达水平,推测过多ROS的产生造成DNA损伤,进而促使p53基因过表达参与细胞凋亡。这与细胞凋亡结果存在一致性,且p53基因的表达水平随OPFRs浓度的升高而上调。这说明,p53基因在TPP及TCPP诱导的HEK293细胞凋亡中同样发挥重要作用。此外,TPP及TCPP暴露上调了HEK293细胞p53及Bax基因,推测2种典型OPFRs通过上调细胞内p53基因水平,进而促进Bax的表达并转移至线粒体。此外,表2中Caspase凋亡执行因子Caspase7的表达量在TPP及TCPP的高浓度组(10-4mol·L-1)被上调,说明在线粒体途径后期,Caspase7被激活,进而实现凋亡。

表1 qRT-PCR引物序列Table 1 Gene-specific primer sequences used for qRT-PCR
2.4 分子模拟TPP/TCPP与p53-DNA的相互作用
基于qRT-PCR的实验结果,选取p53基因作为与凋亡相关的靶标基因,通过分子对接研究TPP/TCPP分子与p53间的相互作用方式。如图3所示,TPP/TCPP与DNA分子通过氢键、疏水和π-π相互作用紧密结合。TPP的苯环通过嵌入方式插到DNA双螺旋结构中,从而损伤双螺旋结构(图3(a)),TCPP通过沟槽结合方式影响DNA结构(图3(b))。
2.5 TPP/TCPP与p53-DNA结合作用的研究
通过分子对接构象分析,发现TPP和TCPP能够与p53结合,插到DNA的双螺旋中,从而损伤双螺旋结构。进一步采用光谱法从分子水平探究TPP及TCPP诱导细胞凋亡的效应机制。
紫外-可见吸收光谱法研究发现,加入TPP/TCPP后,p53基因片段在255 nm处的吸收峰峰位随OPFRs浓度的增加而产生蓝移(1.0~3.5 nm),详情见表3。吸光度随OPFRs浓度的增加而增大,产生增色效应(图4(a)和图4(c)),这说明,TPP/TCPP可能通过插入p53-DNA碱基对中,破坏DNA双螺旋结构。图4(b)和图4(d)为不同浓度TPP/TCPP与EB-p53-DNA相互作用的荧光光谱。TPP/TCPP使得EB-DNA体系的荧光强度(597 nm)随OPFRs浓度的增加而减小,造成荧光猝灭。

图3 TPP/TCPP分子与p53在结合位点的相互作用注: 配体键, 受体键,氢键,具有疏水作用的受体氨基酸残基,相应的具有疏水作用的原子。Fig. 3 Docking views of TPP/TCPP and hydrophobic interaction between TPP/TCPP and p53 gene in the binding siteNote: Ligand bond; Non-ligand bond; Hydrogen bond and its length; Non-ligand residues involved in hydrophobic contacts; Corresponding atoms involved in hydrophobic contacts.

图4 TPP/TCPP与p53-DNA片段相互作用的紫外和荧光光谱注:1~7表征不同浓度组,依次为0、1×10-6、2×10-6、4×10-6、6×10-6、8×10-6和10×10-6 mol·L-1。Fig. 4 The UV-Vis spectra and fluorescence spectra of the interaction between TPP/TCPP and p53-DNA fragmentsNote: Curve 1 to 7 representing different concentration groups, i.e., 0, 1×10-6, 2×10-6, 4×10-6, 6×10-6, 8×10-6 and 10×10-6 mol·L-1.
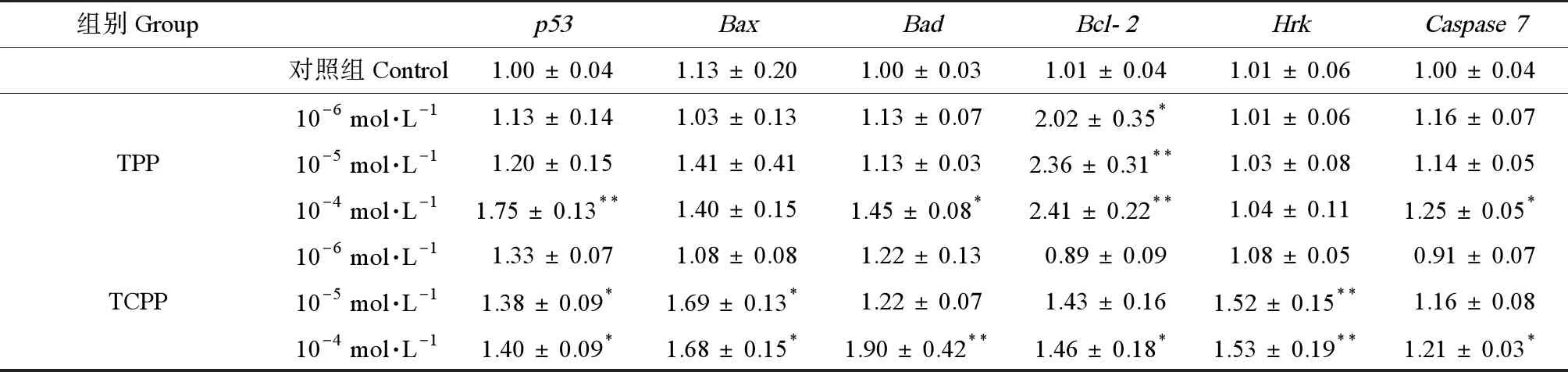
表2 不同浓度TPP/TCPP对HEK293细胞凋亡相关基因表达量的影响Table 2 The expression of apoptosis-related genes in HEK293 cells under different concentrations of TPP/TCPP
注:与对照组相比,*P<0.05、**P<0.01。
Note: compared with the control,*P<0.05,**P<0.01.

表3 TPP/TCPP与p53基因片段作用的紫外和荧光光谱相关数据Table 3 Relevant data values of ultraviolet and fluorescence spectra of TPP/TCPP and fragments of p53 gene
3 讨论(Discussion)
Bcl-2家族对细胞凋亡具有重要的调控作用,其中既有促进凋亡的蛋白(如Bax),也有抑制凋亡的蛋白(如Bcl-2)[27-28]。Bcl-2家族成员大多数定位于线粒体外膜上。因此,Bcl-2家族主要通过改变线粒体膜的通透性,进而影响内源线粒体凋亡途径来调控凋亡[27]。本研究选取了一系列Bcl-2家族蛋白的编码基因进行研究,包括Bcl-2(抑制凋亡)、Bax、Bad和Hrk(促凋亡)。其中,Bax基因的启动子能够结合与DNA损伤修复相关的p53基因。当外界刺激或内源活性氧升高造成DNA损伤时,p53基因首先通过阻碍细胞周期,抑制细胞增殖,进而修复损伤。当损伤无法修复时,p53基因又通过多种途径诱导细胞凋亡[29-31]。故在凋亡早期,p53基因能够促进Bax的转录表达[29]。本实验中,Bax基因的表达水平在TPP和TCPP高浓度组(10-4mol·L-1)均出现上调趋势,推测TPP和TCPP上调HEK293细胞内的p53基因水平,进而促进Bax的表达并转移至线粒体中。
Caspase家族是凋亡的主要参与者,在线粒体途径后期,细胞色素c(cyt c)被线粒体释放至胞质中。cyt c与凋亡蛋白活性因子-1(Apaf-1)结合,在dATP/ATP存在下,活化Caspase9,进而激活下游的Caspase凋亡执行因子Caspase7,实现细胞凋亡。结合转录水平的结果,分析TPP及TCPP诱导HEK293细胞凋亡的机制(图5)。一定剂量的TPP及TCPP通过上调HEK293细胞内的p53基因水平,促进Bax等基因的表达,进而在线粒体途径中释放cyt c,最终激活Caspase7实现凋亡。
分子模拟技术有助于研究小分子配体与受体间的结合作用机理[32]。研究表明,小分子与双螺旋DNA的结合方式主要包括静电式、嵌入式和沟槽式[33-34]。分子对接的结果显示,TPP及TCPP与p53片段通过嵌入式和沟槽式结合,嵌插到DNA双螺旋中,进而损伤DNA结构。结合紫外及荧光谱图分析发现,EB的置换量与TPP的浓度呈现正相关关系。推测TPP在嵌入式结合p53片段的过程中,同EB竞争p53-DNA的结合位点,将EB从DNA的双螺旋中置换出来,造成结合DNA的EB浓度降低,体系荧光强度减弱。而TCPP以沟槽方式结合p53-DNA,改变基因片段的框架结构,造成EB的流出,引起荧光猝灭。结合实验和分子对接结果,说明了TPP/TCPP与p53的结合,在一定程度上影响了p53-DNA的结构,进而干扰了相关基因(Bax、Hrk、Bcl-2和Bad)的转录、翻译和表达,导致线粒体途径释放cyt c,最终激活Caspase7实现细胞凋亡。本研究探讨了典型OPFRs诱导凋亡的有害结局通路(AOP)通路,为化学品的污染防控提供基础参考数据。

图5 TPP/TCPP诱导HEK293细胞凋亡通路图Fig. 5 The apoptosis pathway of HEK293 cells induced by TPP/TCPP

