新兴污染物对微藻的毒性作用与机制研究进展
洪喻,郝立翀,陈足音
北京林业大学环境科学与工程学院,北京 100083
新兴污染物(emerging contaminants, ECs)在2002年由Richardson提出[1],一般指尚未被相关的环境管理政策法规或排放控制标准限制,但根据其高检出频率,被视为存在潜在健康影响并有可能被纳入管制范围的物质。这类物质通常不是新合成物质,而是已长期存在环境中,但由于普遍浓度较低和监测手段的局限,其普遍存在的特性和潜在的危害在近期才被发现和研究。近年来,人们关注较多的新兴污染物有全氟化合物(perfluorinated compounds, PFCs)、微塑料(microplastics, MPs)、药品及个人护理品(pharmaceuticals and personal care products, PPCPs)和多环芳烃(polycyclic aromatic hydrocarbons, PAHs)等[1-5];此外,人造甜味剂[5-6]、卤代甲磺酸[7]和稀土元素[8]等也逐渐引起关注。在研究污染物的水生态毒理学时发现,新兴污染物在水环境中的长期存在,不仅对生活用水的安全构成了威胁,还影响着湖库、海洋及流域的生物生存与群落结构,干扰甚至破坏生态系统的可持续发展,存在巨大的安全隐患。
近些年来,许多学者从基因、分子、生化、细胞、生理器官、个体、种群及群落等不同生命层次,来研究有毒有害因素(特别是环境污染物)对水生生态系统中各种动物、植物与微生物的影响,通过直接或间接的分析检测,解析损害作用、影响规律与可能的作用机制,研究结果可为水环境中污染物的防治、水环境保护及生态风险评价提供理论基础与数据支持。微藻是研究水生生态必不可少的对象,常用来评价水生生态系统的健康程度。污染物对微藻的影响表现在多个方面,如对微藻生长、细胞形态和结构、光合作用、细胞内氧化还原平衡及活性酶水平的影响等。同时,微藻也是重要的水环境监测指示生物,一直被用来直观判断水体的污染程度;近些年来,不仅水生生态学和环境监测中利用微藻进行研究,微藻还被视为水生态毒理学的重要研究对象。
本文综述了包括全氟化合物、多环芳烃、药品及个人护理品、纳米材料、微塑料和稀土元素在内的共6类新兴污染物对微藻的毒性作用与机制,通过总结分析提出建议和展望,以期服务于该领域今后的发展。
1 全氟化合物对微藻的毒性作用与机制(Toxic effects and mechanisms of perfluorochemicals on microalgae)
PFCs是一类广泛存在于自然环境中的持久性有机污染物,被广泛应用于工业生产和日常生活的诸多领域中,如作为表面活性剂和表面保护剂应用于地毯、皮革、造纸、包装、家具、碱性清洁剂、洗发水和杀虫剂等产品的制作中。自20世纪中期至今,已有数百种含有全氟有机化合物产品被开发、生产并大规模应用。
Latala等[9]研究全氟化合物对微藻的毒性影响发现,绿藻对全氟羧酸的敏感性高于全氟磺酸盐或全氟羧酸的铵盐,而蓝藻和硅藻对这些化合物的敏感性远远高于绿藻。表1中总结了现有的全氟污染物对微藻的半数效应浓度(medium effective concentration, EC50),发现全氟羧酸的毒性影响显著强于全氟盐类。同时,除全氟辛磺酸(perfluorooctanesulfonate, PFOS)和Polyfox 656外,全氟化合物对绿藻的毒性影响显著弱于蓝藻和硅藻。全氟化合物因其独特的表面高疏水性而备受关注,然而该特性也可能导致其掺入微藻细胞膜的脂质双分子层从而引起膜通透性增大。Xu等[10]研究表明,高浓度PFOS显著增加小球藻细胞膜的通透性,低浓度PFOS对通透性改变不明显,而细胞膜高通透性可能造成PFOS刺激胞内活性氧自由基的产生,从而引起其他生物大分子的脂质过氧化损伤,这可能是其毒性作用的主要机制。PFCs的烷基链长度或分配系数不同反映其亲脂性差异,可对细胞膜通透性产生影响,因而影响其对藻的毒性效应。一般来说,PFCs对微藻的EC50值随着链增长而降低,LogEC50值与链长具有良好的线性关系[9,11]。由表1总结亦可发现上述规律,表明当全氟化合物链增长时毒性影响也随之增大。
微藻长期暴露于低浓度的全氟辛酸(perfluorooctanoic acid, PFOA)细胞内也会产生过多的活性氧自由基(reactive oxygen species, ROS),致使细胞出现膜脂质过氧化在内的氧化损伤。例如,全氟辛酸(PFOA)可显著抑制2种绿藻包括蛋白核小球藻(Chlorellapyrenoidosa)和羊角月牙藻(Selenastrumcapricornutum)的生长[12],PFOA具有高疏水疏油的表面活性,可导致细胞膜通透性的降低并可通过被动转运进入微藻细胞,使得叶绿素a和叶绿素b含量降低,超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)活性随着浓度增加出现先增加后降低,其中羊角月牙藻对PFOA的耐受浓度高于蛋白核小球藻。在PFOS的影响下,普通小球藻(Chlorellavulgaris)细胞内丙二醛(malondialdehyde, MDA)和活性氧含量随着PFOS浓度的增加而增加,SOD和CAT活性先增加后降低;PFOS使小球藻的叶绿素a浓度降低,使得藻细胞生长和繁殖受到抑制,而高浓度PFOS能使藻细胞叶绿素b浓度降低,进而加剧对藻光合作用的影响[10]。
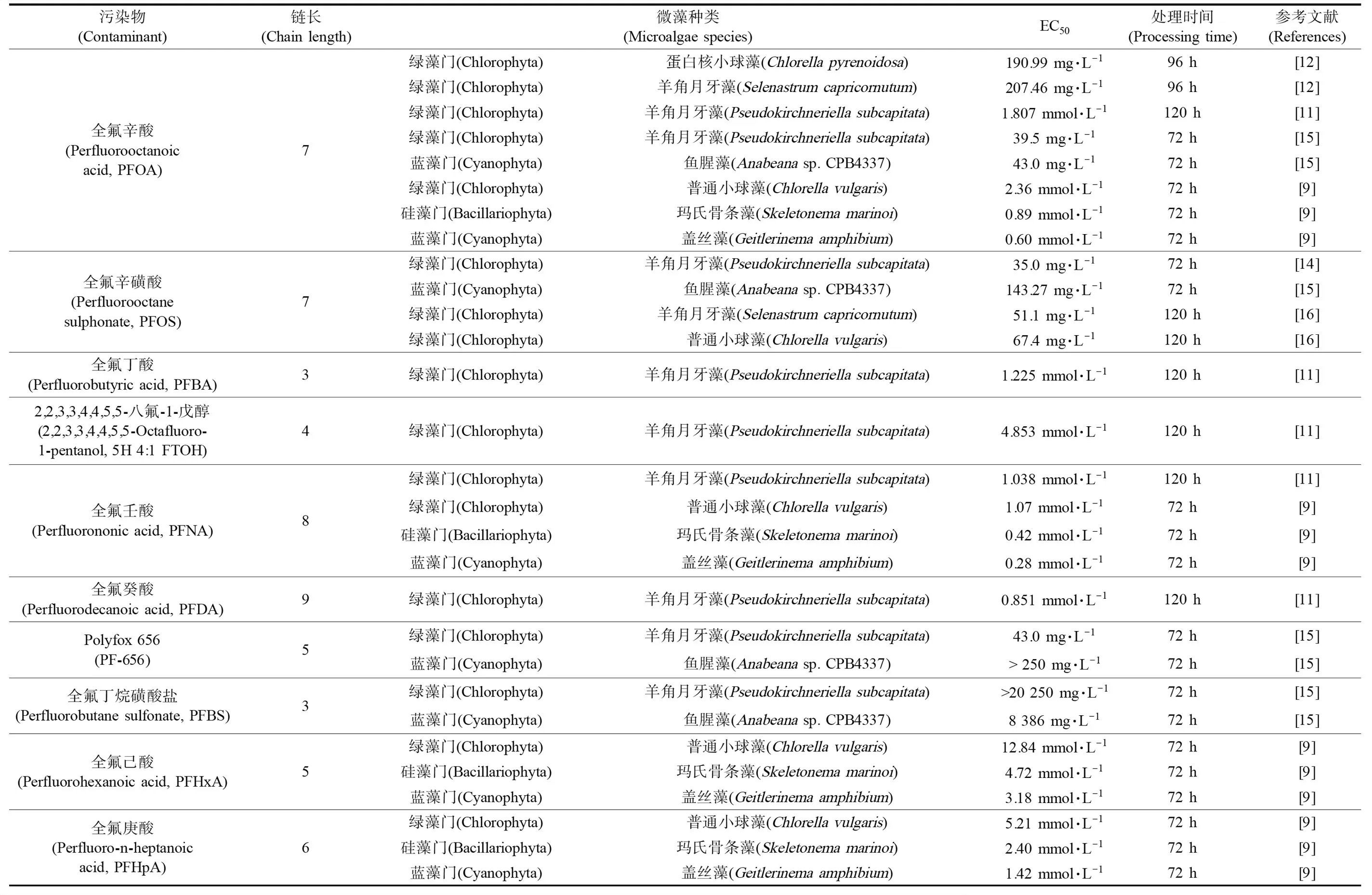
表1 全氟化合物(PFCs)对微藻的毒性作用Table 1 Toxicities of perfluorinated compounds (PFCs) on microalgae
PFOS的毒性作用还表现在与其他污染物的联合作用上,无论其他单个污染物的毒性程度如何,PFOS的存在都将改变共存污染物的表观毒性。PFOS可能通过对细胞膜功能的破坏,影响藻细胞对其他污染物的摄取,进而对不同疏水性有机化合物的毒性产生差异性影响,表现为协同或拮抗作用[13]。因此,当PFOS与其他类型污染物共存时,可能会对水生生态系统带来潜在风险[14]。
2 多环芳烃对微藻的毒性作用与机制(Toxic effects and mechanisms of polycyclic aromatic hydrocarbons on microalgae)
多环芳烃(polycyclic aromatic hydrocarbons, PAHs)是煤、石油、木材和纸张等在不完全燃烧或还原性气氛中热分解产生的挥发性碳氢化合物,是一类持久性有机污染物。迄今已发现有200多种PAHs,其中相当一部分具有致癌性,如苯并[α]芘和苯并[α]蒽等。多环芳烃对微藻的毒性作用亦表现出不同的规律。现已知多种PAHs可以抑制微藻生长繁殖、刺激氧化应激反应、干扰光合作用,同时微藻也对PAHs存在富集、降解和代谢等方面的作用。
PAHs对微藻的毒性不仅体现在对微藻生长的抑制,其对不同微藻的毒性特异还可能影响微藻间的种群关系,甚至导致自然条件下的优势物种发生改变。毕蓉[17]研究发现,蒽对赤潮异弯藻(Platymonashelgolandica)和青岛大扁藻(Heterosigmaakashiwo)的96h-EC50分别为3.092 mg·L-1和7.025 mg·L-1,在共培养体系中青岛大扁藻的种群生长所受的影响比赤潮异弯藻更显著。在青岛大扁藻和赤潮异弯藻初始接种生物量比分别为1∶4、1∶1以及4∶1时,蒽胁迫条件下青岛大扁藻种群的环境容纳量K值分别达到对照组种群K值的18倍、9倍和4倍,蒽胁迫对赤潮异弯藻种群密度的影响与青岛大扁藻相反。由此表明,这2种微藻的种间竞争关系发生改变,其中赤潮异弯藻的竞争优势可被削弱,而青岛大扁藻则在竞争中占据了极为明显的优势。一般情况下,PAHs的存在对微藻表现出抑制作用,部分条件下表现出毒物兴奋效应,但这种效应与PAHs及微藻的种类密切相关,因而表现出不同的规律。例如,低浓度(0.02 mg·L-1)菲、芘和蒽处理对3种赤潮微藻的生长均表现出有刺激作用,而高浓度(0.04、0.06、0.08、0.10和0.12 mg·L-1)处理则显示出抑制作用[18];Croxton等[19]研究了萘、芘和苯并[α]芘对底栖硅藻短吻菱形藻(Nitzschiabrevirostris)生长的影响,发现了一定浓度的PAHs暴露能够抑制该藻的生长,同时PAHs的暴露可使该藻脂质和细胞膜受损程度增加;蒽对米氏凯伦藻(Kareniamikimotoi)的生长具有持续的抑制效应[20];荧蒽在低浓度时对中肋骨条藻表现出生长刺激作用,而在菲的作用下该藻的生长则始终是受到抑制[21]。
与PAHs对微藻生长影响类似,PAHs对藻细胞抗氧化系统的影响也具有不同规律。Lei等[22]在研究芘对普通小球藻、扁盘栅藻(Scenedesmusplatydisus)、四尾栅藻(Scenedesmusquadricauda)和羊角月牙藻的毒性时发现,藻细胞中谷胱甘肽过氧化物酶(glutathione peroxidase, GPX)、SOD和CAT的活性与对照相比均无显著差别,可见在上述4种淡水微藻中抗氧化系统的改变可能并不是芘毒性作用的主要机制。微藻对芘也有一定的耐受与代谢能力,但不同藻之间差异较大,如扁盘栅藻和四尾栅藻代谢芘效率高于羊角月牙藻,而相比之下普通小球藻则几乎不能代谢芘[23]。相应的,不同微藻受芘胁迫时的细胞响应规律也存在差异。经芘处理后,谷胱甘肽(glutathione, GSH)含量与谷胱甘肽巯基转移酶(glutathione S-transferase, GST)、谷胱甘肽过氧化物酶和谷胱甘肽还原酶(glutathione reductase, GR)3种GSH依赖性酶的活性的变化在不同微藻中有所不同。经1.0 mg·L-1芘处理4 d时,GSH和GST在扁盘栅藻和羊角月牙藻中显著增加(> 30 U),在普通小球藻(< 20 U)中保持不变,表明GSH和GST可能参与芘在藻细胞中的转化过程。由于GR在维持细胞内GSH稳态中起重要作用,因此,随着GSH含量和GST活性的增加GR也应该有所增加。然而,在Lei等[22]的研究中发现芘处理的扁盘栅藻和羊角月牙藻中GSH和GST较对照显著提高,但GR仍与对照在同一水平。据此推断,GSH可能是芘参与藻细胞代谢转化的重要途径之一。Wang等[24]研究羊角月牙藻暴露于多种PAHs(包括菲、芴、荧蒽、芘和苯并[α]芘)时发现藻细胞叶绿素与GSH含量均降低,同时SOD和过氧化物酶(peroxidase, POD)的活性在初期升高。可见,微藻对不同PAHs的氧化应激响应差异较大,现有研究十分有限,关于微藻抗氧化系统对PAHs的响应规律仍需进一步研究。
PAHs对微藻的光合作用系统也有一定的影响,如表现出毒物兴奋效应,即高浓度抑制生长,低浓度促进生长。Pérez等[25]研究球等鞭金藻(Isochrysisgalbana)暴露于萘、菲、芘和荧蒽,发现这4种PAHs均能降低微藻的光化学效率,作用强弱依次为荧蒽≥芘>菲>萘。针对这几种PAHs,还有学者研究发现[26],低浓度暴露下菲对赤潮异弯藻光合速率没有明显的影响,而芘和蒽处理的赤潮异弯藻光合速率则有所提高,但高浓度下上述PAHs对赤潮异弯藻光合作用均表现为显著抑制。
不同微藻对PAHs的生物富集、吸附和转化过程也不同。Lei等[27]研究普通小球藻、四尾栅藻、扁盘栅藻和羊角月牙藻对荧蒽和芘的响应,发现4种微藻均能通过吸附和转化将培养基中的荧蒽和芘去除,但是去除效率各不相同。与去除单一PAHs相比,微藻去除荧蒽和芘混合物的效率更高,表明两种PAHs共存可能刺激了微藻的吸附转化能力。另外还发现,羊角月牙藻去除低分子量PAHs主要通过降解,并且当同时暴露于低剂量的镉、锌、铜和镍混合物时其去除效果可能被增强。进一步研究还发现金属混合物的存在可刺激微藻对高分子量PAHs的吸收,过程中未产生明显的降解,荧蒽和芘的中间体未出现显著变化,对荧蒽和芘的吸收率达到88%~117%[28]。贾汭婵[29]研究新月柱鞘藻(Cylindrothecaclosterium)对沉积物中菲和芘的降解发现,藻细胞叶绿素a含量在一定程度上可以影响其对PAHs的降解,但多酚氧化酶(polyphenol oxidase, PPO)活性的强弱才是影响菲和芘降解的主要因素,此外,新月柱鞘藻的释氧作用对沉积物中菲和芘的降解影响也较大。
当PAHs单一存在时,其对微藻的毒性往往低于重金属,而与重金属共存时联合毒性则是随着暴露时间和剂量表现为加成、协同或拮抗,特别是反映在藻细胞抗氧化系统上(以抗氧化酶活性和抗氧化物质含量表征)[24]。例如,50 mg·L-1表面活性剂长链烷基苯磺酸盐(linear alkylbenzene sulfonates, LAS)与不同浓度蒽(2、4、6、8和10 mg·L-1)联合作用于青岛大扁藻,发现藻细胞增长率比起蒽单独处理时分别降低了25.73%、42.60%、43.33%、60.79%和77.23%[30]。当多种PAHs共存时,对微藻的联合毒性也不是简单的叠加,而表现为协同或拮抗作用。如,十六烷基三甲基氯化铵(cetyltrimethylammonium chloride, CTAC)与荧蒽混合对普通小球藻的联合毒性随着荧蒽浓度增加而变化,由低浓度的协同效应(0~50 μg·L-1)变为高浓度的拮抗作用(50~200 μg·L-1)[31]。总之,PAHs对微藻的毒性作用与PAHs自身的理化性质有关,也受到暴露的微藻藻种的影响,另外,微藻生长状态与所处环境条件也可能会影响PAHs对微藻的毒作用[32]。
3 药物和个人护理用品对微藻的毒性作用与机制(Toxic effects and mechanisms of pharmaceutical and personal care products on microalgae)
药物和个人护理用品(pharmaceutical and personal care products,PPCPs)由抗生素、固醇类激素、药物和清洁剂等物质组成,通过水相传递和食物链进行扩散,在水环境中广泛存在。虽然其半衰期短、浓度低,但由于人类活动连续输入使得PPCPs表现为“持续存在”。在环境中PPCPs痕量存在,其对微藻的毒作用随微藻的不同以及污染物本身的差异而有所不同。目前,对微藻毒性研究较多的PPCPs主要是抗生素与增塑剂类污染物,其中常用抗生素对绿藻的研究最多,对硅藻的研究则相对较少,总结见表2。
分析表2中PPCPs的种类和毒作用浓度的数值大小,发现药品中大环内酯类抗生素对微藻的毒作用最为显著,其次是喹诺酮类、四环素类和酰胺醇类。β-内酰胺类抗生素作用于蓝藻的EC50远低于绿藻和硅藻,数值相差2~7个数量级。此外,低剂量的消炎镇痛药和抑菌剂对微藻的毒作用也十分明显。抗抑郁类药物对微藻的毒性根据微藻种类和物质类型差异有所不同,而表面活性剂对微藻的毒性大小则随着链长度的增加而逐渐增大。杜氏盐藻对抑菌剂三氯生最为敏感(EC50= 3.55 μg·L-1),其次是抗抑郁药物氟西汀;羊角月牙藻是PPCPs毒作用研究最多的藻种之一,发现其对大环内酯类抗生素、抗抑郁药物氟西汀和舍曲林均十分敏感;小球藻对PPCPs的敏感性则弱于其他绿藻;除磺胺地托辛外,一般蓝藻对各类药物均表现出较强的敏感性,更适合作为指示藻种。
痕量的PPCPs可能促进微藻的生长[33],但是由于PPCPs种类复杂,不同的PPCPs及其作用浓度对微藻生长的影响也各有不同。相同浓度的邻苯二甲酸二丁酯(dibutyl phthalate, DBP)作用于不同微藻,发现低剂量DBP(< 1 000 μg·L-1)显著促进球形棕囊藻、红胞藻的生长,对普林藻、东海原甲藻、血红哈卡藻、中肋骨条藻和海洋小球藻也有较强的促进作用,而对三角褐指藻的生长则无明显影响[34]。已有研究发现邻苯二甲酸酯类污染物具有内分泌干扰物的特性,对微藻可能起到了类似生长激素的作用,使得剂量很低时也表现出显著的生长促进作用[35]。Delorenzo和Fleming[36]考察了双氯芬酸、三氯生、卡马西平、辛伐他汀、氯贝西酸和氟西汀共6种PPCPs对杜氏盐藻(Dunaliellatertiolecta)的毒性,发现均影响盐藻细胞的生长,其中三氯生影响最大,经80 mg·L-1处理时密度降低42%。除卡马西平外,三氯生、氟西汀、辛伐他汀、双氯芬酸和氯贝酸的96 h-EC50含量分别为3.55、169.81、22 800、185 690和224 180 μg·L-1。Jarvis等[37]的研究也发现卡马西平并不直接影响初级生产力。而三氯生则在环境浓度下即可对盐藻产生显著的毒性效应。另有关于三氯生与卡马西平对绿球藻的毒作用研究,发现三氯生的毒作用强于卡马西平,其中低浓度(0.391 mmol·L-1)三氯生作用下绿球藻表现出适应能力,细胞内脂肪酸合成的抑制程度、蛋白质构象的改变均明显较高浓度(100 mmol·L-1)时低;而卡马西平则是通过其疏水作用而影响藻细胞磷脂双层,作用于膜上特定蛋白质从而破坏细胞膜,并且藻细胞经长时间暴露可对卡马西平的毒作用产生抗性[38]。

表2 药品及个人护理品(PPCPs)对微藻的毒性作用Table 2 Toxicities of pharmaceuticals and personal care products (PPCPs) on microalgae
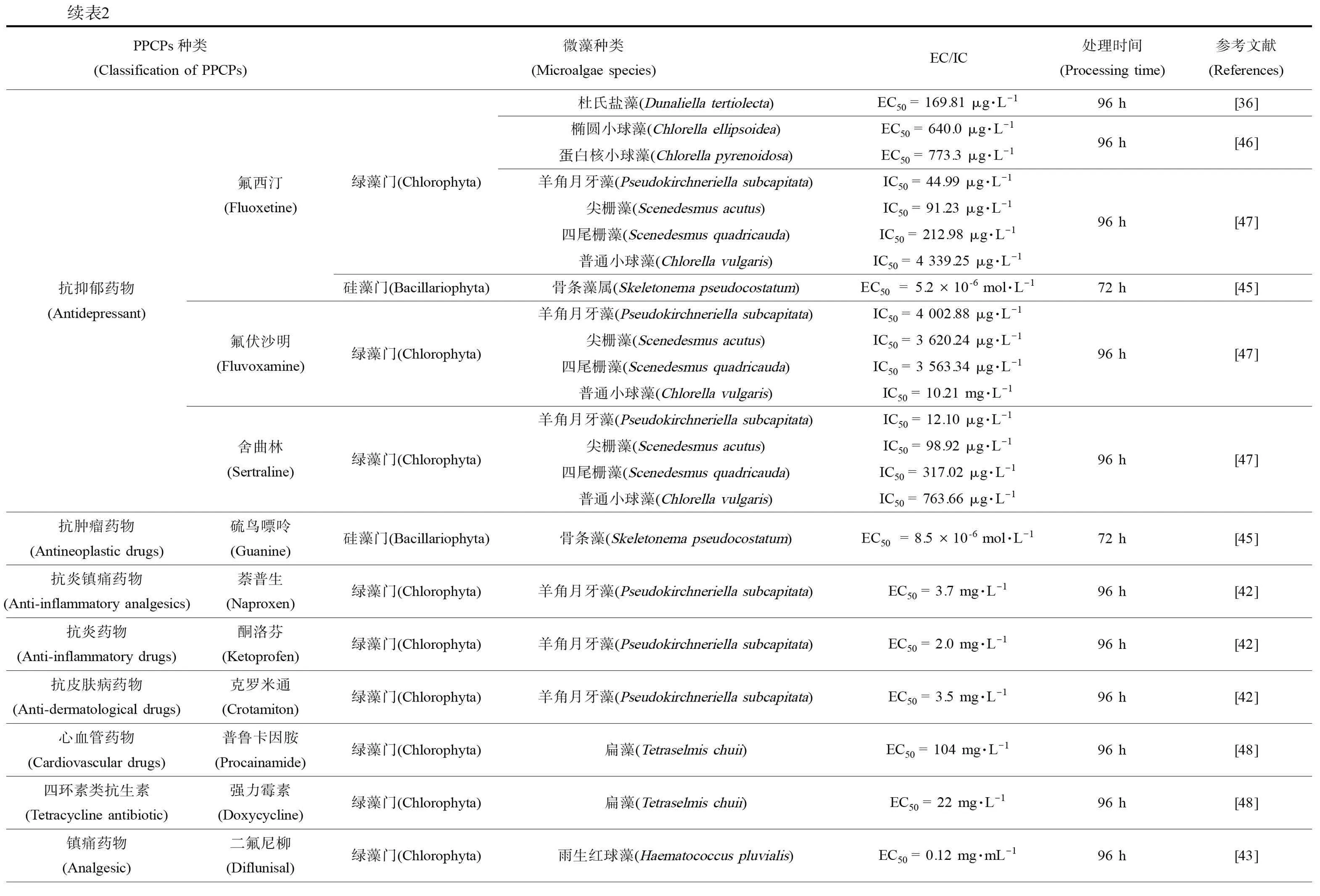
续表2PPCPs种类(Classification of PPCPs)微藻种类(Microalgae species)EC/IC处理时间(Processing time)参考文献(References)抗肿瘤药物(Antineoplastic drugs)硫鸟嘌呤(Guanine)硅藻门(Bacillariophyta)骨条藻(Skeletonema pseudocostatum)EC50=8.5×10-6 mol·L-172 h[45]抗炎镇痛药物(Anti-inflammatory analgesics)萘普生(Naproxen)绿藻门(Chlorophyta)羊角月牙藻(Pseudokirchneriella subcapitata)EC50 = 3.7 mg·L-196 h[42]抗炎药物(Anti-inflammatory drugs)酮洛芬(Ketoprofen)绿藻门(Chlorophyta)羊角月牙藻(Pseudokirchneriella subcapitata)EC50 = 2.0 mg·L-196 h[42]抗皮肤病药物(Anti-dermatological drugs)克罗米通(Crotamiton)绿藻门(Chlorophyta)羊角月牙藻(Pseudokirchneriella subcapitata)EC50 = 3.5 mg·L-196 h[42]心血管药物(Cardiovascular drugs)普鲁卡因胺(Procainamide)绿藻门(Chlorophyta)扁藻(Tetraselmis chuii)EC50 = 104 mg·L-196 h[48]四环素类抗生素(Tetracycline antibiotic)强力霉素(Doxycycline)绿藻门(Chlorophyta)扁藻(Tetraselmis chuii)EC50 = 22 mg·L-196 h[48]镇痛药物(Analgesic)二氟尼柳(Diflunisal)绿藻门(Chlorophyta)雨生红球藻(Haematococcus pluvialis)EC50 = 0.12 mg·mL-196 h[43]喹诺酮类抗生素(Quinolone antibiotic)环丙沙星(Ciprofloxacin)沙氟沙星(Shafloxacin)绿藻门(Chlorophyta)蓝藻门(Cyanophyta)硅藻门(Bacillariophyta)绿藻门(Chlorophyta)普通小球藻(Chlorella vulgaris)EC50 = 0.313 mg·L-1羊角月牙藻(Selenastrum capricornutum)EC50 = 2.97 mg·L-1羊角月牙藻(Pseudokirchneriella subcapitata)EC50 = 11.3 mg·L-1铜绿微囊藻(Microcystis aeruginosa)EC50 = 0.015 mg·L-1角毛藻(Rhodomonas salina)EC50 = 24 mg·L-1羊角月牙藻(Selenastrum capricornutum)EC50 = 16 mg·L-196 h[49]未知(Unknown)[50]72 h[51]96 h[52]氟奎诺酮类抗生素(Fluoroquinolone antibiotic)恩诺沙星(Enrofloxacin)绿藻门(Chlorophyta)羊角月牙藻(Pseudokirchneriella subcapitata)IC50 = 5.18 mg·L-1梭杆纤维藻(Ankistrodesmus fusiformis)IC50 = 10.6 mg·L-196 h[53]喹诺酮类抗生素(Quinolone antibiotic)左氧氟沙星(Levofloxacin)诺氟沙星(Norfloxacin)绿藻门(Chlorophyta)蓝藻门(Cyanophyta)绿藻门(Chlorophyta)羊角月牙藻(Raphidocelis subcapitata NIES-35)EC10 = 1.3 mg·L-1圆柱类鱼腥藻(Anabaena cylindrica NIES-19)EC50 = 0.053 mg·L-1水华鱼腥藻(Anabaena flos-aquae ATCC 29413)EC50 = 0.29 mg·L-1鱼腥藻(Anabaena variabilis NIES-23)EC50 = 0.19 mg·L-1铜绿微囊藻(Microcystis aeruginosa NIES-44)EC50 = 0.062 mg·L-1惠氏微囊藻(Microcystis wesenbergii NIES-107)EC50 = 0.038 mg·L-1念珠藻属(Nostoc sp. PCC 7120)EC50 = 1.7 mg·L-1聚球藻(Synechococcus leopoldensis IAM M-6)EC50 = 0.63 mg·L-1聚球藻(Synechococcus sp.PCC 7002)EC50 = 0.63 mg·L-1羊角月牙藻(Pseudokirchneriella subcapitata)EC50 = 16.6 mg·L-172 h[41]144 h[54]144 h[54]抗生素(Antibiotic)林可霉素(Lincomycin)绿藻门(Chlorophyta)羊角月牙藻(Pseudokirchneriella subcapitata)EC50 = 1 510 μg·L-1硅藻门(Bacillariophyta)梅尼小环藻(Cyclotella meneghiniana)EC50 = 1 630 μg·L-1蓝藻门(Cyanophyta)聚球藻(Synechococcus leopoliensis)EC50 = 195 μg·L-196 h[55]96 h[55]四环素类抗生素(Tetracycline antibiotic)金霉素(Chlortetracycline)蓝藻门(Cyanophyta)绿藻门(Chlorophyta)绿藻门(Chlorophyta)铜绿微囊藻(Microcystis aeruginosa)EC50 = 0.05 mg·L-1羊角月牙藻(Selenastrum capricornutum)EC50 = 3.1 mg·L-1羊角月牙藻(Pseudokirchneriella subcapitata)IC50 = 1.19 mg·L-1梭杆纤维藻(Ankistrodesmus fusiformis)IC50 = 2.23 mg·L-196 h[56]96 h[53]抑菌药物(Antibacterial drug)喹乙醇(Olaquindox)蓝藻门(Cyanophyta)铜绿微囊藻(Microcystis aeruginosa)EC50 = 5.1 mg·L-1绿藻门(Chlorophyta)羊角月牙藻(Selenastrum capricornutum)EC50 = 40 mg·L-196 h[56]大环内酯类抗生素(Macrolide antibiotic)螺旋霉素(Spiramycin)蓝藻门(Cyanophyta)铜绿微囊藻(Microcystis aeruginosa)EC50 = 0.005 mg·L-1绿藻门(Chlorophyta)羊角月牙藻(Selenastrum capricornutum)EC50 = 2.3 mg·L-196 h[56]
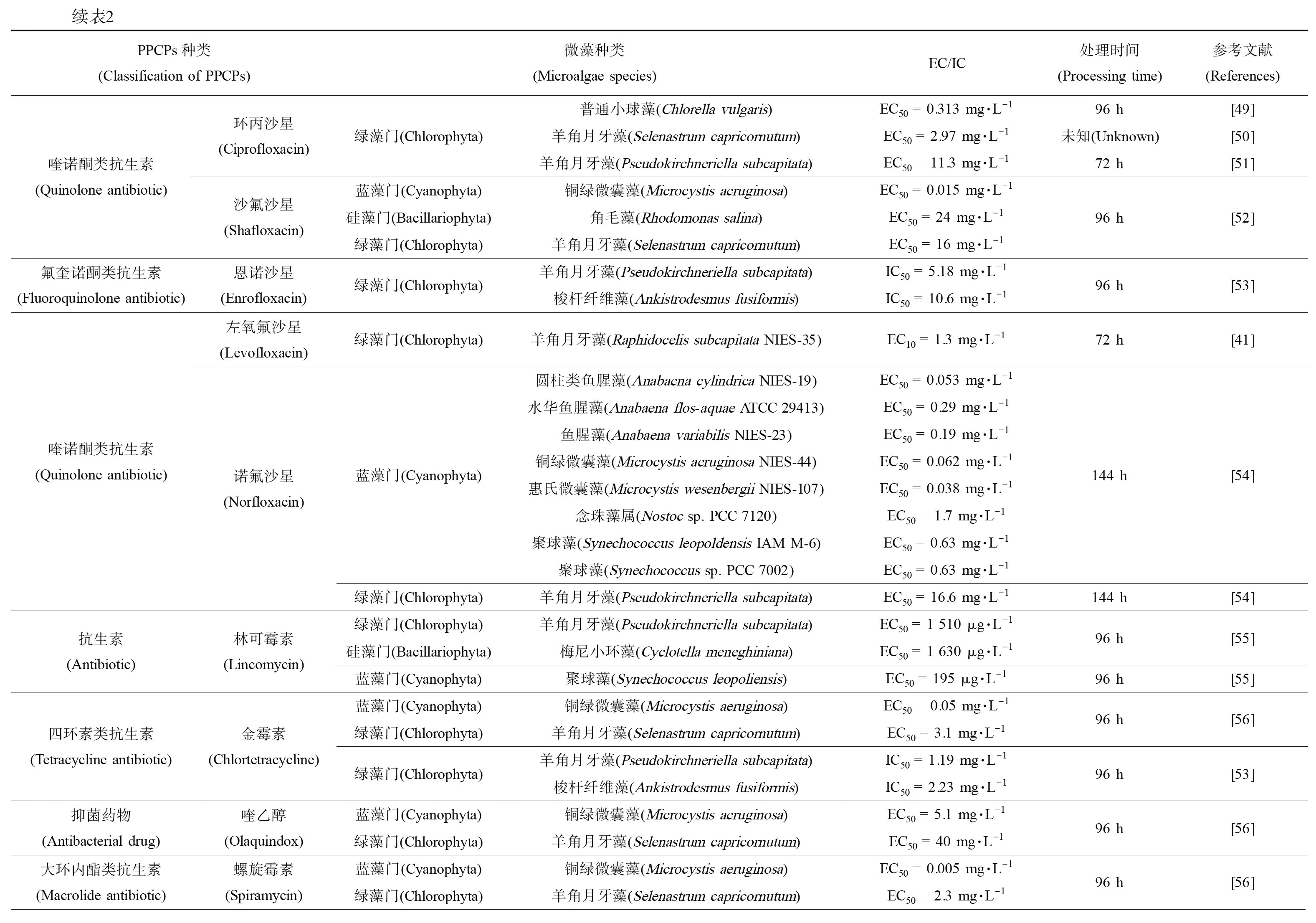
续表2PPCPs种类(Classification of PPCPs)微藻种类(Microalgae species)EC/IC处理时间(Processing time)参考文献(References)氨基糖苷类抗生素(Aminoglycoside antibiotic)链霉素(Streptomycin)蓝藻门(Cyanophyta)绿藻门(Chlorophyta)铜绿微囊藻(Microcystis aeruginosa)羊角月牙藻(Selenastrum capricornutum)羊角月牙藻(Pseudokirchneriella subcapitata)EC50 = 0.007 mg·L-196 h[56]EC50 = 0.034 mg·L-124 h[57]EC50 = 0.133 mg·L-196 h[56]EC50 = 1.5 mg·L-124 h[57]四环素类抗生素(Tetracycline antibiotic)四环素(Tetracycline)蓝藻门(Cyanophyta)铜绿微囊藻(Microcystis aeruginosa)EC50 = 0.09 mg·L-1绿藻门(Chlorophyta)羊角月牙藻(Selenastrum capricornutum)EC50 = 2.2 mg·L-196 h[56]大环内酯类抗生素(Macrolide antibiotic)泰乐菌素(Tylosin)蓝藻门(Cyanophyta)绿藻门(Chlorophyta)铜绿微囊藻(Microcystis aeruginosa)羊角月牙藻(Selenastrum capricornutum)羊角月牙藻(Pseudokirchneriella subcapitata)EC50 = 0.034 mg·L-196 h[56]EC50 = 0.29 mg·L-124 h[57]EC50 = 1.38 mg·L-196 h[56]EC50 =0.0089 mg·L-124 h[57]抗生素(Antibiotic)泰妙菌素(Tylenin)蓝藻门(Cyanophyta)铜绿微囊藻(Microcystis aeruginosa)EC50 = 0.003 mg·L-1绿藻门(Chlorophyta)羊角月牙藻(Selenastrum capricornutum)EC50 = 0.165 mg·L-196 h[56]β-内酰胺类抗生素(β-Lactam antibiotics)苄青霉素(Benzethin)蓝藻门(Cyanophyta)铜绿微囊藻(Microcystis aeruginosa)EC50 = 0.006 mg·L-196 h[56]氨基糖苷类抗生素(Aminoglycoside antibiotic)庆大霉素(Gentamicin)绿藻门(Chlorophyta)羊角月牙藻(Pseudokirchneriella subcapitata)EC50 = 19.2 mg·L-172 h[51]多肽类抗生素(Peptide antibiotic)万古霉素(Vancomycin)绿藻门(Chlorophyta)羊角月牙藻(Pseudokirchneriella subcapitata)EC50 = 724 mg·L-172 h[51]大环内酯类抗生素(Macrolide antibiotic)红霉素(Erythromycin)蓝藻门(Cyanophyta)绿藻门(Chlorophyta)绿藻门(Chlorophyta)圆柱类鱼腥藻(Anabaena cylindrica NIES-19)EC50 = 0.035 mg·L-1水华鱼腥藻(Anabaena flos-aquae ATCC 29413)EC50 = 0.27 mg·L-1鱼腥藻(Anabaena variabilis NIES-23)EC50 = 0.43 mg·L-1铜绿微囊藻(Microcystis aeruginosa NIES-44)EC50 = 0.023 mg·L-1惠氏微囊藻(Microcystis wesenbergii NIES-107)EC50 = 0.023 mg·L-1念珠藻属(Nostoc sp. PCC 7120)EC50 = 0.20 mg·L-1聚球藻(Synechococcus leopoldensis IAM M-6)EC50 = 0.16 mg·L-1聚球藻(Synechococcus sp.PCC 7002)EC50 = 0.23 mg·L-1羊角月牙藻(Pseudokirchneriella subcapitata)EC50 = 0.0366 mg·L-1羊角月牙藻(Pseudokirchneriella subcapitata)IC50 = 170 mg·L-1144 h[54]144 h[54]72 h[44]酰胺醇类抗生素(Amide alcohol antibiotic)甲砜霉素(Thiamphenicol)蓝藻门(Cyanophyta)绿藻门(Chlorophyta)圆柱类鱼腥藻(Anabaena cylindrica NIES-19)EC50 = 1.3 mg·L-1水华鱼腥藻(Anabaena flos-aquae ATCC 29413)EC50 = 13 mg·L-1鱼腥藻(Anabaena variabilis NIES-23)EC50 = 14 mg·L-1铜绿微囊藻(Microcystis aeruginosa NIES-44)EC50 = 0.32 mg·L-1惠氏微囊藻(Microcystis wesenbergii NIES-107)EC50 = 0.43 mg·L-1念珠藻属(Nostoc sp. PCC 7120)EC50 = 3.5 mg·L-1聚球藻(Synechococcus leopoldensis IAM M-6)EC50 = 0.36 mg·L-1聚球藻(Synechococcus sp.PCC 7002)EC50 = 0.67 mg·L-1羊角月牙藻(Pseudokirchneriella subcapitata)EC50 = 8.86 mg·L-1144 h[54]144 h[54]
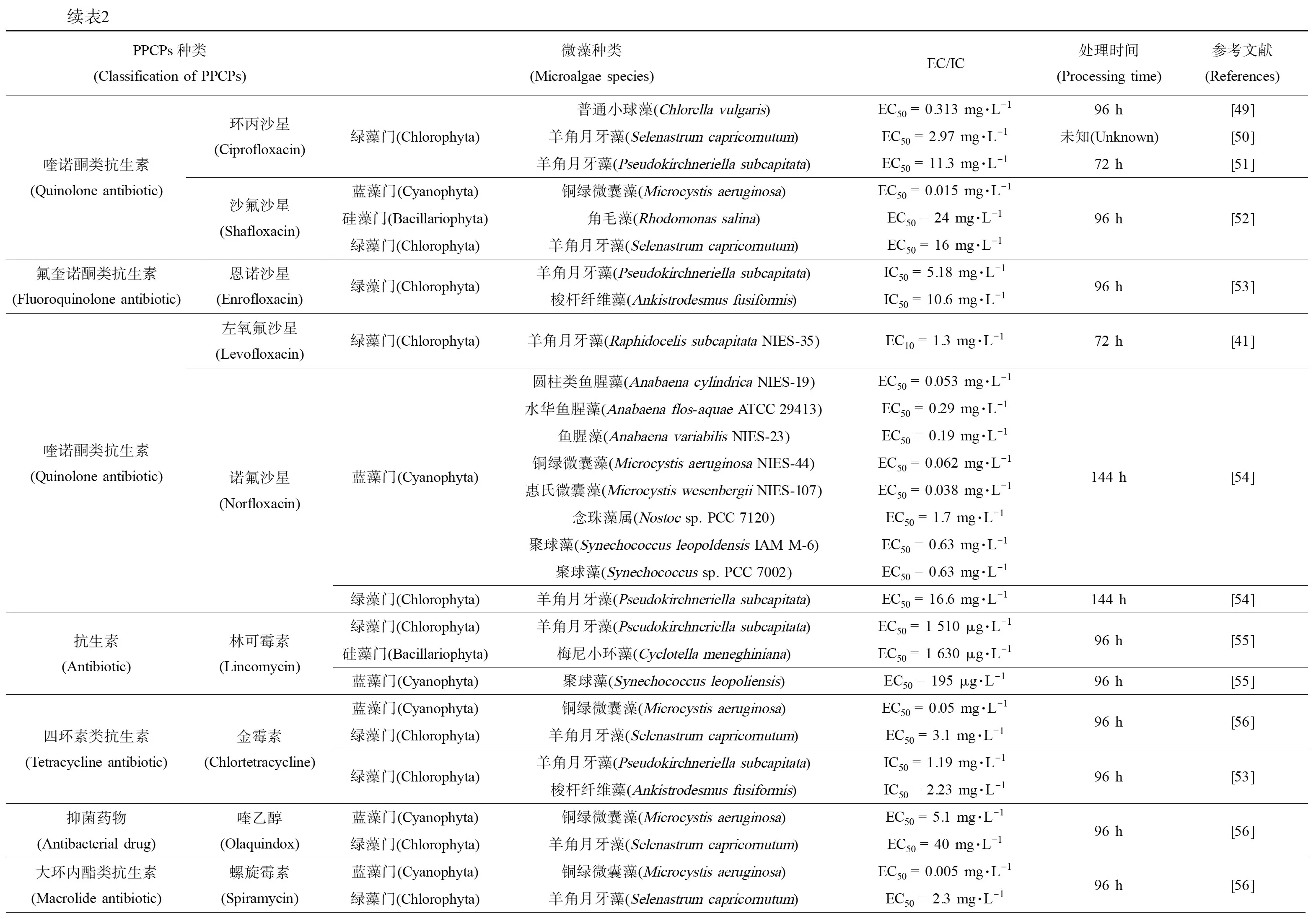
续表2PPCPs种类(Classification of PPCPs)微藻种类(Microalgae species)EC/IC处理时间(Processing time)参考文献(References)四环素类抗生素(Tetracycline antibiotic)土霉素(Terramycin)蓝藻门(Cyanophyta)绿藻门(Chlorophyta)绿藻门(Chlorophyta)蓝藻门(Cyanophyta)硅藻门(Bacillariophyta)蓝藻门(Cyanophyta)绿藻门(Chlorophyta)绿藻门(Chlorophyta)圆柱类鱼腥藻(Anabaena cylindrica NIES-19)EC50 = 0.032 mg·L-1水华鱼腥藻(Anabaena flos-aquae ATCC 29413)EC50 = 0.39 mg·L-1鱼腥藻(Anabaena variabilis NIES-23)EC50 = 0.19 mg·L-1铜绿微囊藻(Microcystis aeruginosa NIES-44)EC50 = 0.062 mg·L-1惠氏微囊藻(Microcystis wesenbergii NIES-107)EC50 = 0.35 mg·L-1念珠藻属(Nostoc sp. PCC 7120)EC50 = 7.0 mg·L-1聚球藻(Synechococcus leopoldensis IAM M-6)EC50 = 1.1 mg·L-1聚球藻(Synechococcus sp.PCC 7002)EC50 = 2.0 mg·L-1羊角月牙藻(Pseudokirchneriella subcapitata)EC50 = 0.342 mg·L-1羊角月牙藻(Selenastrum capricornutum)EC50 = 4.5 mg·L-1铜绿微囊藻(Microcystis aeruginosa)EC50 = 0.207 mg·L-1角毛藻(Rhodomonas salina)EC50 = 1.6 mg·L-1铜绿微囊藻(Microcystis aeruginosa)EC50 = 5.4 mg·L-1羊角月牙藻(Pseudokirchneriella subcapitata)EC50 = 0.6 mg·L-1羊角月牙藻(Pseudokirchneriella subcapitata)IC50 = 0.64 mg·L-1梭杆纤维藻(Ankistrodesmus fusiformis)IC50 = 4.17 mg·L-1144 h[54]144 h[54]96 h[52]24 h[57]96 h[53]磺胺类抗菌药物(Sulfonamide antibiotics)磺胺地托辛(Sulfadipine)蓝藻门(Cyanophyta)蓝藻门(Cyanophyta)绿藻门(Chlorophyta)圆柱类鱼腥藻(Anabaena cylindrica NIES-19)EC50 = 480 mg·L-1水华鱼腥藻(Anabaena flos-aquae ATCC 29413)EC50 > 2 000 mg·L-1鱼腥藻(Anabaena variabilis NIES-23)EC50 = 1 500 mg·L-1铜绿微囊藻(Microcystis aeruginosa NIES-44)EC50 = 500 mg·L-1惠氏微囊藻(Microcystis wesenbergii NIES-107)EC50 = 470 mg·L-1念珠藻属(Nostoc sp. PCC 7120)EC50 > 2 000 mg·L-1聚球藻(Synechococcus leopoldensis IAM M-6)EC50 = 1 100 mg·L-1聚球藻(Synechococcus sp.PCC 7002)EC50 = 760 mg·L-1羊角月牙藻(Pseudokirchneriella subcapitata)EC50 = 2.30 mg·L-1144 h[54]144 h[54]144 h[54]硝基咪唑类抗生素(Nitroimidazole antibiotic)磺胺甲恶唑(Sulfamethoxazole)蓝藻门(Cyanophyta)绿藻门(Chlorophyta)铜绿微囊藻(Microcystis aeruginosa)EC50 = 0.55 mg·L-1羊角月牙藻(Pseudokirchneriella subcapitata)EC50 > 9 mg·L-1羊角月牙藻(Raphidocelis subcapitata NIES-35)EC10 = 0.066 mg·L-124 h[57]24 h[57]72 h[41]咪唑类抗真菌药(Imidazole antifungal)酮康唑(Ketoconazole)绿藻门(Chlorophyta)羊角月牙藻(Pseudokirchneriella subcapitata)IC50 = 3.25 mg·L-172 h[44]硝基咪唑类抗生素(Nitroimidazole antibiotic)甲硝唑 (Metronidazole)绿藻门(Chlorophyta)小球藻(Chlorella sp.)EC50 = 45.1 mg·L-1羊角月牙藻(Selenastrum capricornutum)EC50 = 39.1 mg·L-172 h[58]
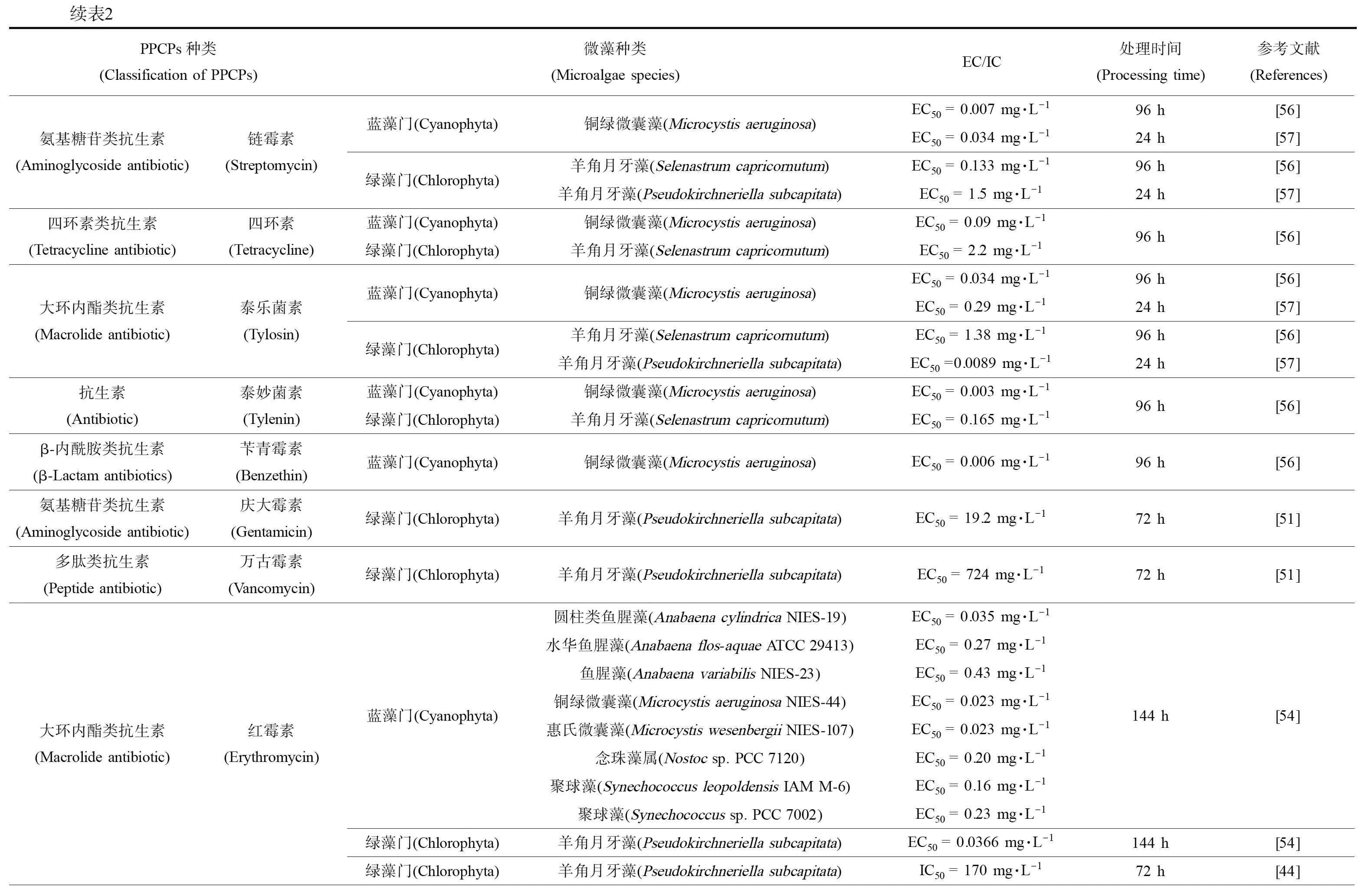
续表2PPCPs种类(Classification of PPCPs)微藻种类(Microalgae species)EC/IC处理时间(Processing time)参考文献(References)抑菌药物(Antibacterial drug)甲氧苄啶(Trimethoprim)蓝藻门(Cyanophyta)绿藻门(Chlorophyta)硅藻门(Bacillariophyta)蓝藻门(Cyanophyta)蓝藻门(Cyanophyta)绿藻门(Chlorophyta)圆柱类鱼腥藻(Anabaena cylindrica NIES-19)EC50 > 200 mg·L-1水华鱼腥藻(Anabaena flos-aquae ATCC 29413)EC50 > 200 mg·L-1鱼腥藻(Anabaena variabilis NIES-23)EC50 = 11 mg·L-1铜绿微囊藻(Microcystis aeruginosa NIES-44)EC50 = 150 mg·L-1惠氏微囊藻(Microcystis wesenbergii NIES-107)EC50 > 200 mg·L-1念珠藻属(Nostoc sp. PCC 7120)EC50 = 53 mg·L-1聚球藻(Synechococcus leopoldensis IAM M-6)EC50 > 200 mg·L-1聚球藻(Synechococcus sp.PCC 7002)EC50 > 200 mg·L-1羊角月牙藻(Pseudokirchneriella subcapitata)EC50 = 80.3 mg·L-1羊角月牙藻(Selenastrum capricornutum)EC50 = 130 mg·L-1角毛藻(Rhodomonas salina)EC50 = 16 mg·L-1铜绿微囊藻(Microcystis aeruginosa)EC50 = 112 mg·L-1铜绿微囊藻(Microcystis aeruginosa)EC50 = 6.9 mg·L-1羊角月牙藻(Pseudokirchneriella subcapitata)EC50 > 9 mg·L-1144 h[54]144 h[54]96 h[52]96 h[52]24 h[57]磺胺类抗菌药物(Sulfonamide antibiotics)磺胺嘧啶(Sulfadiazine)蓝藻门(Cyanophyta)铜绿微囊藻(Microcystis aeruginosa)EC50 = 0.135 mg·L-1硅藻门(Bacillariophyta)角毛藻(Rhodomonas salina)EC50 = 403 mg·L-1绿藻门(Chlorophyta)羊角月牙藻(Selenastrum capricornutum)EC50 = 7.8 mg·L-196 h[52]β-内酰胺类抗生素(β-Lactam antibiotics)阿莫西林(Amoxicillin)蓝藻门(Cyanophyta)铜绿微囊藻(Microcystis aeruginosa)EC50 = 0.0037 mg·L-1硅藻门(Bacillariophyta)角毛藻(Rhodomonas salina)EC50 = 3 108 mg·L-1绿藻门(Chlorophyta)羊角月牙藻(Selenastrum capricornutum)EC50 = 250 mg·L-1绿藻门(Chlorophyta)羊角月牙藻(Pseudokirchneriella subcapitata)EC50 > 2 000 mg·L-196 h[52]72 h[51]β-内酰胺类抗生素(β-Lactam antibiotics)氨苄西林(Ampicillin)蓝藻门(Cyanophyta)绿藻门(Chlorophyta)圆柱类鱼腥藻(Anabaena cylindrica NIES-19)EC50 = 0.14 mg·L-1水华鱼腥藻(Anabaena flos-aquae ATCC 29413)EC50 = 3.3 mg·L-1鱼腥藻(Anabaena variabilis NIES-23)EC50 = 2.2 mg·L-1铜绿微囊藻(Microcystis aeruginosa NIES-44)EC50 = 0.00020 mg·L-1惠氏微囊藻(Microcystis wesenbergii NIES-107)EC50 = 0.013 mg·L-1念珠藻属(Nostoc sp. PCC 7120)EC50 > 200 mg·L-1聚球藻(Synechococcus leopoldensis IAM M-6)EC50 = 0.083 mg·L-1聚球藻(Synechococcus sp.PCC 7002)EC50= 0.0069 mg·L-1羊角月牙藻(Pseudokirchneriella subcapitata)EC50 > 1 000 mg·L-1羊角月牙藻(Pseudokirchneriella subcapitata)EC50 > 2 000 mg·L-1144 h[54]144 h[54]72 h[51]抗生素(Antibiotic)氟甲喹(Fluoroquine)蓝藻门(Cyanophyta)铜绿微囊藻(Microcystis aeruginosa)EC50 = 0.159 mg·L-1硅藻门(Bacillariophyta)角毛藻(Rhodomonas salina)EC50 = 18 mg·L-1绿藻门(Chlorophyta)羊角月牙藻(Selenastrum capricornutum)EC50 = 5.0 mg·L-1蓝藻门(Cyanophyta)铜绿微囊藻(Microcystis aeruginosa)EC50 > 8.8 mg·L-1绿藻门(Chlorophyta)羊角月牙藻(Pseudokirchneriella subcapitata)EC50 = 0~16 mg·L-196 h[52]24 h[57]喹啉酮类杀菌剂(Quinolinone fungicide)恶喹酸(Oxolinic acid)蓝藻门(Cyanophyta)铜绿微囊藻(Microcystis aeruginosa)EC50 = 0.180 mg·L-1硅藻门(Bacillariophyta)角毛藻(Rhodomonas salina)EC50 = 10 mg·L-1绿藻门(Chlorophyta)羊角月牙藻(Selenastrum capricornutum)EC50 = 16 mg·L-196 h[52]β-内酰胺类抗生素(β-Lactam antibiotics)头孢菌素(Cephalosporins)绿藻门(Chlorophyta)羊角月牙藻(Pseudokirchneriella subcapitata)EC50 > 600 mg·L-172 h[51]

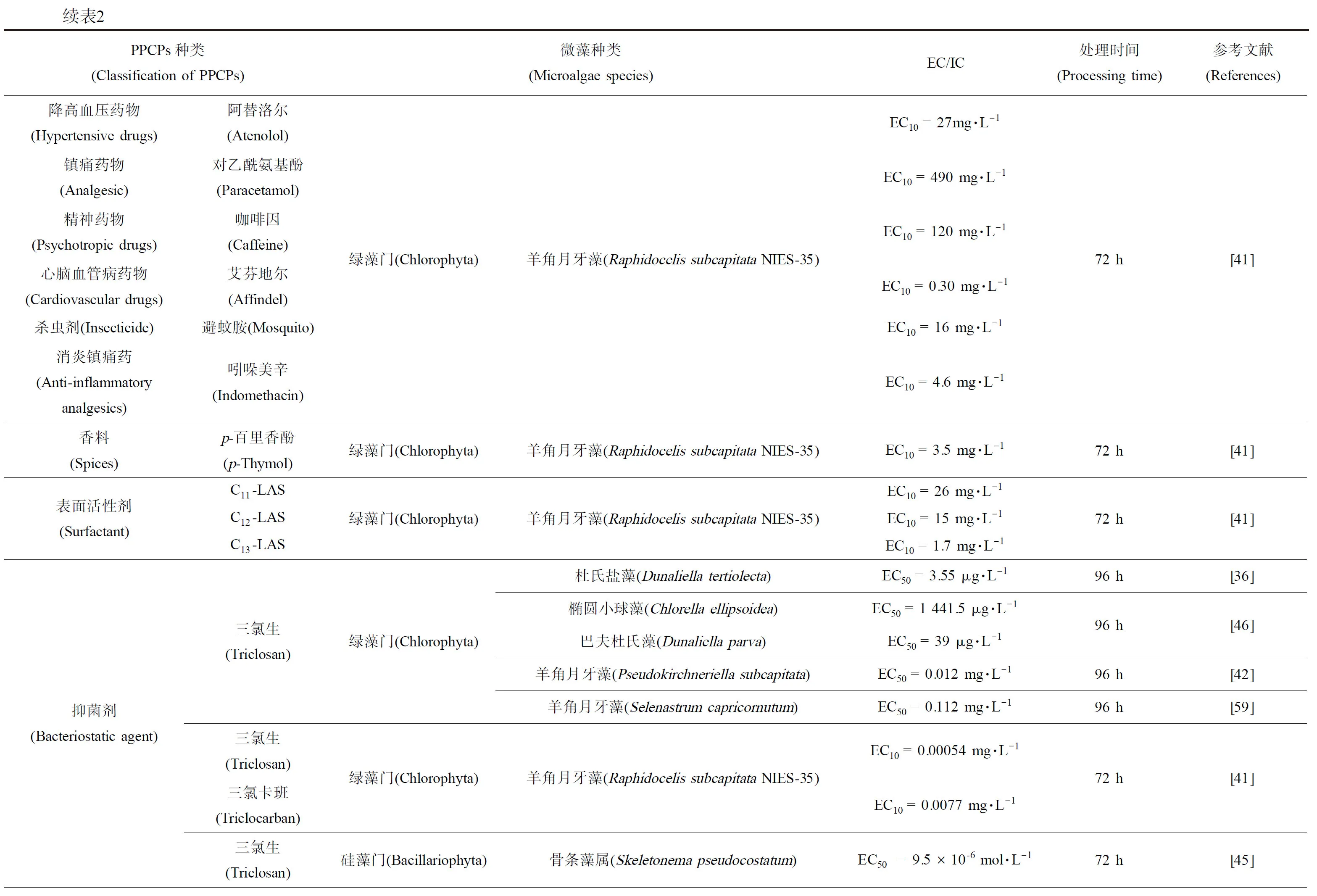
续表2PPCPs种类(Classification of PPCPs)微藻种类(Microalgae species)EC/IC处理时间(Processing time)参考文献(References)降高血压药物(Hypertensive drugs)阿替洛尔(Atenolol)镇痛药物(Analgesic)对乙酰氨基酚(Paracetamol)精神药物(Psychotropic drugs)咖啡因(Caffeine)心脑血管病药物(Cardiovascular drugs)艾芬地尔(Affindel)杀虫剂(Insecticide)避蚊胺(Mosquito)消炎镇痛药(Anti-inflammatory analgesics)吲哚美辛(Indomethacin)绿藻门(Chlorophyta)羊角月牙藻(Raphidocelis subcapitata NIES-35)EC10 = 27mg·L-1EC10 = 490 mg·L-1EC10 = 120 mg·L-1EC10 = 0.30 mg·L-1EC10 = 16 mg·L-1EC10 = 4.6 mg·L-172 h[41]香料(Spices)p-百里香酚(p-Thymol)绿藻门(Chlorophyta)羊角月牙藻(Raphidocelis subcapitata NIES-35)EC10 = 3.5 mg·L-172 h[41]表面活性剂(Surfactant)C11-LASC12-LASC13-LAS绿藻门(Chlorophyta)羊角月牙藻(Raphidocelis subcapitata NIES-35)EC10 = 26 mg·L-1EC10 = 15 mg·L-1EC10 = 1.7 mg·L-172 h[41]抑菌剂(Bacteriostatic agent)三氯生(Triclosan)三氯生(Triclosan)三氯卡班(Triclocarban)三氯生(Triclosan)绿藻门(Chlorophyta)绿藻门(Chlorophyta)硅藻门(Bacillariophyta)杜氏盐藻(Dunaliella tertiolecta)椭圆小球藻(Chlorella ellipsoidea)巴夫杜氏藻(Dunaliella parva)羊角月牙藻(Pseudokirchneriella subcapitata)羊角月牙藻(Selenastrum capricornutum)羊角月牙藻(Raphidocelis subcapitata NIES-35)骨条藻属(Skeletonema pseudocostatum)EC50 = 3.55 μg·L-1EC50 = 1 441.5 μg·L-1EC50 = 39 μg·L-1EC50 = 0.012 mg·L-1EC50 = 0.112 mg·L-1EC10= 0.00054 mg·L-1EC10 = 0.0077 mg·L-1EC50 = 9.5×10-6 mol·L-196 h[36]96 h[46]96 h[42]96 h[59]72 h[41]72 h[45]其他(Others)2-苯氧基乙醇(2-Phenoxyethanol)间苯二酚(Resorcinol)二苯甲酮(Benzophenone)西曲溴铵(Cedrammonium bromide)绿藻门(Chlorophyta)羊角月牙藻(Raphidocelis subcapitata NIES-35)硅藻门(Bacillariophyta)骨条藻属(Skeletonema pseudocostatum)EC10 > 130 mg·L-1EC10 = 72 mg·L-1EC50 =1.1×10-6 mol·L-1EC50= 4.5×10-6 mol·L-172 h[41]72 h[45]


注:*羊角月牙藻的拉丁名为Raphidocelissubcapitata,以前也称为Selenastrumcapricornutum或Pseudokirchneriellasubcapitata。
Note: *Raphidocelissubcapitatawas formerly known asSelenastrumcapricornutumorPseudokirchneriellasubcapitata.
PPCPs作用于藻细胞诱发氧化应激反应可能是其毒害微藻的重要机制之一。如卡马西平几乎可以完全抑制斜生栅藻和小球藻叶绿素a的合成,同时微藻细胞内SOD和CAT活性均出现活性提高的变化[60]。四环素也被发现可显著抑制微藻生长与生理活动,抑制光化学过程并刺激细胞抗氧化系统[61];红霉素、环丙沙星和磺胺甲恶唑均对羊角月牙藻的抗氧化系统产生破坏作用,主要表现在对抗坏血酸(ascorbic acid, AsA)和GSH生物合成、抗坏血酸-谷胱甘肽循环、叶黄素循环和抗氧化酶(如SOD、CAT和GPX)活性等方面的削弱或促进[62]。抗生素对蓝藻的毒作用机制主要是通过影响蛋白质合成(如氯霉素)和DNA复制(如喹诺酮)起作用,但对绿藻的毒害则主要归因于抑制光合作用[56,63]。由于目前研究仍不充分,同时也有一些技术手段方面的限制,使得PPCPs对微藻致毒的精准细胞分子机制仍不十分明确。
微藻暴露于PPCPs时细胞可能出现损伤变化,但是同样微藻反作用于PPCPs对其表现出一定的去除作用,包括生物吸附、生物累积和细胞内外的生物降解[64]。因此微藻可影响PPCPs的迁移转化及其在食物链中的毒性[65]。如海洋舟形硅藻(Naviculaincerta)对壬基酚表现出一定的生物降解和较强的生物积累作用,因此壬基酚有可能经微藻富集向上层食物链转移最终对高等生物及人类造成威胁[66];而有研究报道2种淡水绿藻斜生栅藻和蛋白核小球藻(Chlorellapyrenoidosa)对黄体酮和炔诺孕酮表现出较强的降解转化作用,生物吸附是次要作用,生物转化才是主要机制[66]。微藻对PPCPs的生物累积可能与后者的致毒机制有关[67];微藻吸附PPCPs可能与细胞表面的官能团结构有关,且与环境因素(如pH、碳含量等)有关。微藻也可能通过代谢作用和胞外酶直接作用降解PPCPs[68]。然而同一微藻对不同浓度的PPCPs以及不同微藻对相同PPCPs均具有不同程度的生物累积与生物降解特性[69]。如,蛋白核小球藻吸附三氯生为主要去除机制,而链带藻(Desmodesmussp.)和斜生栅藻则主要通过生物转化来去除三氯生[70]。目前关于微藻吸附转化PPCPs的研究仍然有限,且去除机制随微藻和PPCPs种类而异。
多种PPCPs共存时表现为联合作用,如低剂量时的协同作用,可显著增加对水生生物的不利影响。Delorenzo和Fleming等[36]研究2种混合物——“辛伐他汀+氯贝特酸”和“氟西汀+三氯生”的组合效应时发现2种混合物均对杜氏盐藻均表现为毒性相加作用。然而PPCPs种类复杂,其联合效应既与混合比例有关又与具体剂量有关,基因表达差异等也决定了毒性作用机制的差异。如,螺旋霉素与阿莫西林混合对铜绿微囊藻呈现复杂的毒性效应,即随着混合物中螺旋霉素比例的增加,毒性效应从拮抗转为协同,同时psbA、psaB与rbcL表达水平的变化导致叶绿素a含量的差异,mcyB表达的差异也在基因水平上调控了微囊藻毒素的产生量[71]。
4 纳米材料对微藻的毒性作用与机制(Toxic effects and mechanisms of nanomaterials on microalgae)
纳米氧化物、碳纳米材料以及纳米金属等新兴合成材料应用范围广,近年来越来越多地涌入环境当中,由于其结构微小,能轻易进入生命体,高环境暴露风险使得其可能对水生生态系统构成巨大潜在的威胁[72]。纳米材料通常粒径小于100 nm,主要包括碳基纳米材料(如石墨烯、氧化石墨烯、单壁碳纳米管和多壁碳纳米管等)、无机纳米材料(如纳米金属、纳米金属氧化物和量子点等)。纳米材料最显著的特征是其粒径大小,这是它们的理化性质与生物活性的重要决定因素,目前已经发现多种纳米材料可能引起有害生物学效应[73-74]。
早在2003年,就有学者在《Science》期刊上发表了关于纳米材料毒性效应的文章。随后2006年,Nel等[75]在《Science》上就纳米材料的毒性与机理发表了更为深入的研究成果。纳米材料对环境与人体健康的影响开始备受关注。纳米材料作用于微藻的研究是近几年才开始的。2013年Ahmad等[76]发现纳米CoFe2O4对小球藻的生长抑制率高达32.30%(50 μmol·L-1)和58.75%(100 μmol·L-1),表明纳米CoFe2O4低浓度即可显著抑制小球藻的繁殖。2016年Chae和An[77]研究了银纳米线对莱茵衣藻的毒作用,发现20 μm长的纳米线毒性远大于10 μm。银纳米粒子的大小对其产生溶解Ag+的量有很大影响,而Ag+的存在可能直接对微藻产生毒性影响[78]。尺寸较大的纳米粒子无法进入细胞内,而较小的则可能引起复杂的细胞毒性效应。总的来说,纳米颗粒可引起藻细胞生长与光合作用抑制及脂质过氧化,且毒性程度取决于纳米材料的性质、浓度和粒径。
纳米粒子损伤微藻主要表现在降低叶绿素含量,使细胞生成ROS引发脂质过氧化等自由基损伤反应。如,纳米CoFe2O4能引起小球藻的剂量依赖性氧化应激。随着纳米CoFe2O4浓度的增加,氧化应激响应的蛋白质含量增加,酸性磷酸酶(acid phosphatase, AP)活性增大。低浓度与高浓度纳米CoFe2O4经ROS作用于微藻可能产生2种不同的毒作用模式,较低浓度下小球藻具有较高的ROS清除活性,而较高浓度下CoFe2O4会麻痹抗氧化系统使ROS清除能力丧失[76]。2012年Oukarroum等[79]发现,纳米银可降低小球藻和杜氏盐藻的叶绿素含量,促使细胞产生过量ROS;纳米银粒子可直接作用于小球藻细胞表面,并结合成大的聚集体[79-80];而纳米塑料珠则可通过电荷作用吸附于微藻表面[81];多壁碳纳米管暴露浓度大于1 mg·L-1时可显著影响杜氏盐藻的生长,随着浓度增加抑制作用增强,ROS水平升高,其与细胞表面的直接接触可能与PS Ⅱ功能损伤有关[82];纳米TiO2亦可抑制微藻的生长与光合作用,可诱导可溶性蛋白质的合成,使细胞器降解,减少叶绿体的数量,甚至出现质壁分离,过程中类胡萝卜素和叶绿素b含量出现增加[83]。同时,诸如石墨烯等纳米材料还能通过吸附常量营养素,导致培养基营养物质耗竭,对微藻产生间接毒作用[84]。
另外,遮蔽效应和损伤类囊体膜可能是纳米材料作用于微藻光合作用系统的主要机制。纳米CoFe2O4附着于小球藻的细胞壁阻碍其对光的利用,并且聚集于藻细胞内使光合作用类囊体膜严重受损,同时降低叶绿素a含量进而抑制光合作用[76]。此外,纳米粒子还可与藻细胞表面的蛋白质发生反应,经反应还原金属离子并重新释放,使得藻细胞出现结构溶解、细胞膜破裂与类囊体紊乱等现象[85-86]。
纳米材料对微藻的基因亦表现出毒作用,但作用机制差别较大,如可能激发氧化应激导致DNA损伤,或破坏膜结构进入核内直接损伤DNA分子,或达到特定浓度和剂量才对DNA有所损伤。针对TiO2对衣藻造成的氧化胁迫,有研究通过检测基因表达量发现,TiO2胁迫作用已在基因水平出现了明显响应,SOD1、GPX、CAT和PTOX2基因的表达水平出现异常变化,呈现先激增后下降的趋势[87]。Ahmad等[76]在对纳米CoFe2O4作用于小球藻的研究中也发现,随着纳米CoFe2O4浓度的增加,诱变型谷胱甘肽S-转移酶(mutagenic glutathione S-transferase, Mu-GST)活性持续增加,表现出潜在的遗传毒性。该研究提示了一些纳米材料对微藻的毒作用具有级联效应,即随着ROS的产生引发氧化应激进而导致DNA损伤并表现为生长抑制。而Schiavo等[88]研究纳米材料对杜氏盐藻的损伤作用发现,TiO2破坏细胞壁后首先作用于DNA。纳米ZnO与TiO2不同,前者通过在杜氏盐藻细胞壁附近的连续离子释放产生毒作用,过程可能为首先干扰细胞分裂,进而导致生长抑制,且对DNA的损伤随着ZnO浓度增大而增强。总之,纳米材料对微藻的毒作用机制主要包括细胞膜完整性破坏、蛋白质氧化与变性、氧化胁迫、基因毒性和纳米粒子中金属离子的释放等[89]。
5 微塑料对微藻的毒性作用与机制(Toxic effects and mechanisms of microplastics on microalgae)
微塑料(microplastics, MPs)(< 5 mm)在水生生态环境中广泛存在,尺寸小至纳米级别,介于1~100 nm之间的塑料称为纳米级微塑料。与纳米材料类似,纳米级微塑料体积很小,能够轻易地穿过细胞膜进入藻细胞内部,或在藻细胞表面聚集从而引发遮蔽效应,因此,纳米级微塑料对微藻的毒性影响不容小觑。微塑料作为持久性有机污染物的一种,在环境中能够稳定存在,并且逐渐由大粒径向小粒径转变。大量证据显示,微塑料可能成为一个“长期”而“持久”的污染问题。近年来微塑料的污染情况逐渐加重,有研究估计到2025年海洋中塑料的积累将增加一个数量级[90]。
研究已发现纳米微塑料和微藻之间存在吸附作用,吸附取决于微塑料的理化性质和微藻的形态与生理生化特性,这种吸附会阻碍微藻的光合作用并促进ROS的产生[81]。吸附在微藻细胞表面的微塑料可能在表面包裹甚至存在于功能区,从而限制细胞与环境之间的能量与物质的交换或转移,并阻碍营养物质、光、CO2和O2从培养基进入藻细胞内。有害的藻代谢产物也有可能被锁定在细胞内从而扰乱藻细胞生长[91]。微藻培养物中微塑料的分布取决于微藻的种类和生理状态[92]。物理损伤和氧化应激可能使微藻在微塑料暴露过程中产生类黄酮,并且损伤类囊体和细胞膜[93]。
微塑料对微藻的毒性与其粒径大小有关。如小粒径(0.1 μm)的聚苯乙烯可抑制小球藻的光合作用,其强度大于大粒径条件下(1.0 μm)。一般来说,微塑料粒径越小对微藻的毒作用越显著[93]。Sjollema等[94]发现小粒径聚苯乙烯(0.05 μm)可显著抑制杜氏盐藻的生长,但当粒径增加至6 μm时却无明显影响。另外,Zhang等[91]发现聚氯乙烯微塑料(mPVC)(平均粒径1 μm)显著抑制微藻的生长,而聚氯乙烯大块塑料碎片(bPVC)(平均粒径1 mm)在考察的浓度范围内对微藻生长并无影响。
微塑料可干扰微藻细胞的光合作用。如,纳米塑料对微藻生长和叶绿素a的含量有抑制作用,随浓度增加抑制作用增大[95]。Mao等[93]研究小球藻暴露于不同粒径的聚苯乙烯时藻细胞光合作用参数的变化发现,初期高浓度聚苯乙烯对小球藻的光合作用有抑制作用,且小粒径(0.1 μm)的抑制作用强于大粒径(1.0 μm)。随着聚苯乙烯浓度的增加,对光合参数的影响也加剧。Fv/Fm在100 mg·L-1聚苯乙烯(0.1 μm)处理下的最大抑制比分别为10 mg·L-1和50 mg·L-1浓度下的1.4倍和1.3倍,而随着暴露时间延长,0.1 μm聚苯乙烯(100 mg·L-1)30 d后Fv/Fm、RC/ABS和rETRmax相比对照分别升高了5.1%、7.2%和21.8%,Fo/Fv降低了14.6%,而暴露于1.0 μm聚苯乙烯(100 mg·L-1)时前三个参数分别升高了5.1%、6.5%和12.5%,Fo/Fv降低了14.1%。光合参数的变化规律与生长规律基本一致,可见,微塑料可以初期抑制而后期促进小球藻的生长,这些结果为理解微塑料的水生态风险提供了数据支持。
微塑料作用于微藻还可以引起基因水平的改变。Lagarde等[96]研究聚丙烯(PP)和高密度聚乙烯(HDPE)微塑料对莱茵衣藻的基因表达的影响发现, PP和HDPE(两者粒径均超过400 μm)在60 d内不影响莱茵衣藻的生长,但参与糖生物合成的微藻相关基因却出现了显著的过表达,HDPE的影响尤为突出。关于基因水平影响的研究仍十分有限,关于微藻在微塑料胁迫时的基因表达差异与作用机制的研究今后有待加强。
微塑料也可与其他多种污染物共存发生联合毒性作用。Prata等[48]研究发现在红色荧光聚乙烯微球(1~5 μm)的存在时,普鲁卡因胺和强力霉素在低mg·L-1范围内对海洋朱氏四爿藻(Tetraselmischuii)均表现出毒作用,并且与普鲁卡因胺单独处理相比,微塑料-普鲁卡因胺混合物作用下微藻平均生长速率及叶绿素含量显著降低,同样微塑料-强力霉素混合处理亦对该藻表现出明显的生长抑制,可见微塑料存在下混合毒性比药物单独存在时对微藻的毒性更强。而Davarpanah和Guilhermino[97]研究铜对朱氏四爿藻的毒作用时,发现1~5 μm红色荧光聚乙烯微球在3.68、7.36、14.72、29.44和58.88 mg·L-1浓度下与铜共存并不对其毒作用产生干扰。内分泌类干扰物双酚A(BPA)常用于塑料制品的生产过程,目前在许多微塑料污染物中也发现有BPA的存在。对于微藻转化BPA,Nakajima等[98]研究发现,环境中的淡水绿藻可以将BPA代谢为BPA糖苷,而后者可以积累在藻细胞内,也可在绿藻作用下部分转化为其他糖苷。
现有的研究认为,微塑料对微藻无明显的毒性累积效应。Zhang等[91]研究mPVC对微藻的毒性效应发现,微塑料不会在短时间内向微藻释放有毒物质,其与大部分纳米材料不同对微藻没有毒性累积效应,对光合作用的损害作用可随着暴露时间的延长而减缓。而微藻的生物适应机制(如细胞壁的增厚与微藻之间的均相团聚(homo-aggregation)以及微藻微塑料之间的异相团聚(hetero-aggregation)可能是微塑料对藻类没有毒性累积效应的潜在原因[93]。
6 稀土元素对微藻的毒性作用与机制(Toxic effects and mechanisms of rare earth elements on microalgae)
稀土元素(rare earth elements, REEs)是周期表中ⅢB族钇和镧系元素的总称,是一类容易被忽视的新兴污染物。最近随着REEs在医学、农业、移动通信、能源和弹药等方面使用量的增加,越来越多的REEs进入水生态环境,对人体和生态环境构成一定威胁。
目前,研究普遍认为不同的稀土元素对微藻的毒性作用相似,但之间仍存在一定差异[99]。Tai等[100]研究发现镧系元素对单细胞微藻的毒性作用水平相当,通过毒性大小对元素之间难以区分。而Gonzalez等[101]的研究却发现,随着原子序数的增加,镧系元素对微藻的毒性作用按照镥(Lu)>钆(Gd)>铈(Ce)依次减小。一般来说,低剂量的REEs可促进微藻生长,而高剂量REEs则显著抑制微藻的生长,表现为“Hormesis”即毒物兴奋效应,如,钇(Y)作用于微藻,在叶绿素形成过程中钇是某些酶的活化剂,同时Y可促进氮和磷的吸收,因此Y对微藻叶绿素a和可溶性蛋白含量的影响具有毒物兴奋效应特征[102];另有报道指出,0.1~2.0 mg·L-1的钕(Nd Ⅲ)能促进铜绿微囊藻的生长,而高浓度Nd(Ⅲ)则显著抑制微囊藻的生长[103];较低浓度的镧(La)和Ce则对微囊藻的生长具有促进作用,在高浓度时则表现抑制作用,但抑制程度有差异[104]。低剂量La、Gd和Y混合作用于牟氏角毛藻和球等鞭金藻时,混合与单一REEs在低浓度时均可促进藻体生长,但最佳促藻浓度不同[105-106]。对藻细胞膜结构的影响方面,REEs可影响细胞中的中性脂质组成,多不饱和脂肪酸降低,饱和脂肪酸增加[99]。干扰Ca(Ⅱ)的代谢及破坏细胞膜也是REEs对微藻的毒作用机制之一[107-108]。
REEs诱导微藻细胞发生氧化应激反应是其致毒作用的重要机制之一。如,低浓度钇可使藻细胞中SOD活性提高,减少脂质过氧化产物MDA含量,而高浓度钇则降低细胞SOD活性导致MDA含量迅速增加[102];低浓度Nd(Ⅲ)胁迫下,铜绿微囊藻细胞内叶绿素a与可溶性蛋白含量及CAT活性均增加,而高浓度处理组中细胞膜脂过氧化严重,MDA含量激增,CAT酶活性降低,藻细胞自身防御系统遭到破坏,氧化还原状态失衡,微囊藻生长受到抑制[107]。
REEs作用于微藻光合作用系统,可通过影响光合色素发挥作用[99,109],从而导致藻细胞组成的C/P、N/P和C/N比率发生变化[110]。REEs影响藻细胞光合色素含量的潜在机制可能是其促进了藻体对N和P的吸收,诱发了叶绿素前体物大量合成,同时REEs还可能是叶绿素形成过程中某些酶的活化剂,在叶绿素形成过程中起到了间接作用[102,107,111]。王学等[112]研究认为叶绿素a含量的变化主要是由于REEs影响了原叶绿素酸酯还原酶的活性和氨基-γ-酮戊酸的合成。一定浓度的REEs可增加藻细胞中C/P、N/P和C/N比率,该现象可能与低剂量REEs促进了微藻同化二氧化碳与氮的吸收有一定关系。Rubisco(ribulose-1,5-bisphosphate carboxylase/oxygenase)被称为双功能酶,表现出羧化酶和氧化酶活性,对光合作用有重要影响。刘超[113]研究发现一定浓度的La(Ⅲ)、Ce(Ⅲ)和Nd(Ⅲ)可诱导植物的Rubisco-Rubisco活化酶超复合体产生,从而大大加强Rubisco的羧化活性,提高光合碳同化能力;Hong[114]发现低剂量La(Ⅲ)和Nd(Ⅲ)可诱导Rubisco与其活化酶形成中间复合物。同时,杨革和孔庆娥[115]研究隐甲藻发现,La(Ⅲ)和Nd(Ⅲ)可促进其固氮酶的活性。此外,随着藻细胞生长至稳定期增长速度的减缓,经不同剂量REEs处理的藻细胞中P含量的变化不显著[110]。
反过来,微藻也反作用于稀土元素,表现出一定的吸收和富集的能力。Birungi等[116]研究微藻细胞对La的吸附和解吸,发现链带藻(Desmodesmusmultivariabilis)吸附La的效率最高,其最大吸附容量为100 mg·g-1。在初始浓度为100 mg·L-1时,链带藻对La的解吸效率可达到初始浓度的90.92%,若用于富集稀土元素,该藻是优选生物之一。
7 小结(Summary)
环境中各种新兴污染物不断出现,研究人员正积极努力开展针对新兴污染物的风险评价和控制方面的工作。但是无论在科学研究层面,还是在风险控制与管理层面上,做好新兴污染物的环境暴露、作用影响与毒性分析都是危害评估和生态风险评价的基础。微藻是地球上生长最快的自养生物,其光合作用为地球生产了约1/2的氧气[117],同时作为地球上最重要的初级生产者之一,将大量的二氧化碳固定用于生产各种有机碳化合物,肩负着为其他生物的生存与发展提供物质与能量基础的重要使命,因此,研究新兴污染物对微藻的毒性作用与机制十分必要,不仅对新兴污染物的生态风险研究有重要意义,同时对开发基于微藻的新兴污染物毒性检测技术有重要理论参考价值。
目前,新兴污染物对微藻的毒性影响具体表现在影响微藻的种间关系、细胞生长与结构、胞内氧化还原状态、干扰细胞内抗氧化系统、光合作用过程、基因表达及微藻对污染物的吸收与降解转化等方面。本文介绍了多种新兴污染物,其中PFCs对微藻的毒作用与机制仍不深入,主要是氧化应激反应方面有一些报道,对微藻种群和基因层面的影响有待深入探究。PFCs长期持久地存在于水环境中,其与其他多种污染物的联合作用可能具有持续深远的危害,应当予以重视。PAHs对微藻的毒作用与机制研究较少,目前主要集中研究了微藻如何去除PAHs及其机制,因此,今后应当加强其对微藻种间关系、微藻抗氧化系统与基因表达等方面的研究,特别关注新型多环芳烃类污染物。对于PPCPs由于其种类繁多,目前针对微藻的毒作用研究主要集中在抗生素上,针对其他类型PPCPs的研究有待加强。另外,PPCPs在水环境中长期痕量存在,需关注低浓度PPCPs的长期污染对微藻的毒性效应乃至对水生生态系统的影响。现已发现纳米材料及微塑料对微藻的毒作用与其浓度与粒径有关,而这2类污染物对微藻种间关系及藻细胞基因表达方面的影响研究却十分有限亟待加强,对藻光合作用的影响机制亦不够全面。REEs对微藻的毒性研究主要集中在对光合作用的影响方面,对基因表达的影响以及微藻吸收、富集和代谢REEs的研究均涉及较少。
总之,新兴污染物对微藻的毒作用与机制的研究仍不系统,尚不清晰,毒性效应及其生态风险也未能准确判定,今后可以考虑加强以下几个方面的研究:(1)不仅开展微藻暴露于新兴污染物的场景模拟研究,更应重视实际暴露研究,在此过程中探明新兴污染物在水/微藻、水/颗粒/微藻、水/底质/微藻等多介质环境中的迁移转化行为与赋存形态变化,分析新兴污染物的生物可利用性,并解析新兴污染物对微藻的实际暴露水平;(2)开展微藻对新兴污染物的降解转化行为研究,探明暴露后微藻代谢通路水平、信号通路水平的变化与机制,更为准确地评估新兴污染物对微藻可能带来的毒性效应,尤其关注对微藻增殖与固碳产氧能力的影响;(3)微藻在地球上无处不在,是生态系统中重要的初级生产者,包括氧气在内为其他生物提供了大量用于生存与繁衍所需的物质与能量,新兴污染物对微藻生长及其群落的干扰可能对整个生态系统造成巨大风险,因此,建议将微藻列为优先检测生物类群,研究并开发适用于不同环境介质(包括不同水环境)的新兴污染物微藻毒性快速检测技术。
致谢:感谢中国科学院生态环境研究中心魏东斌研究员在文章小结修改中给予的帮助;感谢美国佐治亚理工大学土木与环境工程学院谢兴助理教授对本文英文摘要修改的帮助。

