一氧化氮熏蒸处理对甜瓜采后细胞壁代谢及黑斑病控制的影响
石 玲,吴 斌,敬媛媛,李亚玲,李 玲,何 欢,廖海慧,朱 璇,
(1.新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052;2.新疆农业科学院农产品贮藏加工研究所,新疆 乌鲁木齐 830052)
甜瓜(Cucumis melo L.)在我国新疆广泛种植,种植面积达8.22×108m2,年总产量达292.17万 t[1]。甜瓜果实含水量高,采摘季节处于炎热夏季,采后生理代谢活动旺盛,细胞壁结构易受到破坏,贮藏过程中质地变软[2],易受到病原微生物侵染产生病害,尤其是链格孢引起的黑斑病[3-4],可造成严重的采后损失。
细胞壁作为植物细胞的第一层屏障,其构成成分改变会影响到细胞的形状、延展性和防御功能[5]。果胶和纤维素作为细胞壁主要结构物质,果胶物质在多聚半乳糖醛酸酶(polygalacturonase,PG)、果胶甲酯酶(pectin methyl esterase,PME)的协同作用下由大分子质量的非水溶性物质转化为小分子质量的水溶性物质,细胞壁骨架断裂,纤维素被纤维素酶(cellulase,Cx)降解,导致果蔬细胞壁结构和功能改变[6-7]。果实细胞壁结构是否完整对抵抗病原菌侵染能力大小、果实的贮藏时间长短都起着重大意义[8]。研究发现,化学杀菌剂虽然在一定程度上可防治黑斑病,但存在着化学残留、病菌产生耐药性以及环境污染的问题,因此使用受到限制[9]。前人研究发现,采后处理可以诱导或激发果实细胞壁的抗性反应,增强果实对病原菌侵染的抵抗能力[10]。
NO是一种具有广泛作用的信号分子,能够影响果蔬的品质变化及抗逆反应[11-12]。目前,研究表明利用NO处理枇杷果实[13]、莲雾果实[14]、草莓[15]、番木瓜[16],能够减缓其细胞壁的解聚,抑制果实细胞壁水解酶的活性,使果胶和半纤维素分解速率减慢,有利于保持果实的品质。Hu Meijiao等[17]发现NO处理有利于维持芒果果实硬度,并提高芒果对炭疽病的抗性。已有研究表明,外源NO处理能够诱导采后果蔬获得一定的抗病能力,达到增强果蔬抗病性及保持果蔬品质的目的[18]。目前,研究多集中在采后NO处理对果实抗病效果的影响,NO处理对果实细胞壁代谢的影响和抗病性的关系则研究较少。
本实验主要探究NO熏蒸处理对甜瓜果实采后细胞壁代谢和抗病性的影响,以期为NO广泛应用于果蔬采后的病害防控提供理论参考。
1 材料与方法
1.1 菌株、材料与试剂
用于甜瓜果实损伤接种的病原菌交孢链格孢(Alternaria alternata),由新疆农业大学微生物实验室提供。
试材甜瓜品种为‘西州蜜25号',于2017年7月18日在新疆鄯善县甜瓜种植基地采摘,选取生长周期(可溶性固形物质量分数为15%~18%)和色泽相近、无机械损伤和病虫害、果柄留有T形藤蔓的甜瓜果实,套发泡网装箱后,及时运回,并于通风阴凉处除去田间热。
咔唑、半乳糖醛酸、溴麝香酚蓝、羧甲基纤维素钠、葡萄糖、结晶酚、3,5-二硝基水杨酸、戊二醛、浓硫酸、酒石酸钾钠均为国产分析纯。
1.2 仪器与设备
DZKW-D-4电热恒温水浴锅 北京中南路业仪器有限公司;HWJRL-2红外加热炉 北京科普瑞医疗仪器有限公司;FW-80高速万能粉碎机 广州仪科实验室技术有限公司;DELTA320分析天平 梅特勒-托利多仪器(上海)有限公司;DZG-303A超纯水仪 四川卓越水处理设备有限公司;Himac CR-20B2大型台式冷冻离心机、SU8000新型场发射扫描电子显微镜 日本日立公司;GY-4型数显式果实硬度计 乐清市艾德堡仪器有限公司。
1.3 方法
1.3.1 熏蒸处理
将甜瓜放入带有风扇的密封箱中。根据预实验浓度筛选结果,采用60 μL/L NO熏蒸3 h,以置于密封箱中无NO熏蒸处理的甜瓜作为对照组。每处理30 个甜瓜,重复3 次。熏蒸处理结束后,将果实于(25±1)℃放置12 h后进行损伤接种处理。
1.3.2 损伤接种
参照Deng Lili等[19]的方法并稍作修改。取在马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基培养7 d的A. alternata,加入含有体积分数0.05% Tween-80的无菌水20 mL,用无菌药匙刮下PDA培养基上的孢子,转移到50 mL三角瓶内,摇晃混匀后用纱布滤除大块絮状物,将A. alternata孢子浓度调节至1×106个/mL。先用无菌水擦拭两组甜瓜果实的表皮并晾干,再用体积分数75%的乙醇溶液擦洗消毒。晾干后用灭菌的铁钉在甜瓜横向中心线等间距穿刺5 个直径3 mm、深4 mm的孔洞,每个孔洞分别注入20 μL孢子悬浮液,用胶带封住孔洞。损伤接种后,将果实放入纸箱中于(25±1)℃ 下贮藏,每隔2 d取样测定相关指标。
1.3.3 指标测定
1.3.3.1 病斑及发病率测定
每隔2 d测定并记录贮藏期间各组的病斑直径、病斑深度和发病率。
病斑直径:接种部位果皮削去,用直尺在病斑处进行十字交叉法测量病斑直径,单位为mm。
病斑深度:将接种部位纵向切开,用直尺在病斑处测量病斑深度,单位为mm。
记录出现病害的孔洞数量(病斑直径大于4 mm的孔记为发病孔数),发病率按下式进行计算。

1.3.3.2 硬度的测定
用刀片在甜瓜果实横径处切开,在距果皮5 mm的切面处选取等间距的6 点,用GY-4型数显式果实硬度计进行测定(探头直径3 mm),多次测定的平均值记为甜瓜果实硬度,单位为N。
1.3.3.3 细胞膜渗透率的测定
细胞膜渗透率参照曹建康等[20]的方法测定。
1.3.3.4 果胶物质及纤维素质量分数的测定
原果胶、可溶性果胶、纤维素质量分数的测定参照曹建康等[20]的方法。
1.3.3.5 PG、PME、Cx活力的测定
PG活力测定参考Verma等[21]的方法。以每分钟每克样品于37 ℃下分解果胶产生1 μg的游离半乳糖醛酸为1 个酶活力单位(U)。
PME活力的测定参照Guo Qin等[22]的方法。以OD620nm每分钟减少0.01为1 个酶活力单位(U)。
Cx活力的测定参照曹建康等[20]的方法。以每分钟每克样品40 ℃分解羧甲基纤维素钠产生1 μg的无水葡萄糖为一个酶活力单位(U)。
1.3.3.6 微观结构的观察
在甜瓜接种后第2、6、10天进行随机取样,用干净刀片从甜瓜赤道接种部位周围取0.5 cm×1 cm×2 mm瓜皮,装入含体积分数2.5%戊二醛溶液的离心管中,于4 ℃的条件下固定,固定后分别在体积分数为65%、75%、85%、95%、100%的丙酮溶液中脱水处理20 min,脱水后将瓜皮裁剪成3 mm×2 mm×2 mm的方块,用导电胶粘在洁净的工作台上,通过E-1045离子溅射仪进行喷金处理,放入扫描电子显微镜工作台后开始观察和拍照。
1.4 数据处理与分析
利用SigmaPlot 12.0软件对数据进行整理和制图,采用SPSS 22.0软件对测定的数据进行方差分析,利用邓肯氏多重比较对差异显著性进行分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 NO处理对甜瓜果实贮藏过程中损伤接种病斑的影响
如图1A所示,NO熏蒸处理可明显降低果实损伤接种A. alternata后的病斑直径,贮藏第8天对照组果实病斑直径为17.64 mm,NO处理组甜瓜果实病斑直径为8.70 mm,NO处理组病斑直径比对照组低50.68%,且整个贮藏期间处理组病斑直径一直显著低于对照组(P<0.05)。
如图1B所示,甜瓜果实在整个贮藏期间,果实病斑深度逐渐增加。在贮藏第6天处理组病斑深度为10.50 mm,对照组果实病斑深度为16.90 mm,对照组病斑深度比处理组深60.95%,且在贮藏第4天开始NO处理组甜瓜果实病斑深度一直显著低于对照组(P<0.05)。
如图1C所示,甜瓜果实的发病率随贮藏时间延长而升高,且整个贮藏期间,NO处理组果实发病率一直低于对照组。NO处理组甜瓜果实在前2 d未发病。在第8天,对照组果实发病率为100%,而NO处理组仅有46.70%甜瓜果实发病,NO处理组发病率比对照组低53.30%(P<0.05)。
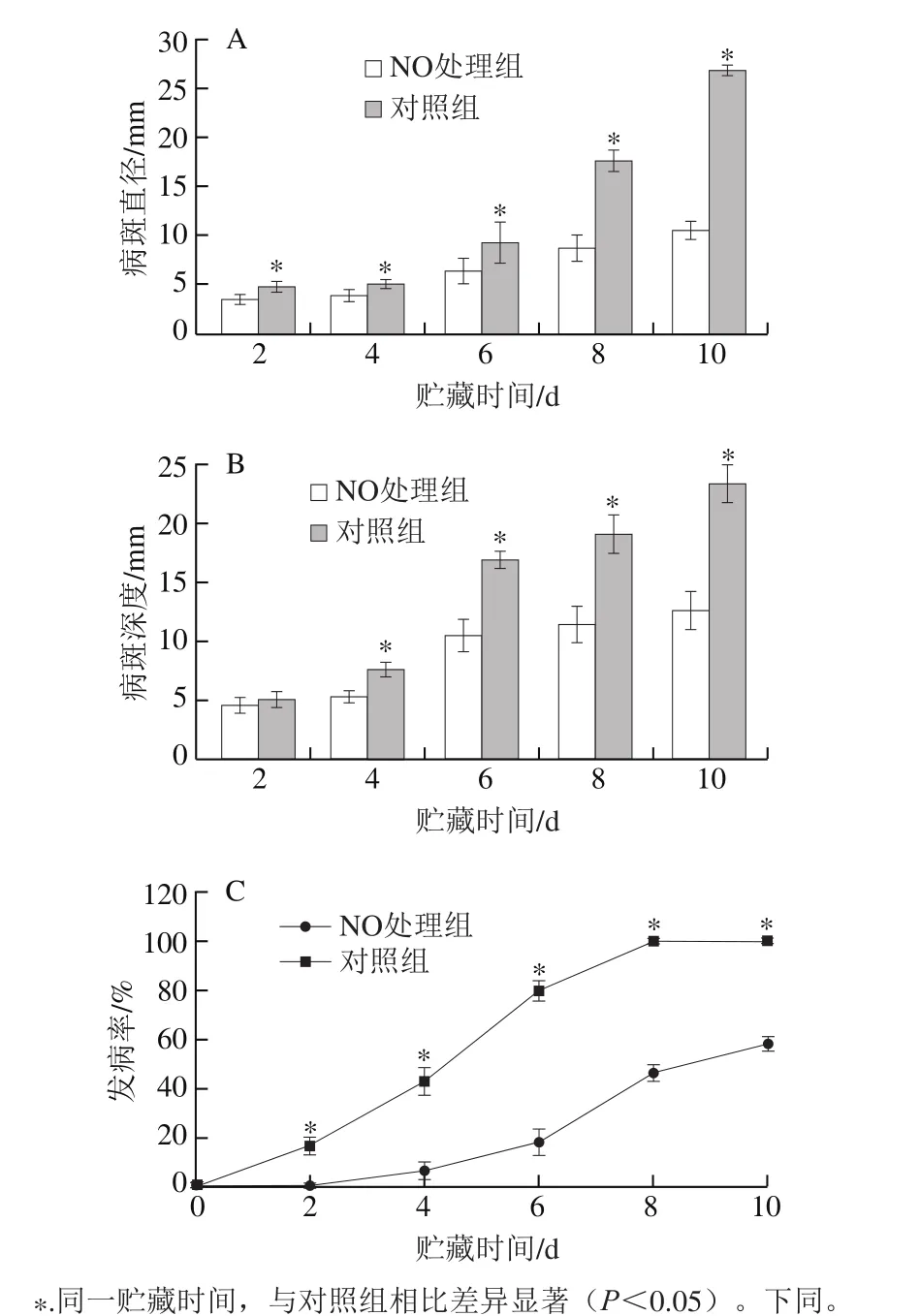
图1 NO处理对甜瓜果实贮藏期间病斑直径(A)、病斑深度(B)、发病率(C)的影响Fig. 1 Effect of NO treatment on lesion diameter (A), depth (B) and disease incidence (C) of melon fruit
2.2 NO理对甜瓜果实贮藏过程中硬度的影响
如图2所示,两组甜瓜果实硬度在贮藏期间均逐渐下降,但经NO熏蒸处理后的甜瓜果实硬度在整个贮藏期均高于同期对照组果实。在贮藏结束时,NO处理组和对照组甜瓜果实硬度分别为24.14 N和17.70 N,与采收时相比分别降低21.37%和42.35%,两组果实硬度差异达显著水平(P<0.05)。

图2 NO 处理对甜瓜果实贮藏期间硬度的影响Fig. 2 Effect of NO treatment on firmness of melon fruit
2.3 NO处理对甜瓜果实贮藏期间细胞膜渗透率的影响

图3 NO处理对甜瓜果实贮藏期间细胞膜渗透率的影响Fig. 3 Effect of NO treatment on cell membrane permeability of melon fruit
由图3可知,在整个贮藏过程中两组果实细胞膜渗透率总体上呈现出升高趋势,NO处理组的甜瓜果实细胞膜渗透率一直低于同期对照组。在第8天时,NO处理组甜瓜果实的细胞膜渗透率比同期对照组低10.66%(P<0.05)。
2.4 NO处理对甜瓜果实贮藏期间果胶物质质量分数的影响
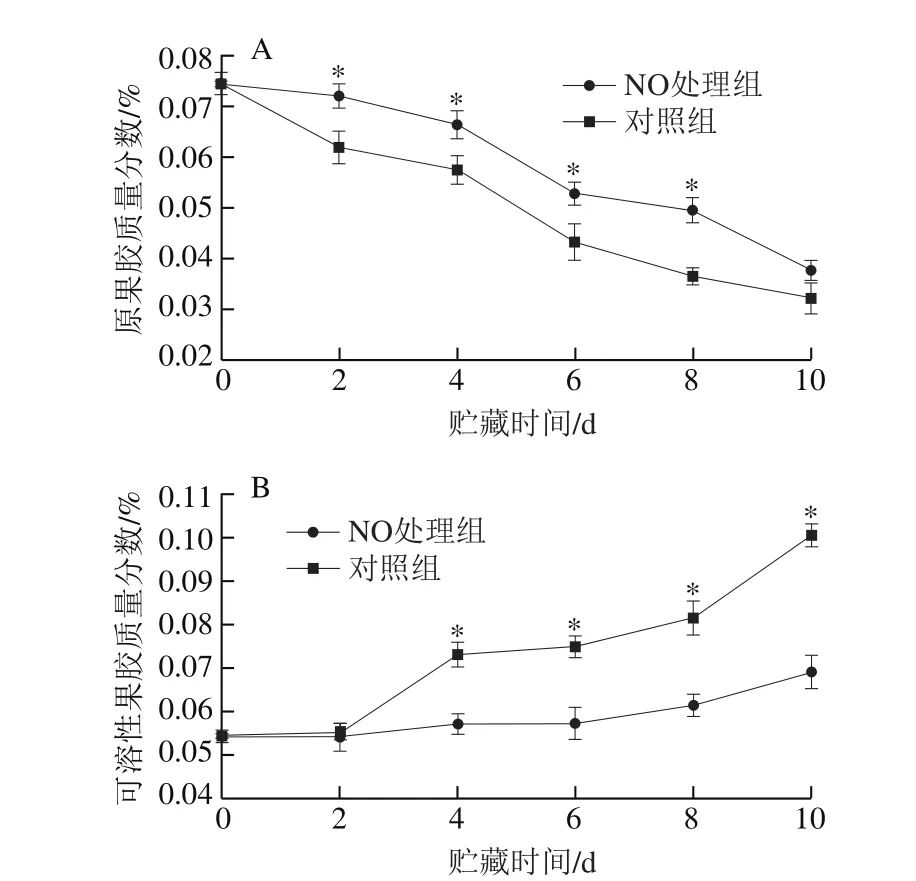
图4 NO处理对甜瓜果实贮藏期间原果胶(A)和可溶性果胶(B)质量分数的影响Fig. 4 Effect of NO treatment on propectin (A) and soluble pectin (B)contents of melon fruit
由图4A可知,甜瓜果实原果胶质量分数在贮藏过程中呈现出持续下降趋势,且NO处理后的甜瓜果实中原果胶质量分数一直比同期对照组高。第8天时,NO处理组甜瓜果实和对照组原果胶质量分数分别为0.049%和0.036%,NO处理组果实中原果胶质量分数比同期对照组高36.11%(P<0.05)。
由图4B可知,随着贮藏时间的延长,甜瓜果实可溶性果胶质量分数呈上升趋势,但NO熏蒸处理后的甜瓜上升较为缓慢,且对照组可溶性果胶质量分数始终高于NO处理组。对照组甜瓜果实内可溶性果胶在2~8 d内增加了48.00%。第6、10天时,NO熏蒸处理后甜瓜果实中可溶性果胶分别比同期对照组低23.60%和37.50%(P<0.05)。
2.5 NO处理对甜瓜果实贮藏期间纤维素质量分数的影响

图5 NO处理对甜瓜果实贮藏期间纤维素质量分数的影响Fig. 5 Effect of NO treatment on cellulose content of melon fruit
由图5可知,随着贮藏时间延长,甜瓜果实纤维素质量分数呈先上升后下降的趋势。第6天时,NO处理组和对照组纤维素质量分数均达到最大值,分别为0.34%和0.30%,NO熏蒸后的甜瓜果实纤维素质量分数比对照组高13.33%(P<0.05)。
2.6 NO处理对甜瓜果实贮藏期间PG、PME、Cx活力的影响


图6 NO处理对甜瓜果实贮藏期间PG(A)、PME(B)、Cx(C)活力的影响Fig. 6 Effect of NO treatment on the activities of PG (A), PME (B) and Cx (C) in melon fruit
如图6A所示,贮藏期间,甜瓜果实PG活力呈先上升后下降的趋势,NO处理组PG活力在第2天后开始低于对照组。NO处理组和对照组在第6天达到最大值,分别为7 258.97 U和8 245.06 U,且NO处理组甜瓜果实PG活力比对照组低11.96%(P<0.05)。
由图6B可知,甜瓜果实PME活力随着贮藏时间延长呈现先上升后下降的趋势。贮藏第6天,NO处理组和对照组甜瓜果实PME活力达到峰值,分别为14.13 U和22.93 U,NO处理组甜瓜果实PME活力比对照组低38.37%(P<0.05),两处理组间的PME活力在贮藏结束时无显著差异(P>0.05)。
如图6C所示,随着贮藏时间延长,两组甜瓜果实Cx活力呈现先升高后降低的趋势,NO处理组的甜瓜果实和对照组果实的Cx活力分别在第8、6天达到最大值,分别为2 771.87 U和3 778.90 U。在贮藏第6天时,NO处理组甜瓜Cx活力为2 710.28 U,比此时对照组低28.28%(P<0.05)。
2.7 NO处理对甜瓜瓜皮贮藏期间超微结构的影响

图7 NO处理对甜瓜贮藏期间瓜皮表面气孔超微结构的影响(×2 000)Fig. 7 Effect of NO treatment on stomatal ultrastructure of melon skin (× 2 000)
在损伤接种A. alternata第2天,NO处理组甜瓜果皮内气孔的结构保持完整(图7B1),但是对照组气孔收缩,气孔结构被破坏(图7A1);接种后第6天,对照组果实瓜皮表面气孔结构遭到破坏,并且被凋亡的细胞和代谢产物堵塞难以分辨(图7A2),而NO处理组瓜皮表面气孔也受到破损,气孔结构发生一定的塌陷(图7B2);在贮藏第10天时,NO处理组瓜皮表面气孔结构发生塌陷,并且可以看到少量菌丝已从气孔长出(图7B3),对照组甜瓜表皮的气孔被菌丝、凋亡细胞和代谢物覆盖,甜瓜表皮气孔被严重破坏(图7A3)。

图8 NO处理对甜瓜贮藏期间瓜皮表面裂纹超微结构的影响(×1 000)Fig. 8 Effect of NO treatment on the ultrastructure of surface cracks in melon fruit (× 1 000)
甜瓜果实在损伤接种A. alternata第2天,NO处理组甜瓜瓜皮裂纹处没有出现菌丝的生长和扩散(图8B1),但是对照果实的裂纹处开始出现菌丝生长的现象(图8A1);接种后第6天时,NO处理组甜瓜瓜皮裂纹处开始有少量菌丝分布(图8B2),而对照果实的裂纹处裂纹的深度加深,伴有大量菌丝长(图8A2);接种后第10天时,NO处理组甜瓜瓜皮裂纹处裂纹加深并出现部分菌丝生长(图8B3),而对照果实的裂纹处裂纹的宽度增加,菌丝生长密集(图8A3)。
3 讨 论
一般认为细胞壁是果实发挥防御作用、抵抗病菌侵染的第一道屏障[23]。细胞壁结构的完整性对果实抗病性有重要的意义,细胞壁被破坏会导致果实抗病性降低[24]。果蔬细胞壁的主要组成物质有果胶、半纤维素以及纤维素等植物多糖。纤维素与果胶等结合在一起是组成细胞壁的基本物质,起支撑作用,有利于保持细胞壁结构。采后果实细胞壁代谢过程中发生原果胶分解,可溶性果胶比例增高,细胞内中胶层初生壁解体,丧失对原生质体的支持力,引起膜破裂,果实抗病性降低[25]。
细胞壁降解酶引起细胞壁结构破坏,是导致植物病害的主要致病因子之一。本实验结果说明适量的NO熏蒸处理能够延缓甜瓜果实PME、PG、Cx活力的上升,可以有效地维持果实中原果胶的含量稳定,抑制可溶性果胶质量分数增高,保持细胞内纤维素质量分数相对稳定,减缓果实细胞壁代谢。这与高维亚等[26]采用NO熏蒸处理莲雾果实、敬媛媛等[27]利用水杨酸处理甜瓜果实的研究结果一致。
本实验结果发现,随着贮藏时间的延长,甜瓜果实采后细胞膜渗透率持续升高,而NO熏蒸处理有利于保持细胞膜的结构,抑制果实中细胞膜渗透率的增加,提高细胞抗病性。甜瓜果实接种后,果皮接种部位周围出现突起,这可能是由于细胞抗病应激反应形成突起状结构的乳突,其主要成分是胼胝质和木质素[28]。随着果实病情的加重,果皮结构受到破坏,组织结构崩塌,在病原体攻击后,胼胝质可以沉积在质膜和细胞壁之间或气孔周围[29],作为物理屏障阻止微生物进入宿主细胞或阻止其获得宿主细胞的营养从而抑制病原菌生长[30],而NO处理有效维持果实受侵染时气孔结构的完整性,NO熏蒸处理的甜瓜果实表面乳突较对照果实明显变大并且保持时间更长,降低了病原微生物对果实的侵染力。这与She Xiaoping[31]和Tomoko[32]等的研究结果相近。通过果皮裂纹结构的电子扫描显微镜图片可以看出,对照果实裂纹及气孔结构遭到很大程度破坏,随着贮藏时间延长,裂纹的深度和宽度增加,果皮裂纹中布满菌丝。
本实验表明采后NO处理可增强甜瓜果实对病原菌的抵抗能力,一方面是因为该处理能抑制甜瓜果实PG、PME和Cx的活力,有效保持了果实的硬度,同时能较好地维持细胞膜、细胞壁、气孔等结构完整性,抑制细胞膜渗透率的上升;另一方面是因为采后NO处理能较好地维持细胞膜、细胞壁、气孔等结构完整性,可有效抑制病原菌侵入。近年来也有研究表明NO可以通过阻碍黑斑病菌的生长来延长苹果的贮藏时间[33],说明NO增强果实采后抗病性是多方面的,其机理有待进一步研究。
4 结 论
采后60 μL/L NO熏蒸处理能够明显抑制甜瓜果实贮藏期间PG、PME、Cx活力及可溶性果胶质量分数升高,保持了果实硬度;同时,NO处理能够有效维持细胞膜、细胞壁、气孔等结构完整性,抑制细胞膜渗透率的上升,较好地抑制果实气孔及裂纹部位菌丝的生长,显著降低接种果实病斑直径、病斑深度及发病率,说明NO熏蒸处理可以通过调节甜瓜果实采后细胞壁代谢,控制其采后病害的发生。

