超声处理对牛乳酪蛋白结构及抗原性的影响
薛海燕,操 歌,贺宝元,樊娇娇,薛丽欢
(1.陕西科技大学食品与生物工程学院,陕西 西安 710021;2.陕西科技大学轻工科学与工程学院,陕西 西安 710021)
牛乳中大约含有30 种以上具有潜在致敏性的蛋白质,酪蛋白(casein,CN)、β-乳球蛋白(β-lactoglobulin,β-Lg)和α-乳白蛋白(α-lactalbumin,α-LA)等都是牛乳的主要过敏原[1]。其中CN占牛乳中蛋白的80%左右,主要由α-CN、β-CN和κ-CN组成[2]。Anguita等[3]研究发现β-CN在牛乳CN中的抗原性最强,而α-CN是牛乳中所含有且人乳中不存在的蛋白[4],因此CN中更易含有可以被人体免疫系统识别的抗原表位,容易导致过敏反应。
目前已报道多种乳蛋白改性技术可以降低其过敏性。蛋白质改性就是用生物和化学因素(如微生物发酵、酶制剂等)或物理因素(如加热、超声波、超高压等)使蛋白质的氨基酸残基和多肽链发生某种变化,引起蛋白质的大分子空间构象和理化性质发生改变,一定程度消除或掩埋抗原表位从而降低牛乳的致敏性,得到功能特性和营养特性较好的乳蛋白及其制品[5]。Bu Guanhao等[6]通过不同温度加热处理乳清分离蛋白后,测定其抗原性,结果发现当加热温度在90 ℃以下时,α-LA和β-Lg的抗原性增加,当温度高于90 ℃时,两种蛋白的抗原性均显著下降。Enomoto等[7]将麦芽五糖利用干热法结合到α-LA上,结果显示其抗原性降低,其中,糖与蛋白的比例和加热温度都不同程度地影响着抗原抑制率。廖萍等[8]将复原脱脂牛乳经德氏乳杆菌保加利亚乳杆菌亚种进行发酵及冷藏,用间接竞争酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法测定了凝乳中β-CN的抗原性,结果表明,复原脱脂乳发酵会降低其抗原残留量。Lee等[9]发现γ射线照射牛乳中α-CN和β-Lg后,可能改变蛋白抗原表位的结构,降低其抗原性。
超声波是一种频率大于20 kHz的声波,其频率高、波长短,不仅方向性好、功率大、穿透力强,还能引起空化作用和一系列的反应效应、乳化效应、热学效应、力学效应等,这些效应可以改变食品的某些性质,导致细胞破坏、酶失活、病毒失活等。这种无危害、无化学添加的非热处理手段使其在食品加工中受到了人们越来越多的关注[10]。超声波处理在乳品中的应用越来越广泛,Wu Yuwei等[11]利用超声波处理β-Lg并对其结构进行检测,得出超声处理该蛋白质具有改善抗氧化活性的潜力。Zhang Ruihua等[12]利用高强度超声对胶束CN浓缩物进行预处理,综合分析其结构与溶解度、乳化性、胶凝率的变化,推测出高强度超声预处理有利于胶束CN浓缩物功能特性的改变。近年来也有部分学者研究了超声波处理对致敏食物抗原性的影响,邓涵等[13]通过超声波改性大豆7S蛋白,结果显示超声80 min可降低大豆7S蛋白致敏性。马涛等[14]用超声波处理三文鱼并研究蛋白结构的变化,得出过敏原蛋白的构象发生改变导致了其抗原性降低。Li Zhenxing等[15]研究发现,经超声处理后的虾肉蛋白,纯化虾原肌球蛋白免疫球蛋白(immunoglobulin,Ig)E的结合能力降低了80%。李雪等[16]研究0~500 W超声处理对β-Lg抗原性的影响,结果表明该蛋白抗原性呈先升高后降低的趋势,在400 W、25 min时达到最大,比未处理时增加了133%,500 W时抗原性有所回落,结合蛋白结构的检测结果,得出超声处理可能改变β-Lg高级结构,导致其过敏表位的暴露。邹丽[17]利用辐照协同超声对β-Lg进行改性,并结合蛋白的结构变化,得出蛋白的部分抗原决定簇被破坏、蛋白抗原性降低的结论。
目前有关超声处理对CN影响的研究多为探究蛋白结构与理化特性方面的关系,或者单独探究抗原性及致敏性的变化,而对CN的结构变化与抗原性相关关系的研究较少,本研究采用不同的功率超声处理牛乳α-CN和β-CN,并结合蛋白结构的变化,综合分析超声处理对CN结构和抗原性影响的相互关系。研究旨在探究利用超声处理改变CN致敏性的现实意义,为降低致敏蛋白的抗原性提供新思路。
1 材料与方法
1.1 材料与试剂
α-CN和β-CN标准品 美国Sigma公司;兔抗α-CN和β-CN多克隆抗体为本实验室自制;辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔IgG北京博奥森生物技术有限责任公司;其余化学试剂均为分析纯。
1.2 仪器与设备
JY92-IIN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;电泳仪 北京百晶生物技术有限公司;UV75-18紫外-可见分光光度计 上海江岳仪器仪表有限公司;全波长扫描式多功能读数仪 美国赛默飞世尔科技有限公司;圆二色光谱仪 英国应用光物理公司。
1.3 方法
1.3.1 超声处理CN
用0.01 mol/L pH 7.4的磷酸盐缓冲液(phosphate buffered saline,PBS)将样品配成1 mg/mL的α-CN、β-CN溶液,取25 mL于烧杯中,放入超声波细胞破碎仪中(探头直径为6 mm)进行超声波处理。设置超声功率分别为0(对照)、150、300、500、650 W,超声时间为15 min。其间,脉冲工作3 s,休息8 s,整个超声过程使用冰浴降温,使样品的温度保持在10 ℃以下,超声完毕后4 ℃保存备用。
1.3.2 超声处理后蛋白质结构分析
1.3.2.1 分子质量的分析
参照程妮[18]的方法,将超声处理后的CN配制成质量浓度为10 mg/mL的溶液,采用质量分数12.5%的分离胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),上样量为10 μL,分析超声处理对两种蛋白质分子质量的影响。
1.3.2.2 羰基含量的测定
在Wehr等[19]的方法上有所改进。取蛋白样品溶液3 mL于10 mL离心管中,加入1 mL的10 nmol/L邻甲苯甲醛(2,4-dinitrophenylhydrazone,DNPH)溶液(由2 mol/L HCl配制),漩涡振荡,充分混匀,室温下避光放置30 min,每5 min漩涡振荡1 次。加入1 mL终质量浓度20 g/100 mL的三氯乙酸,离心(4 000×g、20 min),加入1 mL乙醇-乙酸乙酯(1∶1,V/V)混合溶液洗涤沉淀3 次去除多余的DNPH。将所得沉淀溶解在6 mol/L的盐酸胍溶液(由0.01 mol/L的PBS配制)中,37 ℃放置15 min至完全溶解,4 000×g离心3 min除去不溶物。以不加蛋白样品为空白,在370 nm波长处测量上清液的吸光度,用Bradford法测上清液中的蛋白质含量。羰基含量按朗伯-比尔定律(式(1))计算。

式中:A为所测样品的净吸光度;ε为DNPH的摩尔吸光系数(22 000 L/(mol·cm));b为比色皿厚度/mm;c为羰基含量/(nmol/g)。
1.3.2.3 自由巯基含量的测定
在Ellman's DTNB方法[20]上有所改进。取1.0 mL的样品溶液与4.0 mL Tris-Gly缓冲溶液(含0.086 mol/L Tris、0.09 mol/L Gly、5 mmol/L乙二胺四乙酸,pH 8.0)混匀,再加入50 μL 4 mg/mL的Ellman's试剂(4.0 mg DTNB溶于1.0 mL的Tris-Gly缓冲液),37 ℃反应15 min,在412 nm波长处测其吸光度。按式(2)计算自由巯基含量。

式中:A为吸光度;D为稀释倍数;ρ为样品质量浓度/(mg/mL)。
1.3.2.4 蛋白质二级结构的测定
超声处理前后的两种牛乳CN样品用PBS配制成0.01 mg/mL溶液,利用圆二色光谱仪对其进行检测。测定条件:扫描范围210~280 nm,石英样品池光程为0.01 cm,扫描速率为100 nm/min,带宽为0.5 nm,步长为1 nm。圆二色光谱测定的谱图结果,通过系统自带的分析软件进行二级结构相对含量分析。
1.3.2.5 疏水性的测定
用8-苯氨基-1-萘磺酸铵盐(8-anilino-1-naphthalenesulfonic acid ammonium salt,ANS)荧光探针法[21]对疏水性进行测定。取不同功率下超声处理的0.1 mg/mL CN样品,将20 μL 5 μmol/L的ANS溶液加入到4 mL 0.1 mg/mL的待测样品中,混匀放置5 min,用全波长扫描式多功能读数仪扫描样品的荧光光谱。测定条件如下:激发波长为370 nm,扫描发射波长范围为400~600 nm,电压为400 V,狭缝宽度均为10 nm。用荧光强度表示疏水性的大小。
1.3.3 CN抗原浓度的测定
用间接竞争ELISA法测定被处理的α-CN和β-CN的残余抗原性[22]。在间接竞争ELISA体系中待测抗原与包被抗原竞争结合抗体血清,因此被测抗原的抗原性与吸光度成反比。把α-CN和β-CN分别稀释至最佳包被质量浓度6.25 μg/mL和12.5 μg/mL,取100 μL包被96 孔板,4 ℃过夜;加入待测抗原(或系列稀释的标准抗原用来建立标准曲线)与羊抗兔IgG预混液进行竞争反应1 h,对照组不加待测抗原;加入4 000 倍体积稀释的羊抗兔IgG-HRP标记物进行检测并显色,测得吸光度,无抗原竞争时的吸光度为A0,各相应浓度抗原抑制时的吸光度为A,以ln(A/(A0-A))为纵坐标,以CN相应浓度的对数(lg[α-CN]或lg[β-CN])为横坐标,制作标准曲线,根据标准计算得待测抗原浓度,反映抗原性的变化。
1.4 数据统计与分析
数据以平均值±标准差表示,采用SPSS软件的单因素方差分析方法进行显著性分析,以P<0.05表示差异显著。
2 结果与分析
2.1 CN分子质量分析结果

图1 超声功率对α-CN(A)、β-CN(B)分子质量的影响Fig. 1 Effect of ultrasound power on molecular mass of α-CN (A) and β-CN (B)
从图1A的SDS-PAGE图可以看出,在150~650 W的超声功率内,α-CN电泳条带所出现的位置与对照组比较无明显变化,说明在实验条件下,不同的超声功率处理对α-CN的分子质量无明显影响。图1B中显示,β-CN的电泳条带在150~500 W的超声功率范围内无明显变化,但在650 W时其灰度明显降低,却未出现新条带,这可能是由于超声引起的空化效应和局部高温过于剧烈时,CN部分亚基发生了降解,蛋白质分子间的氢键和二硫键等相互作用形成分子质量大的聚合体,无法进入凝胶中所致[23]。
2.2 CN羰基含量变化

图2 超声波处理功率对α-CN(A)、β-CN(B)羰基含量的影响Fig. 2 Effect of ultrasound power on carbonyl contents of α-CN (A)and β-CN (B)
蛋白质中许多侧链氨基酸官能团容易氧化生成羰基衍生物,因此羰基含量通常被认为是判断蛋白氧化的指标之一,一般来说,羰基含量越高,氧化程度越大[24]。从图2中可以看出,当超声功率增加至650 W时,α-CN和β-CN的羰基含量分别增加了12%和15%。说明超声处理在一定程度上会使得α-CN和β-CN被氧化,且随着超声功率的增加,被氧化程度也随之增加。这是因为α-CN和β-CN含有较多的无规卷曲结构,该类蛋白的结构特点是疏松无序,超声的空化效应会产生局部高温,会导致蛋白中的还原性氨基酸等被氧化形成羰基[25]。
2.3 自由巯基含量变化

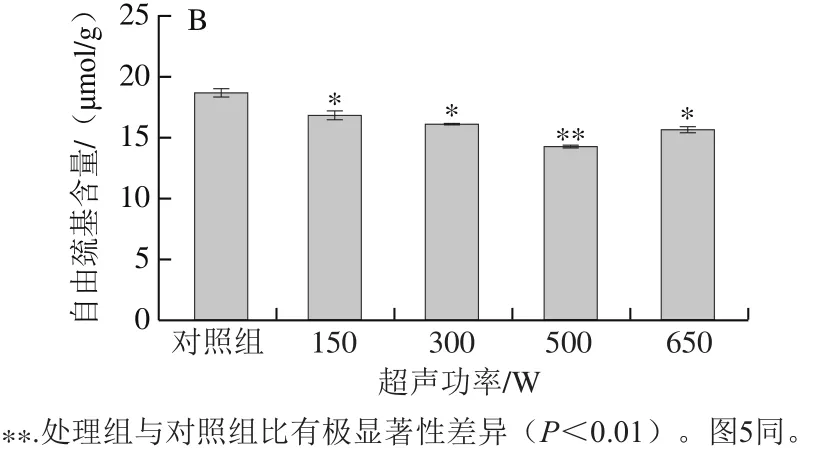
图3 超声功率对α-CN(A)、β-CN(B)自由巯基含量的影响Fig. 3 Effect of ultrasound power on free sulfhydryl group contents of α-CN (A) and β-CN (B)
蛋白质中重要的官能团之一便是巯基基团,巯基相互交联形成二硫键以维持蛋白质结构的稳定[26]。导致自由巯基含量变化的原因有二,一方面超声波作用过程中气泡破裂会产生高强度的振动波和剪切力,造成α-CN和β-CN结构改变,使得α-CN和β-CN内部的自由巯基暴露到蛋白表面,导致自由巯基含量增多;另一方面,超声波的空化效应会使水分子分解成高活性的氢自由基和羟自由基,并氧化掉暴露到蛋白表面自由巯基,使得自由巯基含量减少[27]。从图3可以看出,α-CN和β-CN在超声条件到达500 W时的自由巯基含量较对照组分别降低了22.3%和23.8%,但在650 W时,α-CN和β-CN的自由巯基含量比对照组分别下降了16.9%和16.7%,比500 W时略有回升。这是由于超声功率在小于500 W时,自由巯基暴露速率低于其被氧化的速率,因此总含量减少;而功率达到650 W时,超声效应过于剧烈导致蛋白结构更加无序松散,二硫键更易遭到破坏,此时产生自由巯基的速率大于其被氧化的速率,最终导致α-CN和β-CN自由巯基含量回升。
2.4 二级结构相对含量的变化

表1 不同超声波功率对α-CN二级结构各组分相对含量的影响Table 1 Effect of ultrasound power on secondary structure content of α-CN

表2 不同超声波功率对β-CN二级结构各组分相对含量的影响Table 2 Effect of ultrasound treatment power on secondary structure content of β-CN
通过在线软件对超声处理后的α-CN和β-CN圆二色光谱数据进行分析,得到两种CN二级结构相对含量结果如表1、2所示,其中,近60%的二级结构是以α-螺旋、β-折叠的形式存在,这些都是蛋白的弹性结构;β-转角相对含量是反映蛋白结构松散性的指标之一[28];无规卷曲对蛋白构象有着重要作用。在α-CN和β-CN二级结构中,α-螺旋和无规卷曲相对含量最高,分别为36%~39%和30%~32%,β-转角相对含量约为16%~19%,而β-折叠相对含量最少,约为14%~17%。从表中显著性分析可看出,α-CN和β-CN的α-螺旋结构经超声处理后与对照组相比显著性减少,这是由于超声波空穴作用产生的局部高温使得螺旋结构部分展开或断裂[23];β-转角相对含量随着超声功率的增加总体呈现出显著性增长趋势,该现象会增加蛋白的比表面积,一般来说蛋白的抗原结合位点多存在于β-转角区域,该结果或将导致抗原表位的暴露。在超声功率小于500 W时,α-CN和β-CN的无规卷曲结构的相对含量随着超声功率的增强而增加,推测是剪切效应导致CN分子结构变得无序松散;超声功率达到650 W时,相对含量却开始下降,该现象与自由巯基含量的变化结果一致,无规卷曲相对含量变化或将导致蛋白功能实施和构象发生改变。β-折叠相对含量在功率小于500 W时,随着超声功率的增加呈现显著性降低趋势,α-CN和β-CN分别减少了21.0%和27.4%,功率达到650 W时却分别减少了12.7%和19.5%,比500 W时略有回升,这表明在超声处理过程中,CN的二级结构发生了去折叠变化,一定程度破坏了蛋白的弹性结构;当功率到达650 W时,过于剧烈的空化效应导致蛋白的结构更加扭曲复杂,产生新的折叠结构。综上所述,超声波处理会使得CN的空间结构内部发生变化,同时,结构的改变或将导致蛋白抗原性发生改变。
2.5 CN的疏水性变化
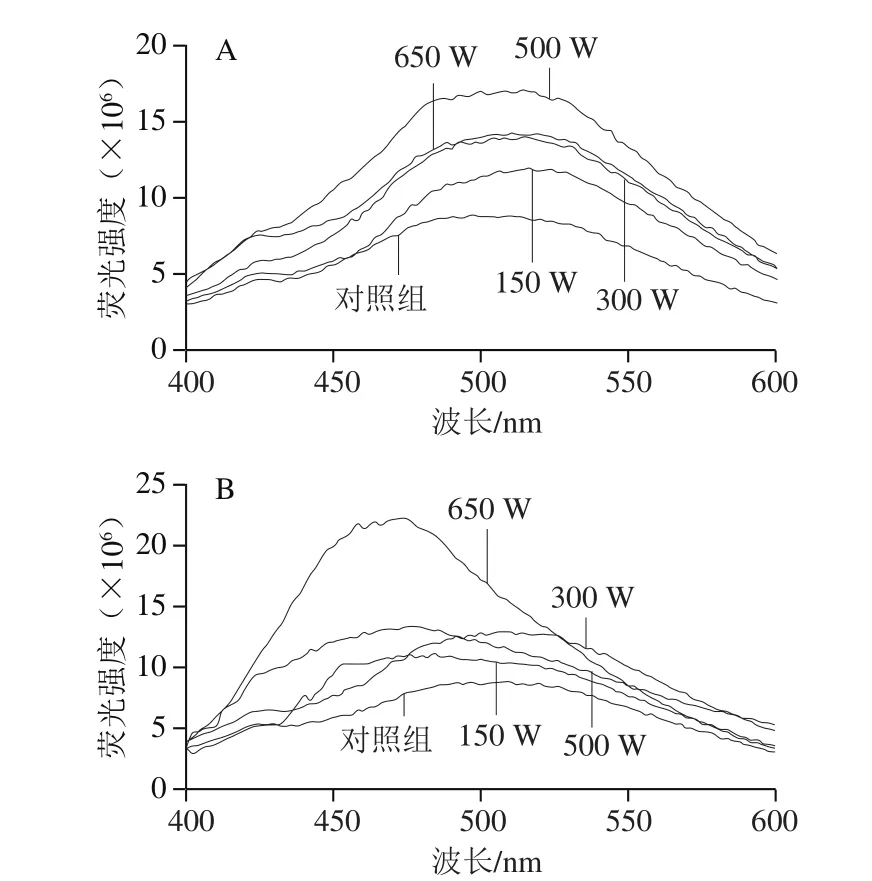
图4 不同超声功率下α-CN(A)、β-CN(B)的荧光光谱Fig. 4 Fluorescence spectra of α-CN (A) and β-CN (B) treated with different ultrasonic powers

表3 不同超声波功率对CN疏水性检测最大荧光强度的影响Table 3 Effect of ultrasonic power on maximum fluorescence intensity for hydrophobicity of caseins
图4是由ANS检测法得到的两种CN不同超声处理条件下的荧光光谱图。蛋白质疏水性基团的相互作用力是维持蛋白质三级结构的重要的作用力,通过检测蛋白质表面疏水性的变化就可以了解蛋白质三级结构的变化。目前,应用最为广泛的方法是荧光探针法,在一定范围内,最大荧光强度与蛋白表面的疏水性呈线性关系[29]。结合表3可以看出,经过不同超声功率处理后,α-CN的最大荧光强度在超声功率小于500 W时显著增强,结合二级结构的变化,说明当二级结构中的α-螺旋结构向无规卷曲结构转变时,分子结构变得松散,包埋在内部的疏水性区域外翻到蛋白分子表面,与疏水性探针ANS结合,使荧光强度增强,此时表面疏水性增加;在功率为650 W时略有降低,这是由于随着超声波处理强度进一步增大,局部高温和剧烈的空化效应使蛋白分子内部的电荷分布发生改变,导致α-CN的内部基团相互靠近交联,且结合β-折叠的增多可知此时蛋白结构再次发生折叠,使分子表面的疏水性氨基酸重新掩埋到分子内部无法与荧光探针结合[30],此时荧光强度降低,表明疏水性减弱;β-CN在功率小于500 W时与α-CN疏水性变规律一致,而当超声功率为650 W时,荧光强度达到最大,但其吸收峰发生了蓝移现象,结合SDS-PAGE图分析结果,可能是由于在此超声条件下β-CN的蛋白内部聚集,产生了大分子物质使得荧光强度增大。
2.6 CN抗原性的变化

图5 超声功率对α-CN(A)、β-CN(B)抗原性的影响Fig. 5 Effect of ultrasonic power on antigenicity of α-CN (A) and β-CN (B)
如图5所示,α-CN的抗原性总体大于β-CN的抗原性,两种蛋白随着在0~500 W时均呈现上升趋势,在功率为500 W时,抗原性分别上升了41.1%和71.7%。在功率达到650 W时,α-CN和β-CN抗原性有所下降,但仍高于对照组的抗原性,结合游离巯基和羰基含量的变化以及二级结构无规卷曲和β-折叠相对含量变化综合分析,可以推测CN的抗原性或与β-螺旋相对含量呈负相关,与无规卷曲相对含量呈正相关,且与其氨基酸侧链修饰也有一定关联。
3 讨 论
超声处理在乳制品加工中运用广泛,但在乳品致敏蛋白方面的研究却较少。李雪[16]、冯景丽[28]等的研究结果表明超声波处理会使蛋白的结构发生改变,且对致敏蛋白的抗原性产生一定的影响,因此通过超声处理改变致敏蛋白结构,进而改变其抗原性的方法是可行的。本研究对牛乳的α-CN和β-CN进行不同功率的超声处理,通过SDS-PAGE、表面羰基及巯基含量测定以及二级结构和疏水性分析,探究CN结构是否会影响抗原性,为研究超声处理是否可以改变过敏蛋白的致敏性提供理论参考。
本研究中,随着超声功率的增加,α-CN的分子质量并没有显著变化,这与Stanic-Vucinic等[31]关于超声对β-Lg结构影响研究中的结果相似,但β-CN在超声功率为650 W时发生了蛋白聚集等现象,导致条带变浅。α-CN和β-CN羰基含量都有不同程度的增加,说明超声在一定程度上导致了CN发生氧化。巯基含量的减少与氧化有关,其中,α-CN内部折叠发生改变,导致巯基基团的暴露或掩埋;同时超声波的空化效应会使水分子分解成高活性的氢自由基和羟自由基,与暴露到蛋白表面自由巯基发生氧化反应,最终使得α-CN和β-CN的自由巯基含量减少。
随着超声功率的增加,两种CN的二级结构发生了非常复杂的改变,圆二色光谱结果显示:随着超声功率的增加,α-CN和β-CN中的α-螺旋相对含量持续减少,β-转角相对含量呈现增多趋势,无规卷曲相对含量先增多后降低,在500 W时达到最大,β-折叠相对含量则呈现与无规卷曲结构相反的变化规律。表明超声功率会导致蛋白的弹性结构减少,无序性增强,蛋白比表面积增大,从而暴露出一些原本掩埋的抗原表位[32-33]。
α-CN结构中只有两个疏水区,而β-CN是所有CN中疏水性最强的蛋白[34],疏水性的变化与其二级结构的变化相关,结果显示超声功率小于500 W时,随着超声功率的增大,两种蛋白疏水性均有不同程度的增强,二级结构中无规卷曲相对含量增加,结构松散、疏水区暴露;在650 W的功率下,α-CN的疏水性降低,这是由于过于剧烈的空化效应导致蛋白结构的卷曲变化使分子表面的疏水性氨基酸重新掩埋到分子内部,最终疏水性变弱,这与Silva等[35]利用超声处理改变蛋白质溶液的理化及结构特性的疏水性研究结论相似;而β-CN经处理后疏水性远远强于未处理蛋白,这是由于剧烈的超声波除去了CN胶粒的表面极性静电,使得疏水区域增多,疏水性增强,进而易产生交替聚集[36],这与β-CN的分子质量变化规律一致。
CN抗原性的结果变化趋势则与二级结构中的无规卷曲结构的含量变化规律一致,与β-折叠结构的含量变化规律相反。结合二级结构的分析结果,这是由于在超声功率小于500 W时,超声的空化效应导致蛋白结构发生改变,无规卷曲相对含量的增加和β-折叠相对含量的减少使得蛋白结构松散无序,导致蛋白分子表面的抗原表位暴露到分子表面,部分隐性过敏表位变为显性,更易与抗体特异性结合,抗原性升高。在功率达到650 W时,α-CN和β-CN抗原性有所下降,但仍高于未处理时的抗原性,结合二级结构的无规卷曲的增加和β-折叠含量变化分析,这是由于CN的结构再次发生部分折叠,无序网状蛋白发生层片化,使得部分暴露出的抗原表位再度被包埋;再综合其自由巯基含量和羰基含量的变化结果综合分析,推测部分肽段的抗原表位在650 W的高强度超声功率下,因超声空化效应产生的局部高温而失活或被氧化,使抗体与抗原表位的结合率减少,最终导致抗原性降低。李雪[37]在研究超声波对β-Lg蛋白的抗原性影响时得到过类似结果。
综上所述,经过超声处理后的α-CN和β-CN均发生了一定程度的氧化;蛋白二级结构发生了尤为复杂的变化,最终使得蛋白质构象发生改变,导致CN疏水性变强,且原本紧密的弹性结构变得空洞化、片层化;无序松散的蛋白结构造成抗原表位发生一定程度的暴露或包埋,导致其抗原性发生改变。随超声功率增大,两种CN抗原性先增大后略减小,与疏水性的变化一致,与β-折叠结构相对含量呈现负相关,与无规卷曲结构相对含量呈正相关。但CN的结构十分复杂,蛋白致敏性结果并非单因素所致。因此,超声处理是否会引起致敏性的改变,还需进一步结合模拟肠胃消化及采用对牛乳过敏患者的血清(含IgE)进行ELISA实验过敏原检测等深入探讨。

