不同地域典型干腌火腿肌原纤维蛋白的氧化特性及体外消化性对比
詹 光,乐 怡,王 颖,孙杨赢,潘道东,党亚丽,何 俊,曹锦轩,
(1.宁波大学食品与药学学院,浙江 宁波 315211;2.武汉轻工大学食品科学与工程学院,湖北 武汉 430023)
干腌火腿是以猪的后腿为原料,经腌制、发酵成熟等阶段制作而成的肉制品。干腌火腿因其鲜美的滋味和浓郁的香气而备受消费者青睐。目前,国际上较为典型的干腌火腿主要有西班牙的伊比利亚火腿、塞拉诺火腿,中国金华火腿、宣威火腿、如皋火腿,意大利帕尔玛火腿,以及中国改进意大利工艺生产的巴马火腿。巴马火腿与帕尔玛火腿工艺相似,原料均来自意大利猪的优良品种,二者均在低温度、高湿度环境下分两次上盐,随后经过腌制、洗涤、干燥、预发酵和发酵成熟等过程[1-2]。金华火腿原料来自金华“两头乌”或其杂交后代,宣威火腿原料来自“乌金猪”,二者用盐量较高且上盐次数多。宣威火腿发酵温度一般略低于室温;金华火腿前期发酵温度较低,后期升高,再长时间的堆叠后熟[3-4]。蛋白质的消化率和营养价值与蛋白结构和氧化特性密切相关。Bax等[5]的研究表明,蛋白质的消化率是评估蛋白源食物营养特性的重要参数。Rémond[6]的研究表明,原料来源及加工过程影响蛋白的可消化性和生物利用率。Bermúdez等[7]研究也发现,腌制和风干过程可诱导猪肉蛋白质氧化和降解,从而影响胃肠道中的蛋白质消化率。Sun Weizheng等[8]研究表明氧化导致蛋白质聚集和交联,从而降低蛋白质消化率。因此,研究干腌火腿肌原纤维蛋白的氧化特性和体外消化性具有重要意义。但鲜有研究比较西式干腌火腿、本土火腿、外来工艺改进火腿的蛋白消化和利用率。
体外消化模型具有简单、成本低、快速、通用、可再生等优点,被广泛应用于食物的研究,主要可用于食物消化稳定性、肠道运输和代谢、预测食物成分的生物利用率以及药品转运等领域[9]。体外模拟消化也常用于研究食物蛋白在体内的转运机制[10]。Bordoni等[11]利用体外消化模型评估肉类产品的消化性,结果表明在胃模拟阶段被消化的蛋白少,而其在十二指肠中则迅速被消化。Gianfrani等[12]研究了不同消化条件对麸质蛋白致敏性的影响,结果发现越接近胃肠道消化的真实过程,蛋白消化越彻底,致敏性越低。体外消化模型有助于研究食物蛋白质在肠道的消化能力和营养功能[13]。Zhou Changyu等[14]研究了不同烹饪温度对金华火腿蛋白消化率的影响,结果表明100 ℃下金华火腿蛋白消化率最高,该方法为同时比较西式干腌火腿、本土火腿、外来工艺改进火腿的蛋白消化和利用率提供了参考。
为系统理解不同地域和工艺来源的干腌火腿蛋白结构和消化性,本研究评估了4 种著名干腌火腿(帕尔玛火腿(西式干腌火腿)、金华火腿和宣威火腿(本土火腿)、巴马火腿(外来工艺改进火腿))肌原纤维蛋白的表面疏水性、巯基和二硫键含量、微观结构、蛋白降解程度、粒径和体外消化性,旨在为干腌肉制品的营养特性研究提供理论依据。
1 材料与方法
1.1 材料与试剂
巴马火腿和金华火腿 浙江金字火腿股份有限公司;宣威火腿 云南云港宣威火腿食品有限公司;帕尔玛火腿意大利Cim Alimentari Spa公司。所有用于实验室测定的肌肉样品,均选取经过成熟发酵后成品火腿的上方火腿芯部位,火腿级别均为一级。
焦磷酸盐、氯化钾、氯化镁、乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA-2Na)、马来酸、Tris、Tris-HCl、三氯乙酸(trichloroacetic acid,TCA)、盐酸、甘氨酸(Gly)、尿素、5,5-二硫代双(2-硝基苯甲酸)(5,5'-dithiobis(2-nitrobenzoic acid),DTNB)、β-巯基乙醇、溴酚蓝、胃蛋白酶(10 U/mg)、胰蛋白酶(6.6 U/mg)、α-胰凝乳蛋白酶(0.33 U/mg)均为国产分析纯。
1.2 仪器与设备
DY89-I高速匀浆机 宁波新芝生物科技股份有限公司;Allerga冷冻离心机 美国贝克曼库尔特公司;M200 Reader酶标仪 瑞士TECAN公司;ALPHA 1-4 LD plus冷冻干燥机 德国Christ公司;WH966漩涡搅拌器 上海康华生化仪器制造有限公司;BCA蛋白定量试剂盒 碧云天生物技术有限公司;S3400 N扫描电子显微镜 日本日立公司;3000激光散射器英国Malvern公司;Universal Hood Ⅱ型凝胶成像分析系统 美国Bio-Rad公司;FD-1D-80真空冷冻干燥机北京博医康实验仪器有限公司;E0303电泳仪 宁波欧普仪器有限公司。
1.3 方法
1.3.1 肌原纤维蛋白的提取
肌原纤维蛋白提取参考曹锦轩等[15]方法。取4 g样品剪碎,加入30 mL焦磷酸盐饱和缓冲液(100 mmol/L KCl、2 mmol/L MgCl2、2 mmol/L EDTA-2Na、2 mmol/L Na4P2O7、10 mmol/L马来酸,pH 6.8),在冰浴条件下以10 000 r/min匀浆30 s,每10 s匀浆1 次。匀浆液1 000×g冷冻离心10 min收集沉淀,将沉淀物重新分散在15 mL肌原纤维蛋白提取液(100 mmol/L KCl、2 mmol/L MgCl2、2 mmol/L EDTA-2Na、1 mmol/L二硫糖苏醇、10 mmol/L马来酸,pH 6.8)中,1 000×g冷冻离心10 min收集沉淀,重复3 次。所得沉淀用15 mmol/L Tris-HCl缓冲液(pH 8.0)洗涤3 次,得到纯化的肌原纤维蛋白。蛋白质量浓度采用BCA试剂盒进行测定,采用牛血清白蛋白做标准曲线。所有样品保存于-80 ℃环境中。
1.3.2 肌原纤维蛋白巯基和二硫键含量的测定
将1.3.1节提取的肌原纤维蛋白用15 mmol/L Tris-HCl缓冲溶液调整蛋白质量浓度为3 mg/mL。巯基和二硫键含量的检测方法参照Cui Chun等[16]的方法。
巯基含量的测定:0.5 mL蛋白溶液与2.5 mL Tris-Gly-尿素溶液(尿素浓度8 mol/L)以及0.02 mL 4 mg/mL DTNB溶液混合充分,在25 ℃恒温摇床中振荡30 min,摇匀后取样,在412 nm波长处测定吸光度A0。巯基含量按式(1)计算。

二硫键含量的测定:0.2 mL蛋白溶液与1 mL Tris-Gly-尿素溶液(尿素浓度10 mol/L)以及0.02 mL β-巯基乙醇混合充分,在25 ℃恒温摇床中振荡1 h后加入10 mL TCA,继续振荡1 h后3 000×g离心10 min。沉淀溶于3 mL Tris-Gly-尿素溶液(尿素浓度8 mol/L)和0.03 mL DTNB溶液中,在25 ℃恒温摇床中振荡30 min,摇匀后取样在412 nm波长处测定吸光度A1。二硫键含量按式(2)计算。
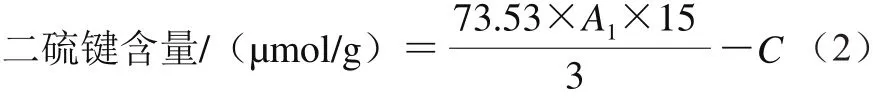
式中:C为样品中的巯基含量/(μmol/g)。
1.3.3 肌原纤维蛋白表面疏水性的测定
肌原纤维蛋白表面疏水性的测定参照Sun Weizheng等[8]的方法并稍作修改。将肌原纤维蛋白分散于20 mmol/L pH 6.0的磷酸盐缓冲液中,取2 mL 1 mg/mL蛋白溶液加入到10 mL离心管中,加入40 μL 1 mg/mL溴酚蓝溶液,室温下振荡孵育10 min,然后4 000×g离心15 min,取上清液于595 nm波长处测定吸光度,以未添加蛋白液的磷酸盐缓冲液作空白,以蛋白质结合的溴酚蓝质量表示蛋白质的表面疏水性。溴酚蓝质量按式(3)计算。
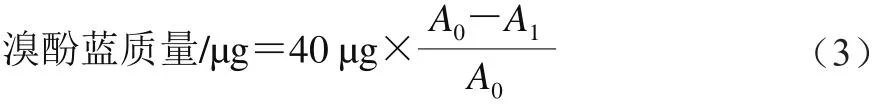
式中:A0为空白上清液的吸光度;A1为样品上清液的吸光度。
1.3.4 肌原纤维蛋白微观结构观察
根据Cao Jinxuan等[17]的方法稍作修改。在成像之前,将冷冻干燥的蛋白质样品用双面胶带固定于样品台,然后进行喷涂处理,采用场发射扫描电子显微镜在加速器电压为10 kV下,以不同的放大倍数对火腿肌原纤维蛋白的表面形态进行观察。
1.3.5 肌原纤维蛋白SDS-PAGE分析
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析参照Wang Daoying等[18]的方法,具体步骤如下。用15 mmol/L Tris-HCl缓冲液(pH 8.0)调整蛋白质量浓度为5 mg/mL。肌原纤维蛋白分离胶质量分数为15%,浓缩胶质量分数为5%。电泳前将蛋白质样品(5 mg/mL)与上样缓冲液(含2% SDS和5% β-巯基乙醇)按体积比1∶4混合并煮沸5 min,取10 μL上清液上样,恒压条件下进行电泳,蛋白在浓缩胶中电压为80 V,进入分离胶后增至120 V,共电泳2 h。电泳结束后,凝胶用考马斯亮蓝R-250(1 g/L)染色0.5 h,最后用含有体积分数50%甲醇和10%乙酸溶液的脱色液脱色至背景清晰。使用凝胶成像系统拍照。
1.3.6 肌原纤维蛋白粒径测定
根据Gatellier等[19]的方法,对提取的肌原纤维蛋白溶液使用激光散射器测定肌原纤维蛋白的粒径。以去离子水作为分散剂,颗粒折射率为1.414,颗粒吸收率为0.001。最终数据由Mastersizer 5.12c软件进行统计分析。
1.3.7 肌原纤维蛋白体外消化率的测定
体外消化率的测定参照Sante-Lhoutellier等[20]的方法稍作修改。蛋白质用33 mmol/L Gly缓冲溶液(pH 1.8)洗涤2 次,并调整最终质量浓度为0.8 mg/mL。蛋白质首先用胃蛋白酶在37 ℃下恒温消化1 h,用与缓冲液等体积的30%三氯乙酸在不同反应时间(0、10、20、30、40、60 min)终止消化反应,4 000×g离心10 min,取上清液在280 nm波长处测定OD值。蛋白质经过胃蛋白酶消化30 min后的不溶部分用33 mmol/L Gly缓冲液(pH 8.0)洗涤2 次,并调整最终质量浓度为0.8 mg/mL。用胰蛋白酶和α-胰凝乳蛋白酶在37 ℃下恒温消化30 min,在不同反应时间(0、5、10、20、30 min)用与缓冲液等体积的30%三氯乙酸终止反应,4 000×g离心10 min,取上清液在280 nm波长处测定OD值。蛋白水解速率用每小时OD值的变化量表示(ΔOD/h)。
1.4 数据处理与分析
每个实验重复5 次,数据以平均值±标准差表示。所得实验数据采用SAS 8.0软件进行单因素方差分析,使用Duncan's Multiple Range Test进行多重比较。
2 结果与分析
2.1 肌原纤维蛋白巯基含量和二硫键含量的分析

图1 4 种火腿肌原纤维蛋白的巯基含量和二硫键含量Fig. 1 Sulfhydryl and disulfide bond content of myofibrillar proteins in four dry-cured hams
巯基是蛋白质重要的功能性基团之一。研究表明,肌原纤维蛋白的天然构象中包含着大量巯基基团[21]。由图1可知,巴马火腿肌原纤维蛋白的巯基含量最低,金华火腿肌原纤维蛋白的巯基含量次之,且显著低于宣威火腿和帕尔玛火腿(P<0.05);二硫键含量分析表明,帕尔玛火腿肌原纤维蛋白的二硫键含量最高,金华火腿肌原纤维蛋白的二硫键含量最低,宣威火腿肌原纤维蛋白的二硫键含量显著高于巴马火腿(P<0.05)。Xiong Youling L.等[22]研究表明,巯基含量通常与蛋白质的氧化程度有关,较低的巯基含量往往表示蛋白氧化程度高。Cao Jinxuan等[17]研究肌原纤维蛋白中的肌动蛋白发现,随着蛋白氧化程度增加,巯基含量降低,二硫键含量升高。二硫键的形成可能是位于蛋白表面半胱氨酸的巯基被氧化所致[23]。在本研究中,由于4 种火腿加工工艺不同,造成火腿成品中肌原纤维蛋白的氧化程度不同,导致蛋白活性巯基和二硫键的含量具有差异。在4 种火腿中,帕尔玛火腿的二硫键含量显著高于其他3 种火腿,这表明蛋白氧化程度较高,蛋白之间巯基产生更多的交联作用,巯基向二硫键方向转化,加速蛋白的聚集。
2.2 肌原纤维蛋白表面疏水性的分析

图2 4 种干腌火腿肌原纤维蛋白的表面疏水性Fig. 2 Surface hydrophobicity of myofibrillar proteins in four dry-cured hams
蛋白质表面疏水性作为评估蛋白结构变化的一项重要指标,可以用来监测其微环境变化[24]。由图2可知,金华火腿肌原纤维蛋白表面疏水性显著高于巴马火腿、宣威火腿与帕尔玛火腿(P<0.05),巴马、宣威和帕尔玛3 种干腌火腿的肌原纤维蛋白表面疏水性无显著差异。表面疏水性的升高主要是蛋白结构的变化所致。大量研究表明,自然状态下蛋白的疏水性基团被包埋于蛋白内,蛋白质氧化后疏水性基团暴露[20]。Melander等[25]研究发现盐含量升高能够导致蛋白质疏水性升高。因此,在火腿加工过程中,腌制用盐量可能是导致4 种干腌火腿蛋白质表面疏水性差异的重要因素。金华火腿用盐量为火腿质量的6.5%~8.0%,高于巴马火腿和帕尔玛火腿。此外,加工温度可能是造成蛋白表面疏水性不同的另一个因素,李清正等[26]研究表明,20~40 ℃范围内,随着温度的升高,猪肉肌原纤维蛋白表面疏水性升高。据文献[27-28]报道,温度升高导致蛋白质空间构象的作用力逐渐减弱,内部疏水残基暴露,进而引发蛋白质表面疏水性升高。金华火腿发酵成熟阶段温度前低后高,前期温度在15~25 ℃之间,后期高达40 ℃,而巴马火腿、帕尔玛火腿采取的是低温发酵,前期温度为15 ℃,后期温度在18.0~20.5 ℃之间,宣威火腿发酵成熟阶段平均室温在15~20 ℃之间。因此,金华火腿采用前低后高的加工温度,也是成品中的蛋白质具有更高表面疏水性的重要原因。
2.3 肌原纤维蛋白微观结构分析

图3 4 种干腌火腿肌原纤维蛋白的微观结构(2 000×)Fig. 3 Microstructure of myofibrillar proteins in four dry-cured hams (2 000 ×)
如图3所示,金华火腿肌原纤维蛋白相比于其余3 种火腿蛋白结构更为伸展、细小、均匀,蛋白聚集程度低;巴马、宣威、帕尔玛火腿蛋白结构较粗糙、排列杂乱,蛋白质交联明显。蛋白质结构伸展会增大内部疏水性位点的暴露程度,导致表面疏水性增强;聚集或交联会导致疏水性氨基酸被埋藏,导致表面疏水性降低[29]。因此,金华火腿肌原纤维蛋白伸展的表面可能暴露出更多的疏水基团,从而导致蛋白有更大的表面疏水性,这与表面疏水性的结果一致。相比于金华火腿,巴马、宣威、帕尔玛火腿蛋白有明显的交联和聚集现象,二硫键含量的测定结果也证实了这一现象,表明巴马、宣威、帕尔玛火腿蛋白有更高的氧化程度,肌原纤维蛋白中巯基的氧化促进了二硫键的生成,加速了蛋白质之间的交联和聚集[30]。
2.4 肌原纤维蛋白体外模拟消化前后SDS-PAGE图谱分析
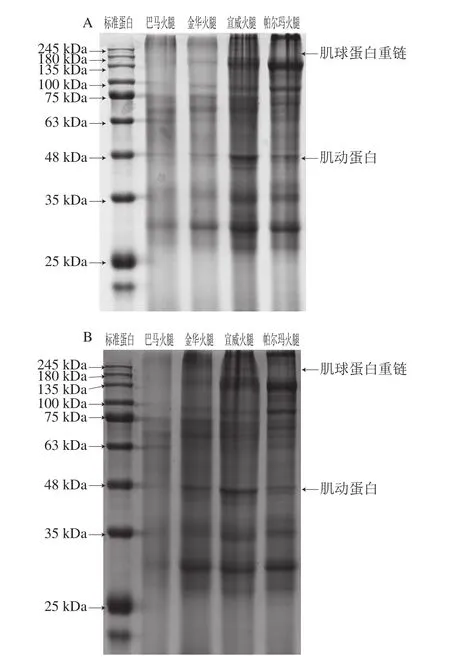
图4 肌原纤维蛋白体外模拟消化前(A)、后(B)SDS-PAGE图谱Fig. 4 SDS-PAGE of myofibrillar proteins before (A) and after (B)stimulated digestion in vitro
图4 显示了4 种火腿的肌原纤维蛋白消化前后谱带灰度的差异。在未经酶消化的样品中,肌球蛋白重链(220 kDa)蛋白条带不明显,可能是由于火腿长时间的发酵成熟过程导致蛋白降解。巴马火腿、金华火腿的大部分蛋白条带灰度明显低于宣威火腿、帕尔玛火腿,这可能是由于前二者在加工过程中肌原纤维蛋白发生了更大程度地降解。经过胃蛋白酶、胰蛋白酶及α-胰凝乳蛋白酶2 步消化后,4 种火腿大部分蛋白的条带灰度与消化前相比发生明显变化,其中135~180 kDa和25~35 kDa范围的蛋白条带灰度变浅,这与Paolella等[31]的研究中帕尔玛火腿在模拟胃肠消化后的蛋白电泳结果一致。肌原纤维蛋白条带灰度的降低或消失可归因于消化酶导致蛋白发生大幅降解[32]。酶消化后的宣威火腿、帕尔玛火腿的大部分蛋白条带灰度明显高于巴马、金华火腿,表明前二者肌原纤维蛋白的降解程度较低。在4 种火腿中,肌动蛋白(43 kDa)在消化后条带灰度变化不明显,这可能与肌动蛋白本身较稳定、难以与酶发生作用有关[33]。
2.5 肌原纤维蛋白的粒径分析
如表1所示,经过胃蛋白酶消化后,4 种火腿肌原纤维蛋白的各项粒径数值明显减小,其中帕尔玛火腿D3,2和D4,3值最低,宣威火腿最高,金华火腿D3,2值显著低于巴马火腿(P<0.05),D4,3值则相反。再经过胰蛋白酶、α-凝乳蛋白酶消化后,肌原纤维蛋白的各项粒径数值与胃蛋白酶消化后相比进一步的减小,金华火腿D3,2值最低,帕尔玛火腿最高,巴马火腿D3,2值显著低于宣威火腿(P<0.05);宣威火腿D4,3值最高,巴马火腿的D4,3值显著高于金华火腿和帕尔玛火腿(P<0.05)。Dx(10)、Dx(50)和Dx(90)值的变化趋势与D3,2和D4,3值基本一致。在本研究中,蛋白质的降解作用是导致粒径降低的主要原因。由于火腿种类的不同,导致未消化前蛋白的粒径存在差异。蛋白酶消化后蛋白粒径减小,因为在酶的作用下蛋白降解,减小了粒径[34],体外模拟消化前后SDS-PAGE图谱也表明蛋白发生了降解。经过蛋白酶消化后,4 种火腿粒径具有差异,是因为蛋白的氧化程度不同所致。Promeyrat等[35]研究结果表明蛋白质疏水性与粒径呈负相关。金华火腿蛋白表面疏水性较高,疏水性基团暴露程度高,提供了更多的酶识别位点,胃蛋白酶和α-胰凝乳蛋白酶能有效裂解疏水性氨基酸之间的肽键,使蛋白质降解程度更高,导致2 步酶消化后的蛋白粒径小于其余3 种火腿。此外,二硫键的形成导致蛋白质之间发生交联聚集,会掩埋酶的识别位点[36],2.1节结果也表明帕尔玛火腿蛋白的二硫键含量最高。因此,经过2 步酶消化后的帕尔玛火腿蛋白降解程度较低,蛋白粒径大于其余3 种火腿。

表1 4 种干腌火腿肌原纤维蛋白体外模拟消化前后粒径变化Table 1 Changes in particle size of myofibrillar proteins in four dry-cured hams after in vitro digestion
2.6 肌原纤维蛋白体外消化率的分析

图5 4 种火腿的肌原纤维蛋白体外水解速率Fig. 5 In vitro proteolysis rate of myofibrillar proteins in four dry-cured hams
体外消化模型由于建模简单、能初步评估膳食蛋白质生物利用度而广泛用于科学研究[37]。消化过程中的蛋白水解速率是评估蛋白体外消化性的重要指标,一般来说,蛋白水解速率越高,其消化性越好。如图5所示,胃蛋白酶消化后,金华火腿肌原纤维蛋白的水解速率最高,帕尔玛火腿肌原纤维蛋白的水解速率显著低于巴马火腿和宣威火腿(P<0.05)。胰蛋白酶和α-胰凝乳蛋白酶消化后,金华火腿肌原纤维蛋白的水解速率最高,帕尔玛火腿肌原纤维蛋白水解速率最低,巴马火腿肌原纤维蛋白的水解速率显著低于宣威火腿(P<0.05)。胃蛋白酶能有效裂解疏水性氨基酸和芳香族氨基酸(例如苯丙氨酸、色氨酸和酪氨酸)之间的肽键,胰蛋白酶则对赖氨酸和精氨酸残基C端的肽键更为敏感;α-凝乳蛋白酶对苯丙氨酸、色氨酸和酪氨酸的N端的肽键较为敏感[38]。由于不同的酶有不同的酶切位点,因此体外模拟消化过程中达到最大蛋白水解速率的时间也不同。4 种火腿肌原纤维蛋白的水解速率差异与蛋白质表面疏水性的变化一致,较高的表面疏水性表明疏水性基团暴露程度高,蛋白中疏水性基团的暴露可以为胃蛋白酶和α-胰凝乳蛋白酶提供更多的识别位点。金华火腿肌原纤维蛋白的疏水性基团暴露程度高,便于胃蛋白酶和α-胰凝乳蛋白酶识别,因此在2 种酶消化后的蛋白水解速率高。此外,二硫键的形成会导致蛋白聚集,影响酶的特异性识别[36]。这可能是导致宣威和帕尔玛火腿肌原纤维蛋白在胃蛋白酶和胰蛋白酶、α-凝乳蛋白酶消化后水解速率低于金华火腿的原因。
3 结 论
体外模拟消化是评估蛋白消化、吸收能力的有效方式。本研究结果表明,4 种干腌火腿中,金华火腿有最大的体外消化率,而帕尔玛火腿的体外消化率最小,金华火腿相比于其他3 种干腌火腿更易于消化。4 种干腌火腿的体外消化率差异可能是由于肌原纤维蛋白的氧化程度不同,造成蛋白表面疏水性和聚集程度产生差异,从而导致消化酶与肌原纤维蛋白相互作用强度不同。本研究通过体外模拟消化实验探讨了4 种干腌火腿的消化吸收性和营养特性,为干腌肉品的消化和吸收特性提供了理论依据。

