乙酰丙酸对沙门氏菌诱导性耐酸响应
田牧雨,张一敏,董鹏程,毛衍伟,梁荣蓉,朱立贤,,罗 欣,2
(1.山东农业大学食品科学与工程学院,山东 泰安 271018;2.江苏省肉类生产与加工质量安全控制协同创新中心,江苏 南京 210095)
沙门氏菌(Salmonella)是与食品安全相关的最主要的食源性致病菌之一,能引起一系列人类疾病,包括急性高烧发热和胃肠炎等[1]。根据欧洲食品安全管理局的统计,欧盟每年就有10万多人被感染[2]。沙门氏菌可在各种恶劣的环境条件下生长,因此在食品安全方面存在一定的隐患。在肉类加工企业中,为了减少细菌(如大肠杆菌、沙门氏菌和单增李斯特菌)的污染,屠宰后的胴体在入库预冷前采用有机酸喷淋的方式进行减菌处理[3],或者以盐的形式添加到加工肉制品中以抑制细菌生长[4]。最常用的有机酸是柠檬酸、苹果酸、乳酸和醋酸等。此外,有研究表明,乙酰丙酸也具有相类似的抑菌效果[5]。美国食品药品监督管理局认证乙酰丙酸是一种可以直接添加到食品中的一般认为安全类物质[6]。
然而,弱酸环境可以提高沙门氏菌在其他环境压力下存活率并影响其毒性[7]。沙门氏菌具有复杂的调控机制以保护其应对诸多生物或非生物的不利因素[8-9]。Foster等[10]在1991年首先提出了诱导性耐酸响应(acid tolerance response,ATR),随后,沙门氏菌在酸应激条件下存活的适应性反应得到了广泛关注。诱导性耐酸响应的定义是指微生物在适度的低pH值环境中培养一段时间或暴露在微酸性环境中(酸适应),然后在普遍致命的低pH值环境中培养产生了抗性(酸激过程),称作诱导性耐酸响应或耐酸反应[10-11]。有学者对不同酸(苹果酸、柠檬酸、乳酸、醋酸、盐酸)诱导沙门氏菌产生耐酸能力的研究发现,柠檬酸诱导能力最强,而盐酸诱导能力最弱;其中乳酸和醋酸也具有较强的诱导能力[12]。ATR可增强细菌在酸性食品中的生存能力,使其在极端的胃酸环境中存活,严重威胁消费者的生命健康[13]。沙门氏菌的ATR受血清型、培养基组成、培养温度、pH值、酸化剂种类等多种条件的影响[14]。沙门氏菌在弱酸环境下的ATR是细胞内发生的一个复杂的生理生化反应,目前关于ATR的研究主要从pH值稳态系统、应激蛋白分子的调控、细胞膜组成和流动性控制等方面进行研究。因此,本实验研究了几种有机酸(L-乳酸、醋酸和乙酰丙酸)和盐酸在即食肉制品pH 6.0和肉极限pH 5.4下对两株不同血清型沙门氏菌的生长和ATR的影响,以及沙门氏菌在酸胁迫下的pHi变化,为进一步探究沙门氏菌的ATR提供参考。
1 材料与方法
1.1 菌株、材料与试剂
鼠伤寒沙门氏菌标准菌株(S. typhimurium ATCC 14028)和分离自我国肉牛屠宰企业中常见的德尔卑沙门氏菌(S. Derby),由山东农业大学食品学院畜产品加工实验室保存。
脑心浸液(brain heart infusion,BHI)培养基、脑心浸液琼脂(brain heart infusion agar,BHIA) 北京陆桥技术股份有限公司;L-乳酸 上海麦克林生物有限公司;醋酸、乙酰丙酸 上海阿拉丁工业公司;羧基荧光素琥珀酰亚胺脂 (5,6-carboxyfluorescein succinimidyl ester,CFSE) 美国AAT Bioquest公司。
1.2 仪器与设备
S210 pH计 瑞士Mettler Toledo公司;生物安全柜美国Thermo Scientific公司;红外线灭菌器 中国力康公司;804R离心机 德国Eppendorf公司;RF-5301PC荧光分光光度计 日本Shimadzu公司。
1.3 方法
1.3.1 菌株活化
原始菌株置于-80 ℃条件下贮藏。工作菌株按照1%的接种比例从贮藏液转接至BHI培养基(pH 7.4)中,37 ℃过夜(约18 h)培养。
1.3.2 生长曲线的测定
本实验对两株沙门氏菌在五种培养基中的生长曲线分别进行了测定。空白对照为100 mL BHI培养基(pH 7.4),盐酸对照组用盐酸调BHI培养基pH值分别为6.0和5.4。三个处理组为分别添加了L-乳酸、醋酸及乙酰丙酸的BHI培养基(pH值分别为6.0和5.4)。将上述所述的过夜(约18 h)培养的菌液,分别于4 ℃下离心(5 000×g,10 min)收集菌体(两株菌的细胞浓度约为108CFU/mL)。按1%的接种量,将其接种至上述各种BHI培养基中,37 ℃培养至稳定期。每小时收集样品,适度稀释后涂布于BHIA,并在37 ℃培养24 h后菌落计数。以lg(CFU/mL)表示存活细胞数量随时间变化,然后将数据拟合到Gompertz模型[15]生成生长曲线方程(1)。

式中:N0是初始细胞计数的对数(lg(CFU/mL));C是初始和最终细胞数之间的差值(lg(CFU/mL));k是最大比生长速率/h-1;LPD是迟滞期持续时间(lagphase duration)/h;X培养时间/h;Y是细胞计数的对数(lg(CFU/mL))。
生长动力学参数为:LPD、k、最大生长密度(maximum population density,MPD)(lg(CFU/mL))、达到稳定期所需的时间(time needed to reach the stationary-phase,TSP)/h和增代时间(generation time,GT)/h。GT根据式(2)计算。

式中:0.301为系数。
1.3.3 诱导性耐酸的测定
参考Liu Jiamei等[13]的方法,取1 mL培养至稳定期(10~48 h)的酸适应或非酸适应的菌液(两株菌的细胞浓度约为108CFU/mL)离心(8 000×g,5 min,4 ℃)后接种于9 mL的pH 3.0的BHI溶液(使用HCl调节)中酸激2 h。分别在酸激前和酸激2 h后,梯度稀释后涂布于BHIA平板培养基,37 ℃培养24 h,进行菌落计数。残存率以酸激前后菌落数比值的对数表示,并按照式(3)计算。

式中:NC为酸激后菌落数(lg(CFU/mL)),N0为酸激前菌落数(lg(CFU/mL))。3 次独立实验,每次实验做3 个平行。
1.3.4 pHi的测定
参照Breeuwer等[16]的方法,分别对上述两株沙门氏菌在不同培养条件中的pHi进行测定。
预处理:将两株沙门氏菌分别接种于如上所述的不同pH值条件下的100 mL空白对照培养基、盐酸对照培养基、L-乳酸、醋酸和乙酰丙酸的BHI培养基中。生长至稳定期,离心收集(8 000×g,10 min),用缓冲液D(含50 mmol/L HEPES缓冲液,5 mmol/L EDTA,pH 7.2)洗涤1 次后将其悬浮在等体积的缓冲液D中,加入一定量的终浓度为1.0 μmol/L CFSE,37 ℃避光温育30 min后,离心(8 000×g,0 ℃,15 min)收集菌体,在同样的条件下,用缓冲液E(含50 mmol/L KH2PO4-NaOH缓冲液,pH 6.8)洗涤1 次,去上清液,然后将其悬浮在缓冲液E中,再加入一定量的浓度为10 mmol/L的葡萄糖,37 ℃温育30 min后,用缓冲液E洗涤1 次,然后再将其悬浮在缓冲液E中细胞密度为108CFU/mL,避光冷藏备用。
建立pHi标准曲线:pHi标准缓冲液(含50 mmol/L氨基乙酸、50 mmol/L柠檬酸、50 mmol/L Na2HPO4·2H2O、50 mmol/L KCl)调节pH值分别为5.0、5.5、6.0、6.5、7.0、7.5、8.0和8.5,共8 种缓冲液。将上述进行荧光标记的菌液离心(8 000×g,4 ℃,10 min),然后将其悬浮在相等体积、pH值不同的8 种缓冲液中,制成一系列菌悬液,再加入一定量终浓度为1 μmol/L的缬氨霉素和终浓度为1 μmol/L尼日利亚菌素,使两株沙门氏菌细胞内外pH值达到平衡,15 min后,用荧光分光光度计测定发射波长为520 nm、激发波长分别为490 nm和435 nm的荧光强度(激发缝宽为5 nm,发射缝宽为10 nm)。以490 nm与435 nm的荧光强度的比值(R490nm/R435nm)为纵坐标,pHi标准缓冲液的pH值为横坐标,数据经R软件回归处理后,作出R490nm/R435nm随pH值变化的标准曲线。
pHi测定:在发射波长为520 nm、激发波长为490 nm和435 nm下,用荧光分光光度计分别测定上述处理后荧光标记的样品(悬浮在缓冲液E中)的荧光强度,求得R490nm/R435nm的比值;再根据制作的R490nm/R435nm随pH值变化的标准曲线,则可计算出R490nm/R435nm所对应的pHi。进行3 次独立实验,每次实验做3 个平行。
1.4 数据统计分析
采用SAS 9.0的混合模型(MIXED Procedure)进行统计分析,菌株、pH值和酸的种类作为对细菌残存率和pHi影响的固定因素,实验重复及固定效应的交互作用为随机因素,数据用平均值及标准误(standard error,SE)表示,差异显著水平P<0.05;采用Origin Pro 9.4软件和R 3.5.1软件作图分析。
2 结果与分析
2.1 不同pH值和酸化剂种类对沙门氏菌生长动力学参数的影响
在不同pH值(5.4和6.0)下,对两株沙门氏菌在盐酸、L-乳酸、乙酸和乙酰丙酸酸化的BHI(不含葡萄糖)和非酸化BHI培养基(pH 7.4)中的生长情况进行了测定。表1、2中显示了沙门氏菌的主要生长参数。Gompertz方程的决定系数(R2)均大于0.95,表明该方程能很好地拟合沙门氏菌在不同培养基中的生长情况。在生长培养基中添加有机酸可提高GT、TSP和LPD,并降低k和MPD。pH值为6.0时,不同有机酸对沙门氏菌的抑制效果与pH 5.4相似。本研究发现,低pH值延迟了沙门氏菌的生长,GT、TSP和LPD均较高,而MPD和k则较低。pH值为5.4时的环境对沙门氏菌有较好的抑菌效果且有机酸的抑菌效果高于无机酸。这与先前的研究在一定的pH值下,乳酸比盐酸具有更强的抑制作用是一致的[17]。
图1、2显示了不同pH值(5.4和6.0)下两株不同血清型的沙门氏菌在非酸化BHI(pH 7.4)和酸化BHI培养基(盐酸、L-乳酸、乙酸和乙酰丙酸)中的生长曲线。有机酸存在解离和未解离两种形式,未解离的有机酸由于与细菌的细胞膜具有相似相溶的特性,可经自由扩散直接进入细菌内部,由于细菌内部pH值接近中性,未解离的有机酸在细菌内部解离,降低了膜内pH值,削弱菌膜的跨膜梯度,进而抑制了细菌的生长[18]。
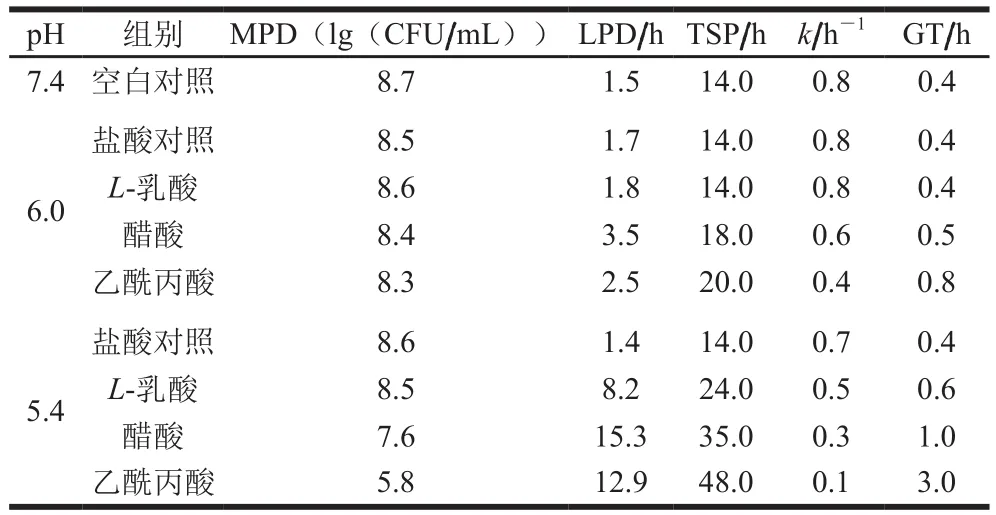
表1 鼠伤寒沙门氏菌的生长动力学参数Table 1 Growth kinetic parameters of S. typhimurium

表2 德尔卑沙门氏菌的生长动力学参数Table 2 Growth kinetic parameters of S. Derby

图1 鼠伤寒沙门氏菌在5 种培养基中的生长拟合曲线Fig. 1 Growth curves of S. typhimurium in various media

图2 德尔卑沙门氏菌在5 种培养基中的生长拟合曲线Fig. 2 Growth curves of S. Derby in various media
结果表明pH 5.4时,有机酸对沙门氏菌的抑制作用明显增强,其中乙酰丙酸对沙门氏菌的生长抑制作用最强,GT(3 h)和TSP(48 h)均较高(表1、2)。酸化剂的抑菌强弱为:乙酰丙酸>醋酸>L-乳酸>盐酸。这些结果与Álvarez-Ordóñez等[19]研究的结果一致,该学者测试了鼠伤寒沙门氏菌在不同pH值和不同温度下用醋酸、乳酸、柠檬酸和盐酸酸化的BHI中生长的能力,发现无论pH值和温度如何变化,酸抑制细菌生长的顺序均为:醋酸>乳酸>柠檬酸>盐酸。与乳酸和醋酸相比,乙酰丙酸具有更好的耐热性,更少的蒸发量,这可以提供最有效的杀菌效果[5]。本研究表明pH值为5.4的乙酰丙酸可以一定程度上抑制沙门氏菌的生长。
2.2 诱导性耐酸的测定
残存率是比较微生物的耐酸能力的重要指标。由表3可知,在弱酸性pH值下预适应显著增强了沙门氏菌的耐酸性。与非酸适应性细胞相比,酸适应的沙门氏菌细胞在pH 3.0的BHI培养基中残存率显著提高(P<0.05),沙门氏菌在弱酸环境中产生了较强的耐酸性,有机酸培养基中培养的沙门氏菌的ATR显著高于在无机酸环境中培养的沙门氏菌。另外,研究发现不同血清型菌株之间ATR存在差异,S. typhimurium对不同的有机酸产生的ATR差异显著(P<0.05),而乙酰丙酸处理的S. Derby的残存率在不同pH组存在显著差异(P<0.05)。
研究表明,在pH 5.4酸适应后产生的耐酸性显著高于pH 6.0酸适应后的耐酸性,pH 5.4提高了沙门氏菌对强酸的敏感性。在pH值为6.0的L-乳酸诱导下,pH 3.0酸激后S. typhimurium的菌落数减少约2.4(lg(CFU/mL)),而pH 5.4酸适应后,pH 3.0酸激后细菌的菌落数仅减少0.9(lg(CFU/mL))。该结果与刘佳玫等[20]报道的结果一致,在温和的低pH值环境下培养沙门氏菌使其耐酸性增强,即ATR。Burin等[21]发现在pH 6.0或pH 5.0时,沙门氏菌对有机酸的适应能力较强。然而,当pH值较低(pH 4.0)时,细菌在6~24 h后无法存活。另外Samelis等[22]的报告发现,酸适应使沙门氏菌对低温环境更敏感,在低温(10 ℃)下生长的鼠伤寒沙门氏菌与在30 ℃下获得的细胞相比,耐酸性降低。因此有机酸协同低温加工贮藏可作为控制食品微生物的方法。

表3 沙门氏菌在BHI(pH 3.0)酸激2 h后的残存率Table 3 Survival rates of Salmonella challenged in BHI at pH 3.0 for 2 h
不同酸化剂处理的沙门氏菌残存率存在一定差异(表3)。耐酸性强弱大致为:L-乳酸>醋酸>乙酰丙酸>盐酸,其中L-乳酸和醋酸耐酸性之间无显著性差异,乙酰丙酸耐酸性较弱且显著低于其他两组有机酸(P<0.05)。该结果与Zhang Yimin等[23]报道的酸适应性单增李斯特菌在pH 6.0乙酰丙酸与乳酸和醋酸中的存活率无显著性差异的结果不同,本研究发现乙酰丙酸适应下的沙门氏菌残存率低,说明其杀菌效果最强,这意味着乙酰丙酸可作为食品加工中一种理想的杀菌剂。但是这些结果需要进一步扩大ATR的研究以应对不同的环境条件,以促进设计和提高风险评估研究的准确性。
2.3 pHi的变化
pHi与细菌产生ATR的能力密切相关,在低pH值环境中,细胞质会通过排出质子来维持pHi的稳定[24]。测定pHi变化可以进一步探究沙门氏菌细胞在酸胁迫下维持pHi的能力。图3、4分别为S. typhimurium和S. Derby在BHI培养基中生长至稳定期pHi标准曲线。通过R软件回归处理后得到的模型检验P<0.01,R2趋近于1,拟合度较好。这表明,本研究所建立的以CFSE为荧光指示剂测定沙门氏菌pHi的方法是稳定的。因此,该方法在后续研究中被进一步用于测定不同条件下的pHi,以揭示沙门氏菌的耐酸性。由图3、4可知,随着pHi的升高,荧光强度比值(R490nm/R435nm)呈升高趋势。
表4为S. Typhimurium和S. Derby在不同pH值、不同酸培养基中生长至稳定期后的pHi。研究表明胞外pH值为5.4和6.0时,有机酸处理的沙门氏菌pHi与盐酸对照组相比普遍存在差异,有机酸在该pH值状态下诱导的致死酸应激使有机酸比无机酸更有效地缓解pHi。这与ATR结果一致,表明沙门氏菌有机酸诱导的耐酸反应与pHi的稳定能力有关。Cheng Changyong等[25]研究发现单增李斯特菌在乙酸和乳酸存在下,在细胞外pH 4.5下维持pHi的能力受到损害,但在盐酸和柠檬酸处理组中没有影响,与本实验结果相似。不同有机酸处理对沙门氏菌pHi的影响存在差异。pH 6.0的L-乳酸处理组沙门氏菌pHi显著高于醋酸和乙酰丙酸处理的pHi(P<0.05);而在pH 5.4时,沙门氏菌的pHi有机酸处理组之间无显著性差异。
不同的胞外pH值对其pHi的影响有一定差异,pH 5.4条件下细菌更易维持pHi稳定,其中盐酸和乙酰丙酸处理组的细菌pHi差异显著(P<0.05)。同时pH 5.4时其耐酸能力较强,这说明在弱酸压力条件下细菌pHi的稳定能力与其酸诱导产生的耐强酸能力成正比,与ATR结果相一致。有研究指出蜡样芽孢杆菌在低pH值的生长过程中能够产生ATR,这种适应性依赖于pHi稳态,并且在谷氨酸、精氨酸和赖氨酸存在下增强[26]。张群等[27]研究发现琥珀酸放线杆菌在pH 4.7和pH 4.5时,pHi升高;而pH值大于5.2时,pHi降低,该研究表明这是由于细胞膜受到损伤使其通透性增大,pHi受到缓冲液影响的结果。另外,两株不同血清型的沙门氏菌在有机酸处理下pHi存在一定差异,其中乙酰丙酸处理组两株沙门氏菌的pHi均差异显著(P<0.05)。该结果与Cheng Changyong等[25]报道的结果一致,他测定了不同酸环境下不同血清型单增李斯特菌的pHi变化,发现不同血清型单增李斯特菌维持pHi稳定的能力存在差异。本研究表明细胞外部pH值和有机酸环境共同决定了pHi的稳定性,在有机酸存在的弱酸培养条件中,S. typhimurium胞内pH值的波动较小。结合ATR结果发现在pH值为5.4和6.0的诱导条件中两株沙门氏菌均产生显著的ATR,细菌维持pHi稳态的能力与其在酸性条件下的生长和存活状况有关。在一定细胞外pH值下有机酸处理对pHi的影响也是沙门氏菌产生ATR的重要因素。

图3 鼠伤寒沙门氏菌在BHI培养基中生长至稳定期pHi标准曲线Fig. 3 Standard curve of fluorescent intensity ratio versus intracellular pH of stationary phase S. typhimurium cultured in BHI medium

图4 德尔卑沙门氏菌在BHI培养基中生长至稳定期pHi标准曲线Fig. 4 Standard curve of fluorescent intensity ratio versus intracellular pH of stationary phase S. Derby cultured in BHI medium

表4 两株沙门氏菌在不同培养条件中生长至稳定期pHiTable 4 Intracellular pH of stationary phase Salmonella cultured in different media
3 讨 论
研究发现乙酰丙酸杀菌效果最好,同时其产生耐酸性能力弱,是一种理想的杀菌剂。在酸适应和酸激过程中,不同因素的相互作用对ATR有很大的影响且不同血清型的沙门氏菌ATR差异显著(P<0.05)。沙门氏菌在极端酸性环境中存活的能力可根据先前的生长条件而发生显著变化。pH 6.0的环境显著降低了细菌的耐酸性(P<0.05),而耐酸性的产生伴随着pHi的变化,在一定细胞外pH值下有机酸处理对pHi的影响也是沙门氏菌产生ATR的重要因素。其中涉及到多种机制的协同作用还有待进一步探究。
沙门氏菌对pH 5.4和pH 6.0的适应性强调了在食品加工中利用有机酸杀菌时适当监测pH值变化的重要性。另外,有机酸和低温[28]、乙醇[29]、高压[30]等的联合处理也被证明是一种良好的选择。因此在食品加工过程中采用联合杀菌可作为防止该病原微生物生长和存活的一种策略。

