滁菊的功能成分及其体外抗氧化活性
贾雨朦,陈芹芹,毕金峰,吕 莹,乔叶宁,张佰清
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.中国农业科学院农产品加工研究所,农业农村部农产品加工综合性重点实验室,北京 100193)
菊花为菊科植物菊花(Chrysanthemum morifolium Ramat)的干燥头状花序,具有疏风、清热、明目、解毒的功效,在我国种植广泛,有3 000 年的栽种历史[1]。按产地可将菊花分为“杭菊”、“贡菊”、“怀菊”、“滁菊”、“毫菊”等品种[2]。其中,滁菊产于安徽滁州地区,为当地特色植物资源,又名“甘菊”、“白菊”等,是中国“四大名菊”之一,其性微寒,具有平肝、明目及疏风散热等功效,为我国卫生部批准的药食同源植物[3]。
在多种菊花品种中,滁菊效用较优。《中药志》所述“主产于安徽滁县,品质最佳”;《现代实用中药》同样评价“滁州产者菊花味最清凉,不苦不甜,白菊中以此为最良,且不湿不燥,故处方中常以滁菊代替其他菊花,而其他菊花不能代替滁菊”[4]。同时,现代研究也表明,滁菊含有酚酸类、黄酮类、萜类和多糖[5]等物质,具有抗氧化、抗衰老[6]、预防高血糖、改善缺血心肌的血液供应[5]、抗肿瘤等作用[6]。
氧化过程对许多生物体是来说必不可少的,氧化反应可以产生代谢所需的能量,然而,氧自由基的过度产生会诱发诸多疾病,例如癌症、类风湿性关节炎、心血管疾病、糖尿病以及与衰老相关的退行性过程[7]。过去20 年来,有很多关于活性氧及自由基在细胞损伤和与衰老过程相关的疾病中起重要作用的报道[8]。研究证明,含有抗氧化活性物质(如酚类、维生素、类胡萝卜素和黄酮类)的食物可以帮助人体减少氧化损伤[9]。近年来,具有抗氧化能力的食物作为可以保护人体健康的天然抗氧化剂,受到大众越来越多的关注,因此对食物含有的抗氧化活性物质及抗氧化能力进行检测和鉴定具有重要意义。
目前对于滁菊的研究主要集中在产品加工[10]、成分提取和鉴定[11]及种质特征分析[12]上,对滁菊的功能性成分及其效用的研究较少,特别是对类胡萝卜素类物质。Kishimoto等[13]对菊花中类胡萝卜素的含量和种类进行了鉴定,Ullas等[14]对部分菊花品种的类胡萝卜素类物质及其抗氧化能力进行了分析测定,但目前对于滁菊中类胡萝卜素类物质的种类及功能尚鲜见报道。本研究对滁菊中类胡萝卜素的含量、单体组成及其抗氧化能力进行分析,并对滁菊中含有的其他具有抗氧化能力的物质如多糖、多酚、黄酮等生物活性物质的含量、单体组成和对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)和2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基的清除能力、对Fe3+的还原能力进行测定和比较,以期明确滁菊中各抗氧化物质单体在不考虑协同作用情况下对其总抗氧化能力的贡献,为今后对滁菊抗氧化功能的进一步研究及其作为天然抗氧化剂的进一步开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
滁菊 安徽滁州全椒县卧龙湖有机农业园。
芦丁标准品、没食子酸标准品、β-胡萝卜素标准品、绿原酸标准品 上海源叶生物科技有限公司;葡萄糖标准品、亚硝酸钠、无水碳酸钠、氯化钠、硫酸、苯酚、丙酮、无水乙醇 国药集团化学试剂有限公司;DPPH、ABTS、2,4,6-三吡啶基均三嗪、水溶性VE(Trolox)、α-胡萝卜素标准品、叶黄素标准品、隐黄素标准品、福林-酚试剂、九水合硝酸铝 美国西格玛奥德里奇贸易有限公司;氢氧化钠 上海阿拉丁生化科技股份有限公司;甲醇、正己烷、甲基叔丁基醚(色谱级) 美国赛默飞世尔科技公司。
1.2 仪器与设备
离心机 艾本德中国有限公司;RE52AA旋转蒸发器 上海亚荣生化仪器厂;DK-S26电热恒温水浴锅、DHG-9023A鼓风干燥箱 上海精宏实验设备有限公司;UV1800紫外分光光度计 日本岛津公司;1525高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Waters公司。
1.3 方法
1.3.1 滁菊样品的制备
将滁菊置于粉碎机中22 000 r/min粉碎1 min,粉碎后将滁菊粉放置于自封袋中,密闭封口,常温下放置在干燥器中保存。经测定粉碎后滁菊粉湿基水分质量分数为11.03%。
1.3.2 滁菊酚类提取液的制备
采用Istrati等[15]的方法提取酚类物质,稍作修改。精确称取粉碎后的滁菊样品2.00 g于具塞试管中,加入10.0 mL 80%(体积分数,下同)甲醇溶液,超声提取30 min(40 kHz、25 ℃),经10 000 r/min离心10 min后取上清液,重复3 次,合并上清液,于-20 ℃下保存备用,用于总酚、黄酮含量及酚类物质抗氧化能力测定。
1.3.3 抗氧化能力的测定
1.3.3.1 DPPH自由基清除能力测定
参照Wang Yongtao等[16]的方法并略作修改。取2.0 mL不同浓度的Trolox溶液(0、20、30、40、60、80、100 μmol/L,80%甲醇溶解)于10 mL试管中,加入4.0 mL 0.1 mol/L DPPH溶液(80%甲醇溶解),避光静置30 min,于517 nm波长处测定吸光度。以Trolox浓度为横坐标,吸光度为纵坐标绘制标准曲线,曲线方程为y=0.007 4x+0.641 3,R2=0.998 9。取0.05 mL提取液,用80%甲醇稀释至2 mL,按上述步骤操作并测定吸光度,代入标准曲线方程,结果以每克干物质中Trolox的物质的量表示。
1.3.3.2 Fe3+还原能力的测定
参照Tabart等[17]的方法并略作修改。取0.20 mL不同浓度的Trolox溶液(0、100、200、300、400、500、600、700、800 μmol/L,80%甲醇溶解)于10 mL试管中,加入6.0 mL Fe3+还原能力试剂,混匀,37 ℃水浴30 min,冷却至常温后于593 nm波长处测定吸光度。以Trolox浓度为横坐标,吸光度为纵坐标绘制标准曲线,曲线方程为y=0.001 3x-0.094 2,R2=0.999 1。取0.10 mL提取液,用80%甲醇稀释至0.20 mL,按上述步骤操作并测定吸光度,代入标准曲线方程,结果以每克干物质中Trolox的物质的量表示。
1.3.3.3 ABTS阳离子自由基清除能力
参照Jeong等[18]的方法并略作修改。将7.0 mmol/L ABTS溶液加入2.45 mmol/L过硫酸钾溶液中(体积比1∶1),避光静置12~14 h(室温)后,用80%甲醇将溶液稀释至734 nm波长处吸光度为0.700±0.020。取0.40 mL不同浓度的Trolox溶液(0、25、50、75、100、125、150 μmol/L,80%甲醇溶解)于10 mL试管中,加入3.6 mL ABTS溶液,混匀,静置1 min(室温),于734 nm波长处测定吸光度。以Trolox浓度为横坐标,吸光度为纵坐标绘制标准曲线,曲线方程为y=-0.003 0x+0.612 4,R2=0.999 1。吸取0.10 mL提取液,用80%甲醇稀释至0.40 mL,按上述步骤操作并测定吸光度,代入标准曲线方程,结果以每克干物质中Trolox的物质的量表示。
1.3.3.4 滁菊不同提取物中单一成分对总抗氧化能力贡献的计算
按照式(1)计算不同提取物中单一成分对滁菊总抗氧化能力的贡献[19]。
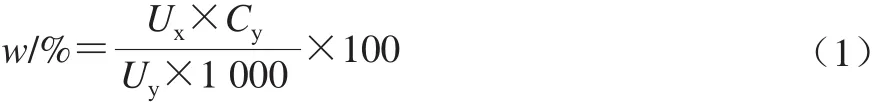
式中:w为某提取物抗氧化能力贡献;Ux为某单体抗氧化能力/(μmol/g);Cy为某单体含量/(μg/g);Uy为某提取物总抗氧化能力/(μmol/g)。
1.3.4 总酚含量测定
采用福林-酚比色法[20]进行总酚含量测定,使用没食子酸作为标准品,以80%甲醇为空白,绘制标准曲线,曲线方程为y=0.093 5x+0.014 2,R2=0.997。取0.2 mL提取液,用80%甲醇定容至2.0 mL,加1.0 mL质量分数10%福林-酚显色剂,充分摇匀,6 min之后加入2.0 mL 7.5 g/L Na2O3溶液,混匀定容至10.0 mL,75 ℃放置10 min,冷却至常温后于765 nm波长处测定其吸光度。总酚含量以每克干物质中没食子酸的质量表示。
1.3.5 黄酮含量的测定
根据Sun Lijun等[21]的方法测定黄酮含量,并稍作修改。以芦丁作为标准品,结果以每克干物质中芦丁的质量表示。准确称取芦丁标准品5.00 mg于25 mL容量瓶中,80%甲醇溶解定容,得到质量浓度为0.20 mg/mL的标准品溶液。精确移取芦丁标准品溶液0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mL于15 mL比色管中,加80%甲醇定容至4.0 mL,再加入质量分数5%亚硝酸钠0.5 mL,摇匀,放置6 min;加质量分数10%硝酸铝0.5 mL,摇匀,放置6 min;加质量分数4%氢氧化钠4.0 mL,定容至10.0 mL,摇匀,放置15 min,以不加样品组为空白。于510 nm波长处测定吸光度,并以芦丁的质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,曲线方程为y=0.013 2x+0.031 3,R2=0.999。取0.2 mL提取液,按上述步骤操作并测定吸光度,代入标准曲线计算黄酮含量。
1.3.6 总类胡萝卜素含量的测定
根据Knockaert[22]的方法测定总类胡萝卜素含量。取2.00 g滁菊粉加40.0 mL混合液(含质量分数50%正己烷、25%丙酮、25%乙醇、0.1% 2,6-二叔丁基-4-甲基苯酚(2,6-di-tert-butyl-4-methylphenol,BHT)、0.5 g NaCl),常温下搅拌30 min,之后加入15.0 mL蒸馏水,常温下搅拌10 min,搅拌结束将混合物倒入分液漏斗,振荡3 次,静置,待液体分为清晰的两层后收集上层有机相。空白组为加入BHT(0.10 g/100 mL)并充分溶解后的正己烷,450 nm波长处测定吸光度,按照公式(2)计算滁菊总类胡萝卜素含量。
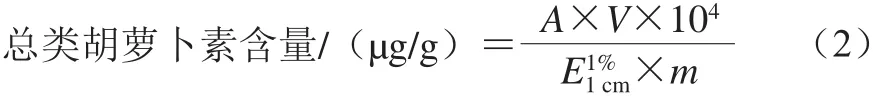
式中:A为滁菊在450 nm波长处的吸光度;m为称取的原料质量/g;V为收集的有机相体积/mL;为β-胡萝卜素在正己烷中的摩尔消光系数(2 560 L/(mol·cm))。
1.3.7 多糖含量的测定
采用Zhao Qingsheng[23]和Wang[24]等的方法进行多糖提取,并稍作修改。精确称取粉碎后的滁菊样品2.00 g,加30.0 mL蒸馏水,置于90 ℃的恒温水浴锅中水浴1 h,水浴结束后超声提取1 h(40 kHz、25 ℃)。抽滤取滤液,旋转蒸发浓缩至10.0 mL,加无水乙醇至溶液乙醇体积分数为80%,4 ℃下醇沉24 h,醇沉结束后抽滤取沉淀,合并沉淀加蒸馏水溶解并定容至100.0 mL。
吸取葡萄糖标准品0.2、0.4、0.6、0.8、1.0、1.2 mL于15 mL试管中,加水至2.0 mL,加入1.0 mL质量分数5%苯酚溶液,混合均匀,迅速加入5.0 mL质量分数95%硫酸溶液,摇匀,室温放置10 min后沸水浴15 min,取出后迅速冷却至室温,以蒸馏水代替葡萄糖溶液作为空白。以葡萄糖质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,曲线方程为y=0.060 8x+0.001 1,R2=0.999。取多糖提取液1.0 mL,蒸馏水稀释至2.0 mL,按上述步骤操作并测定吸光度,代入标准曲线方程,滁菊多糖含量以葡萄糖计。
1.3.8 抗氧化成分单体组成的测定
1.3.8.1 单体酚组成的测定
称取2.00 g滁菊粉于带盖离心管中,加入10 mL 80%甲醇,室温避光超声提取30 min(40 kHz、25 ℃),经10 000 r/min离心10 min后,取上清液,重复3 次,合并上清液,于旋转蒸发仪30 ℃下蒸至近干,用甲醇(色谱级)溶解残渣并定容至10.0 mL,测定前过0.45 μm滤膜。
选用C18色谱柱(250 mm×4.6 mm,5 µm),流动相A为体积分数2%乙酸溶液,流动相B为甲醇,梯度洗脱[25],流速1 mL/min,柱温40 ℃,进样量10 μL,检测波长280 nm。洗脱程序为:0~20 min,95%~75% A;20~35 min,75%~60% A;35~40 min,60% A;40~45 min,60%~5% A;45~50 min,5% A;50~52 min,5%~95% A;52~55 min,95% A。
1.3.8.2 类胡萝卜素单体组成的测定
类胡萝卜素的提取同1.3.5节方法,测定前过0.45 μm有机滤膜。采用HPLC法测定类胡萝卜素单体组成,选用反相C30色谱柱(250 mm×4.6 mm,5 µm)[26],流动相A为V(甲醇)∶V(甲基叔丁基醚)∶V(水)=81∶15∶4,流动相B为V(甲醇)∶V(甲基叔丁基醚):V(水)=6∶90∶4,采用100%~44% A、45 min洗脱程序进行梯度洗脱,流速1 mL/min,柱温30 ℃,进样量10 μL,检测波长450 nm。
1.4 数据统计与分析
实验均进行3 次平行,采用Excel 2013软件处理数据,显著性分析采用Duncan's多范围检验方法,P<0.05表示差异显著;采用Origin 9.0软件作图。
2 结果与分析
2.1 滁菊总酚、黄酮、多糖及类胡萝卜素含量
滁菊的总酚含量为53.67 mg/g,是蓝莓全果的5~11 倍[27],黑莓全果的5.5 倍[28];黄酮含量为70.32 mg/g,比黄菊高24%,比大洋菊高66%~79%[29],是蓝莓的1.9 倍、黑莓的5.9 倍[28];多糖含量为7.68 mg/g,为枣的1/10[30];类胡萝卜素含量为112.36 μg/g,为枸杞的1/12[31]。由此可知,滁菊的酚类物质含量较多,且高于普遍被认为酚类含量较高的蓝莓、黑莓等小浆果食物,黄酮含量也远高于其他品种菊花,多糖含量和类胡萝卜素含量相比于这两种物质含量较高的枣和枸杞并不突出。
2.2 滁菊酚类、多糖及类胡萝卜素的抗氧化能力分析
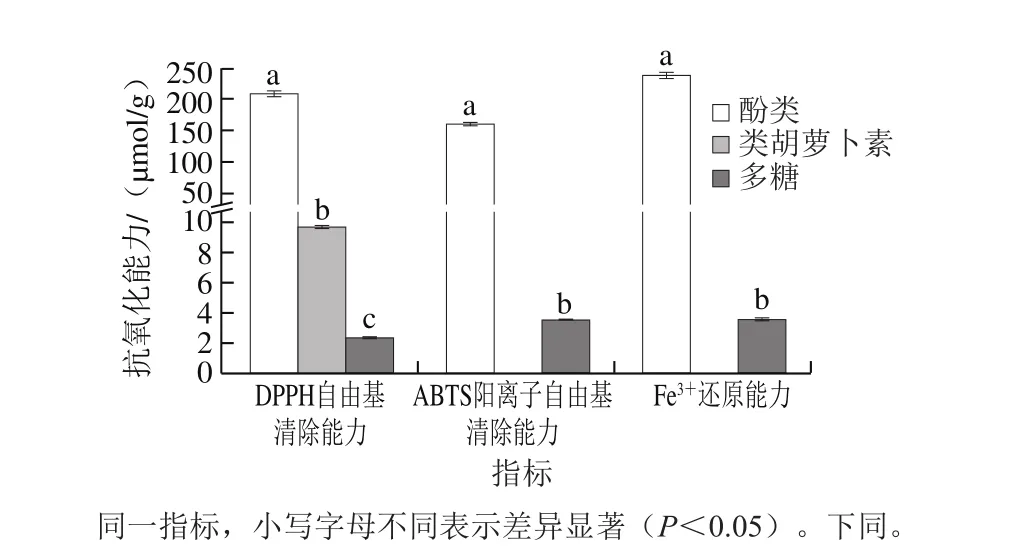
图1 滁菊各提取物抗氧化能力Fig. 1 Antioxidant activities of various extracts of chrysanthemum flowers from Chuzhou
由图1可知,滁菊酚类提取物对DPPH自由基的清除能力为208.79 μmol/g,比黄山贡菊、胎菊、洋金菊等其他几种菊花高25%~68%[2];对ABTS阳离子自由基的清除能力为160.23 μmol/g,是蓝莓的1.4 倍[28];Fe3+还原能力为238.35 μmol/g,高于杭白菊、黄金贡菊和胎菊[2]。滁菊多糖提取物对DPPH自由基和ABTS阳离子自由基的清除能力分别为2.39 μmol/g和3.55 μmol/g,Fe3+还原能力为3.58 μmol/g;滁菊类胡萝卜素提取物对DPPH自由基的清除能力为9.77 μmol/g,均远低于酚类提取物。由此可知,滁菊的抗氧化能力要高于普遍被认为抗氧化能力较强的小浆果食物,且滁菊的抗氧化能力要高于其他品种菊花,说明滁菊为菊花中的优质品种,是一种优质的天然抗氧化剂。
从对滁菊酚类、多糖和类胡萝卜素提取物抗氧化能力之间的比较可以发现,其酚类物质的抗氧化能力远高于多糖和类胡萝卜素类物质。根据熊磊等[32]的研究可知,滁菊多糖在0.2~1.0 mg/mL的高质量浓度下具有较好的抗氧化活性,其质量浓度为1.0 mg/mL时对自由基的清除率高于0.2 mg/mL抗坏血酸;根据张成孜[33]的研究结果可知,滁菊多糖能够提高血清和肝脏中超氧化物歧化酶、谷胱甘肽过氧化物酶活性,并降低丙二醛含量,说明滁菊能提高机体抗氧化能力,并抑制脂质过氧化反应。本研究中滁菊多糖抗氧化能力较低,可能是因为其质量浓度较低(0.07 mg/mL),导致其清除自由基能力较差;也可能是因为滁菊多糖的抗氧化活性更多体现在对超氧化物歧化酶等的作用,而不是自由基的清除能力。
类胡萝卜素类提取物对于DPPH自由基的清除能力虽然比多糖提取物高,但也远低于酚类提取物,这可能是因为滁菊中类胡萝卜素含量较低,且类胡萝卜素在结合状态没有抗氧化能力[31]。由以上结果可推断,滁菊的抗氧化能力可能更多地归因于其所含有的酚类物质。
2.3 滁菊酚类及类胡萝卜素单体组分的鉴定结果
2.3.1 滁菊酚类物质单体组分及含量分析

图2 酚类标准品HPLC图谱Fig. 2 HPLC chromatogram of mixed phenol standards
去除溶剂峰后单体酚标准品HPLC测定结果如图2所示。对单体酚标准品进行测定,可得出15 种标准品保留时间及其峰面积的关系,以标准品峰面积为横坐标,标准品含量为纵坐标绘制出标准曲线,曲线方程的R2均大于0.97。

图3 滁菊酚类提取液HPLC图谱Fig. 3 HPLC chromatogram of phenolic extract of chrysanthemum flowers from Chuzhou
由图3可见,与标准品图谱相比较,同等测定条件下可鉴定出滁菊含有儿茶素、绿原酸、咖啡酸、阿魏酸、金丝桃苷和槲皮素6 种酚类。谢越等[34]利用HPLC法同样在滁菊中检测出了阿魏酸、槲皮素等酚类物质;舒俊生等[35]在95%乙醇提取的滁菊提取液中检测出了绿原酸、咖啡酸、槲皮素等酚类物质,与本实验结果具有一致性。由图4可知,6 种酚类物质中,绿原酸、金丝桃苷含量较高,分别达到了813.21 μg/g和408.17 μg/g,咖啡酸、阿魏酸和槲皮素含量较低,仅分别有32.39、45.76、56.49 μg/g。

图4 滁菊单体酚物质含量Fig. 4 Contents of monophenols in chrysanthemum flowers from Chuzhou
2.3.2 滁菊类胡萝卜素单体组分及含量分析

图5 类胡萝卜素标准品HPLC图谱Fig. 5 HPLC chromatogram of mixed carotenoid standards

图6 滁菊类胡萝卜素提取物HPLC图谱Fig. 6 HPLC chromatogram of carotenoid extract of chrysanthemum flowers from Chuzhou
对类胡萝卜素单体标准品进行测定后可得峰面积与标准品浓度的标准曲线,曲线方程的R2均大于0.97。图5为类胡萝卜素标准品在450 nm波长处的HPLC图。图6为滁菊类胡萝卜素提取物在450 nm波长处的HPLC图,与标准品图谱相比较,可以确定滁菊含有的类胡萝卜素单体为叶黄素和β-类胡萝卜素。从图7可知,这3 种类胡萝卜素单体中,叶黄素含量较高,达到了78.6 μg/g;β-类胡萝卜素含量较低,为6.4 μg/g,说明叶黄素是滁菊含有的主要类胡萝卜素单体。
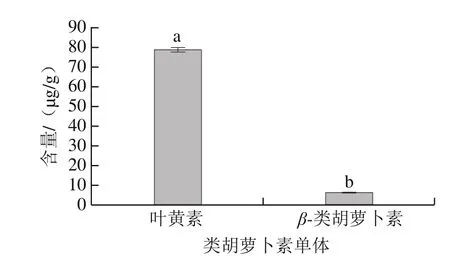
图7 滁菊类胡萝卜素单体物质含量Fig. 7 Types and contents of carotenoid monomers in chrysanthemum flowers from Chuzhou
2.4 单体抗氧化能力及其对总抗氧化能力的贡献
由2.1节分析可知,在滁菊中具有抗氧化能力的物质中,酚类的抗氧化能力最强,总类胡萝卜素次之,但具体哪种酚类单体、类胡萝卜素单体在不考虑协同作用的情况下对酚类及总类胡萝卜素抗氧化能力的贡献最大尚不得而知,故用各单体标准品进行抗氧化能力测定。鉴于各成分之间的协同作用机理较为复杂[36],抗氧化能力贡献的计算仅考虑各单体单独作用情况。
2.4.1 单体酚抗氧化能力及贡献
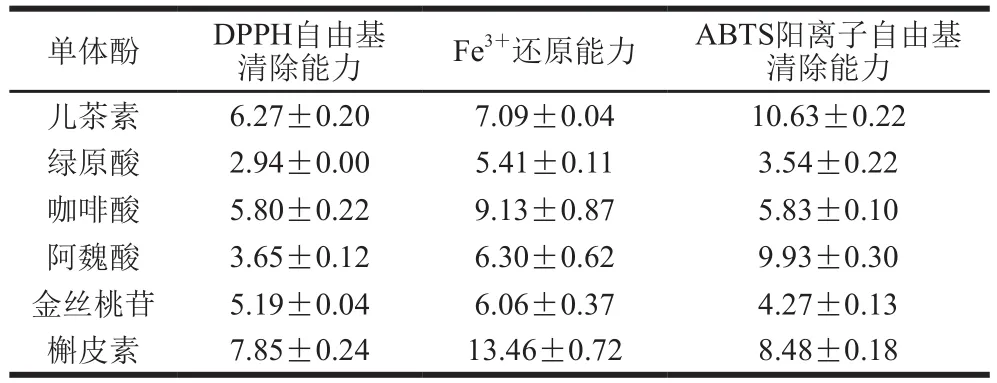
表1 滁菊单体酚抗氧化能力Table 1 Antioxidant activities of monophenols in chrysanthemum flowers from Chuzhou μmol/mg
由表1可知,不同单体酚的抗氧化能力之间差异较大,槲皮素的抗氧化能力最强,儿茶素次之,这说明并不是所有酚类都具有较强的抗氧化活性,部分酚类物质的抗氧化活性较弱,这可能是因为各单体酚在结构上有所差异[37],同时酚类的抗氧化能力和羟基数目也有很大关系。但在抗氧化能力贡献方面(表2),绿原酸的抗氧化能力贡献最大,咖啡酸、阿魏酸较小,这可能是因为绿原酸在滁菊中含量较高且抗氧化能力较强,咖啡酸和阿魏酸虽有较强抗氧化能力,但含量低,故对酚类总抗氧化能力贡献也较低,所以各单体酚的抗氧化能力贡献在不考虑协同作用情况下既与其含量有关,也与其抗氧化能力有关。

表2 滁菊单体酚抗氧化能力贡献Table 2 Contribution rates of monophenols in chrysanthemum flowers from Chuzhou to antioxidant capacity%
由表2可知,各单体酚抗氧化能力贡献总和小于100%,可能是因为提取过程中酚类物质有损失,且使用的提取物虽然主要成分为酚类,但仍有氨基酸和蛋白质等物质存在;也可能因为该测定方法不能测定滁菊含有的全部酚类物质,如舒俊生等[35]在滁菊中发现了芹黄素及其糖苷类物质;同时,不同的酚类物质在共存的情况下可能存在协同作用[38],所以该结果也可能是因为酚类的抗氧化能力主要归因于其各单体酚之间的协同作用,这还需进一步研究。
2.4.2 类胡萝卜素单体抗氧化能力及贡献

表3 滁菊类胡萝卜素单体抗氧化能力及贡献Table 3 Antioxidant capacity and contribution rates of monomeric carotenoids in chrysanthemum flowers from Chuzhou
由表3可知,叶黄素的DPPH自由基清除能力最高,达到4.84 μmol/mg,其抗氧化能力贡献最高;β-类胡萝卜素的DPPH自由基清除能力较低,且其含量远低于叶黄素,故其抗氧化能力贡献仅为0.23%,远低于叶黄素的3.89%。与单体酚相同,在仅考虑单体单独作用的情况下,类胡萝卜素单体的抗氧化能力贡献之和小于100%,这可能是因为类胡萝卜素单体之间[39]、类胡萝卜素与其他成分之间[36]存在协同作用,这还需要进一步的研究。
3 结 论
本实验对滁菊含有的各类具有抗氧化活性的物质进行了测定和分析,结果表明,滁菊的多酚、黄酮类物质含量分别为53.67 mg/g和70.32 mg/g,高于其他品种菊花和小浆果食物,但多糖和类胡萝卜素类物质的含量较低。滁菊的酚类物质抗氧化能力最高,远高于类胡萝卜素和多糖物质,且高于杭白菊等多种菊花。通过HPLC法对滁菊的酚单体组分进行测定,可确定滁菊含有儿茶素、绿原酸、咖啡酸、阿魏酸、金丝桃苷、槲皮素6 种酚类物质,其中绿原酸含量最高。在不考虑协同作用的情况下,绿原酸对酚类Fe3+还原能力、DPPH自由基及ABTS阳离子自由基清除能力的贡献最大,金丝桃苷次之。对滁菊的类胡萝卜素单体进行分析,发现其含有叶黄素和β-类胡萝卜素2 种类胡萝卜素单体,其中叶黄素含量最高,在仅考虑单独作用情况下其对DPPH自由基的清除能力贡献最大。实验结果表明,滁菊是一类具有良好抗氧化能力的天然抗氧化剂,但目前市面上滁菊产品较少,加工较为简陋,使珍贵的资源未能完全开发利用,造成较大的浪费。作为一种药食同源食物,滁菊可以被加工为功能饮料、果蔬复合粉配料,或者作为粥产品、面制品和乳制品等的添加剂,也可以直接作为酚类和类胡萝卜素类等具有抗氧化能力物质的提取原料以制备抗氧化保健品,具有广阔的开发利用空间和巨大的市场潜力。对其进行充分利用不仅可以减少资源浪费,还可以丰富市场中菊花产品的种类,提高农民的经济收益。

