新辅助食管癌手术前后机体营养状况变化研究
李国雨,何 明,李国庆
食管癌是全球第六大常见的恶性肿瘤,在癌症死亡当中排名第四。我国为食管癌高发区,发病率和死亡率均居世界第一位[1],每年因食管癌死亡的人数达40万以上。目前食管癌的治疗以手术为基石的多学科综合治疗为主,对于进展期食管癌,手术治疗的5 a生存率仅为30%~40%[2]。新辅助治疗近些年来在局部进展期食管癌的治疗中迅速开展起来。随机研究表明,新辅助治疗联合手术的综合治疗模式临床效果较为肯定,新辅助治疗与根治性手术切除相结合,可提高R0切除率[3],一定程度上改善预后,但新辅助治疗手术前后患者营养状态变化仍需进一步探索。本研究就新辅助治疗后患者在进行手术治疗前后机体营养状况变化进行探讨,为临床新辅助患者拟行手术治疗前增强其营养状况提供理论依据。
1 对象和方法
1.1 研究对象选择2017年5月1日至2019年5月31日于河北医科大学第四医院胸五科住院治疗的食管癌患者,通过电子病历系统收集患者的临床病历资料。入选标准:①年龄≥18岁;②病理证实为食管癌且术前均接受过新辅助治疗;③接受过手术治疗;④未同时或既往患有其他恶性肿瘤病史;⑤有完整的术前实验室检查信息。排除标准:①年龄<18岁的患者;②病理未证实为食管癌或术前未接受过新辅助治疗的患者;③未接受过手术治疗的患者;④同时或既往患有其他恶性肿瘤病史的患者;⑤资料不完整的患者。
1.2 研究方法研究采用人体测量、营养生化检查、查阅病历等方法进行资料收集。
1.2.1 一般资料包括入院日期、入院诊断、病历号、性别、年龄、新辅助方案(术前辅助放疗;术前辅助化疗;术前辅助放化疗)、肿瘤位置、手术时间、手术方式。
1.2.2 生化测定包括血清前白蛋白(PA)、血清白蛋白(ALB)、总蛋白(TP)、球蛋白(GLOB)、血红蛋白(HGB)、淋巴细胞总数(TLC)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、肌酐(Cr)、尿素氮(UN)。
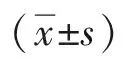
2 结果
2.1 研究人群特征描述按照研究的纳入排除标准,对目标人群进行整理和筛选,共收集142例新辅助食管癌患者,排除未做手术的9例,最终入组133例。患者的一般基线特征见表1-2所示。
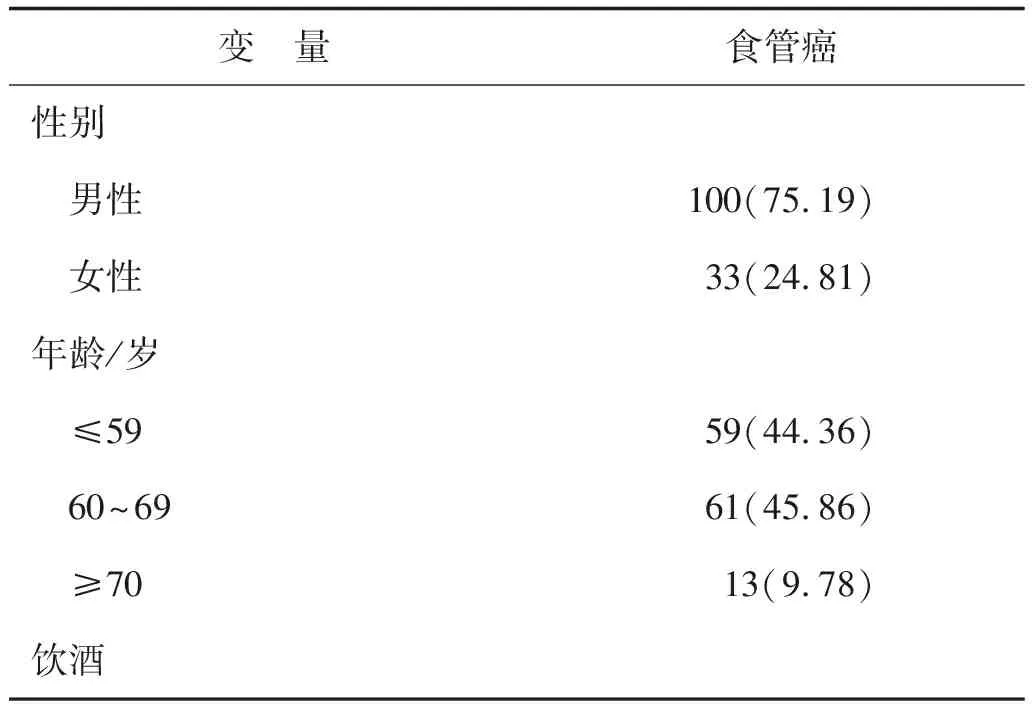
表1 新辅助治疗后手术治疗的食管癌患者的分类变量基线特征(n=133) 例(%)
续表
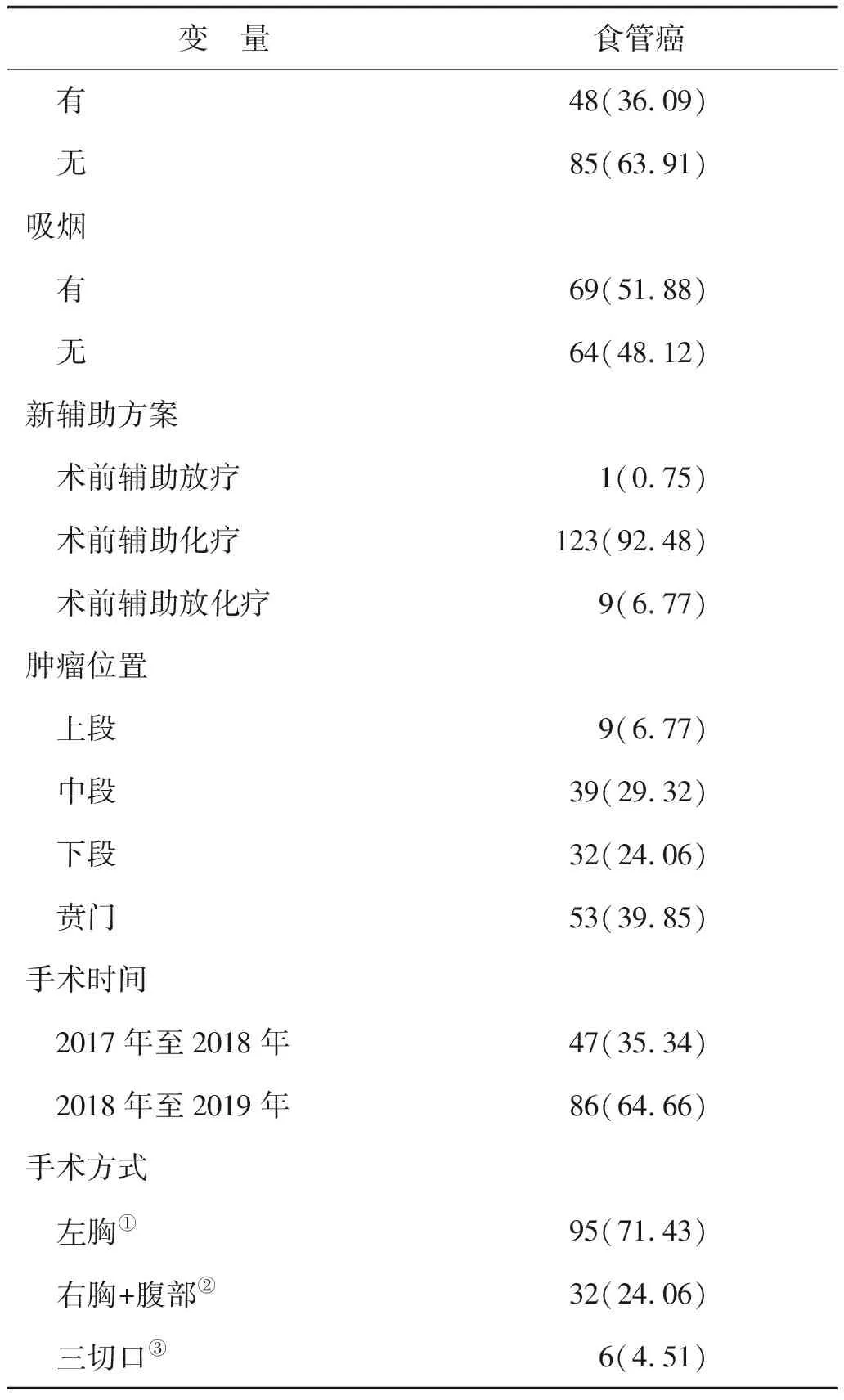
变 量食管癌 有48(36.09) 无85(63.91)吸烟 有69(51.88) 无64(48.12)新辅助方案 术前辅助放疗1(0.75) 术前辅助化疗123(92.48) 术前辅助放化疗9(6.77)肿瘤位置 上段9(6.77) 中段39(29.32) 下段32(24.06) 贲门53(39.85)手术时间 2017年至2018年47(35.34) 2018年至2019年86(64.66)手术方式 左胸①95(71.43) 右胸+腹部②32(24.06) 三切口③6(4.51)
注:①Sweet术式;②Ivor-Lewis术式;③Mckeown术式。
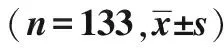
表2 新辅助治疗后手术治疗的食管癌患者的连续变量基线特征
2.2 手术治疗对新辅助食管癌患者的营养状态的影响133例新辅助治疗食管癌患者行手术治疗。与手术治疗前比较,患者手术治疗后相应指标变化见表3-4。其中ALB、PA、TP、HGB、GLOB、TLC水平均明显降低,差异有统计学意义(均P<0.05)。

表3 新辅助治疗食管癌患者手术治疗前后测量指标变化比较 例(%)

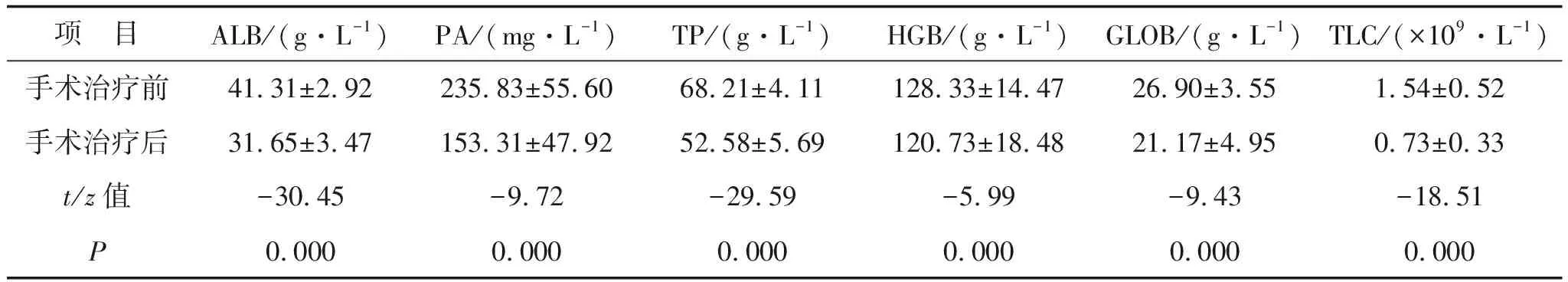
项 目ALB/(g·L-1)PA/(mg·L-1)TP/(g·L-1)HGB/(g·L-1)GLOB/(g·L-1)TLC/(×109·L-1)手术治疗前41.31±2.92235.83±55.6068.21±4.11128.33±14.4726.90±3.551.54±0.52手术治疗后31.65±3.47153.31±47.9252.58±5.69120.73±18.4821.17±4.950.73±0.33t/z值-30.45-9.72-29.59-5.99-9.43-18.51P0.0000.0000.0000.0000.0000.000
2.3 手术治疗对新辅助治疗后食管癌患者的肝肾功能的影响133例患者接受新辅助治疗后行手术治疗。与手术治疗前比较,患者手术治疗后ALT、AST水平均明显增加,差异有统计学意义(均P<0.05);Cr、UN水平均略有增加,但差异无统计学意义(均P>0.05)。见表5。

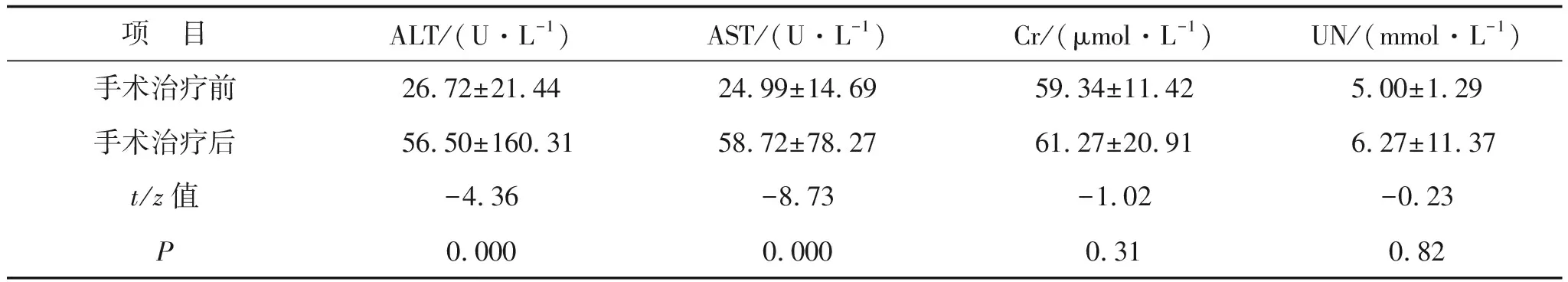
项 目ALT/(U·L-1)AST/(U·L-1)Cr/(μmol·L-1)UN/(mmol·L-1)手术治疗前26.72±21.4424.99±14.6959.34±11.425.00±1.29手术治疗后56.50±160.3158.72±78.2761.27±20.916.27±11.37t/z值-4.36-8.73-1.02-0.23P0.0000.0000.310.82
3 讨论
恶性肿瘤相关的营养不良是临床常见问题。美国癌症中心的营养专家指出,大约40%的肿瘤患者死亡归咎于营养不良,而并非是肿瘤本身[4]。严重的营养不良可影响肿瘤患者的手术治疗及其临床结局。尽管如此,存在营养风险或营养不良的肿瘤患者中仅有30%~60%接受营养干预,还有很大比例未得到及时有效的营养干预[5]。食管癌的营养不良发生率居所有恶性肿瘤第一位,达60%~85%[6]。有文献报道新辅助治疗降低了食管癌患者的生活质量[7]。
食管癌在我国发病率很高,是临床上常见的恶性肿瘤,既往常规治疗方案是手术切除联合术后放化疗,但总体疗效欠佳。近些年来新辅助治疗迅速开展起来,其有利于肿瘤降期、消灭全身微小转移灶,对于可手术切除的食管下段及胃食管结合部腺癌患者,新辅助化疗能够提高5 a生存率,而不增加术后并发症和治疗相关死亡率[6]。然而新辅助治疗后实施手术患者的营养状况变化仍需进一步研究。手术对于食管癌患者来说是非常大的打击,近年来加速康复外科理念越来越受到重视,胸腹腔镜微创手术在食管癌患者治疗中快速发展起来。相较于传统开胸手术,对胸段食管癌行胸腹腔镜微创切除手术患者在围术期实施加速康复措施干预,可减轻术后疼痛、降低术后并发症、缩短住院时间,但是胸腹腔镜微创切除手术对于患者来说创伤也是巨大的[8]。手术是目前治疗食管癌的主要方法, 但创伤大、出血量多,加之术后并发症等,以及老年患者机体功能减弱, 所以无论是传统开放式手术还是胸腔镜手术都会严重降低患者的营养状况[9],本研究表明新辅助治疗后,手术治疗显著降低患者的前白蛋白、白蛋白、总蛋白、淋巴细胞计数及血红蛋白水平,患者的肝功能也严重受到手术的影响。研究发现, 由于食管癌多发于老年群体, 其器官功能衰弱, 且营养摄入量相对较少, 免疫系统呈抑制状态, 而手术的应激性, 进一步加重了免疫抑制[10],所以无论是接受新辅助治疗的患者还是未经任何治疗的患者在接受手术治疗后,患者的营养状况都会受到严重的影响。食管癌患者围手术期营养不良是影响预后的重要因素之一。建议为食管癌患者制定最佳的营养干预措施,以防止手术前后营养不良[11]。还有文献报道食管癌患者在食管癌切除术前接受新辅助治疗时应给予额外的营养干预[12]。所以新辅助治疗后行手术治疗的食管癌患者应尽量改善营养状况。
综上所述,新辅助治疗后实施手术治疗显著降低了食管癌患者的营养状况,应及时加以营养干预。

