牙龈卟啉单胞菌来源的外泌体对食管癌细胞增殖迁移作用的研究
王浩洁,史 浩,齐义军,朱梦玺,陈 攀,兰子君,,张 灏,梁高峰,,高社干,
食管癌(esophageal cancer,EC)是常见的消化道肿瘤之一,全世界每年约有57.2万人死于食管癌。中国是世界上食管癌高发地区之一,每年新增食管癌患者占全球一半以上,其中90%以上属食管鳞状细胞癌(esophageal squamous cell cancer,ESCC)[1-2]。由于早期食管癌缺乏典型症状及食管癌高危预警标志,5 a生存率较低(<25%)。研究表明:诱发食管癌的高危因素包括营养缺乏(经济贫困)、摄入霉变食物或含亚硝酸盐腌菜等因素。然而,随着经济和生活水平提高,我国食管癌的发病率依然较高,这提示其中还可能存在其它危险因素。
研究发现:约20%的恶性肿瘤与感染性因素相关,如幽门螺杆菌(Helicobacterpylori,HP)与胃癌[3]、人乳头瘤病毒(Human Papillomavirus,HPV)与宫颈癌[4]、具核梭杆菌(Fusobacteriumnucleatum)与结肠癌[5]。牙龈卟啉单胞菌(Porphyromonasgingivalis,P.gingivalis)是口腔关键致病菌之一[6],并且大量的文献报道了P.gingivalis感染与口腔癌、胰腺癌、老年痴呆等疾病的发生有一定关系[7-9]。此外,本课题组在之前也发现牙龈卟啉单胞菌感染可能是食管癌发生的一个高危因素[10-12]。还发现:ESCC组织中P.gingivalis含量明显高于癌旁组织和正常食管黏膜组织,P.gingivalis含量与ESCC分化程度、淋巴结转移和TNM分期呈正相关,与ESCC患者总体生存期呈负相关[13]。因此,P.gingivalis可能是ESCC发生发展过程中的重要参与者。然而,目前对P.gingivalis促进食管癌发生发展确切的分子机制尚不清楚。
越来越多的证据表明,肿瘤细胞来源的外泌体(exosome)被认为是肿瘤多阶段演进中的关键因素[14-15]。作为一种直径为30~150 nm的纳米级别的胞外囊泡,外泌体通过携带多种生物活性成分介导细胞间的“物质和信息的交流”[16],进而影响肿瘤进展的许多阶段,包括血管生成、侵袭转移和耐药[17-19]。因此,探究牙龈卟啉单胞菌来源的外泌体(P.gingivalis-Exo)对食管癌细胞的影响,对研究P.gingivalis促进食管癌发生发展,揭示其确切的分子机制有着十分重要的意义。本研究通过MTT、Transwell、划痕和Western blot等实验探究P.gingivalis-Exo如何通过TGF-β1/Smad2通路促进食管癌细胞增殖迁移。
1 材料和方法
1.1 材料
1.1.1 仪器超速离心机(日立CP100WX,日本);透射电镜(JEM-2100,日本电子有限公司);Zetasizer Nano(Malvern Panalytical,英国);激光共聚焦显微镜(Nikon公司,日本);全波长酶标仪(BioTek公司,美国);蛋白电泳及转膜系统(Bio-Rad公司,美国);全自动化学发光成像系统(Tanon 5200,上海天能科技有限公司);微量台式高速离心机(Beckman Coulter,美国);CO2培养箱(Thermo Fisher,美国);厌氧培养箱(COY,美国)。
1.1.2 菌株及细胞P.gingivalisATCC 33277购自美国模式生物培养库(American type culture collection,ATCC);人食管癌细胞系(KYSE-150/KYSE-30)购自中国科学院细胞库。
1.1.3 试剂Roswell Park Memorial Institute-1640培养基(RPMI-1640,Life Technologies公司,美国);胎牛血清(FBS,Gibco公司,美国);胰蛋白酶(南京维森特生物技术有限公司);荧光染料DIR、DAPI(Sigma公司,美国);四甲基偶氮唑盐(MTT,Sigma公司,美国);BCA蛋白浓度试剂盒(上海生工生物工程股份有限公司);Transwell小室(Corning公司,美国);PVDF膜(Millipore公司,美国);ECL发光液(上海天能科技有限公司);二甲基亚砜(DMSO);一抗Smad2(CST公司,美国);TGF-β1(Abcam公司,美国);GAPDH(上海生工生物工程股份有限公司)。
1.2 方法
1.2.1 细菌培养P.gingivalis菌株ATCC 33277在含5%羊血、1%氯化血红素和0.1%维生素K的GAM肉汤液体培养基中培养,放置37 ℃厌氧培养箱常规培养(85%N2、10%H2和5%CO2)。
1.2.2 细胞培养KYSE-150/KYSE-30在含有10%FBS,1%青链霉素的RPMI-1640中培养,放置于37 ℃、5%CO2的恒温细胞培养箱中常规培养。
1.2.3 外泌体提取收集P.gingivalis的培养上清液,加入50 mL离心管中,4 000×g离心30 min去除碎片。然后将上清液移入超离管中,超速离心100 000×g离心60 min,弃去上清液,最后用PBS缓冲液重悬沉淀,并用0.22 μm的针头式过滤器进行过滤,分装置于-80 ℃冰箱备用。
1.2.4 电镜鉴定P.gingivalis-Exo的结构P.gingivalis-Exo经无菌的PBS稀释后,取20 μL的P.gingivalis-Exo悬液滴加于直径2 mm载样铜网上,滤纸吸去多余液体,室温静置3 min,于铜网上滴加3%磷钨酸溶液约10 μL,负染5 min,在透射电子显微镜下观察P.gingivalis-Exo并拍照。
1.2.5 Zetasizer Nano分析P.gingivalis-Exo粒径使用Zetasizer Nano分析提取的P.gingivalis-Exo,将1 mL的P.gingivalis-Exo加入到比色皿中,上机,待其布朗运动1 min后,使用Zetasizer Nano软件进行分析后计算出纳米粒子浓度和尺寸分布。
1.2.6 细胞摄取P.gingivalis-Exo将1 μL浓度为5 mg·mL-1的DIR溶液加入到PBS重悬的P.gingivalis-Exo溶液中,37 ℃避光孵育30 min,100 000×g超速离心60 min,弃去游离的DIR染料,所得产物用PBS稀释。
1.2.7 MTT实验根据实验分组,收集对数期的食管癌细胞消化、离心,用完全培养基重悬成单个细胞悬液,接种于96孔板中(每孔5×103细胞),待其贴壁后加入P.gingivalis-Exo,每个样设置5个复孔,放置在5%CO2、37 ℃的培养箱中孵育,分别在12、24、48、72 h后每孔加入15 μL的MTT(5 mg·mL-1),继续孵育。4 h后终止反应,弃上清液,加入150 μL DMSO,避光振荡10 min。用酶标仪在波长490 nm处测量OD值,并绘制生长曲线图。
1.2.8 划痕实验将5×105个细胞接种于六孔板中,放置在5%CO2、37 ℃的恒温培养箱中孵育。当细胞密度达到80%,在每个孔中心用100 μL枪头尖端刮擦细胞,PBS洗涤3遍,并加入无血清的培养基和P.gingivalis-Exo进行共培养,然后分别在0、12、24 h进行拍照。通过Image J软件确定无细胞区域。
1.2.9 Transwell实验实验前,先将50 mg·mL-1的基质凝胶稀释(50 mg·mL-1的基质凝胶:PBS=1∶8),并将其加入到24孔Transwell小室的上室,放置在5%CO2、37 ℃的培养箱中过夜使基质胶充分干燥。收集对数期的食管癌细胞,在无血清培养基中重悬,均匀混合。在Transwell上室中加入1×104个细胞,待其完全贴壁后加入P.gingivalis-Exo。最后,将500 μL含10%胎牛血清的培养基添加到下室。37 ℃、5% CO2细胞培养箱中培养24 h后,弃去上、下室培养液,PBS洗涤,晾干,取出小室用4%多聚甲醛固定2 h,PBS洗3次,4 g·L-1结晶紫染色30 min,再用PBS清洗3次,Transwell小室在显微镜下观察和拍摄。
1.2.10 Western Blot实验将5×106个细胞接种于直径为6 cm的培养皿中,KYSE-150/KYSE-30细胞与P.gingivalis-Exo共培养,37 ℃、5%CO2的恒温细胞培养箱中孵育。24 h后,用预冷的PBS洗涤细胞3次,在细胞中加入300 μL RIPA裂解液(含3 μL的PMSF),冰上充分裂解,14 000 r·min-1、4 ℃离心15 min,收集上清液。BCA试剂盒测定样品蛋白浓度后,调整至一定浓度,放置-80 ℃备用。SDS-PAGE电泳:取100 μL的细胞裂解液加入25 μL的5×Loading buffer,100 ℃沸水浴加热10 min 以充分变性蛋白。冷却至室温后,将蛋白样品加入10%SDS-PAGE胶的上样孔内,先80 V后120 V恒压电泳,然后300 mA恒流转印至PVDF膜上。转膜完毕后,5%脱脂牛奶室温封闭2 h,加入一抗GAPDH(1∶1 000)、Smad2(1∶1 000)、TGF-β1(1∶1 000),4 ℃摇床过夜,二抗(1∶5 000)室温孵育1 h,ECL显色并拍照。
1.3 统计学分析
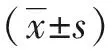
2 结果
2.1P.gingivalis-Exo的物理表征收集P.gingivalis的培养上清液,然后采用超速离心法提取外泌体。透射电子显微镜观察P.gingivalis-Exo,如图1所示,外泌体形状如卵圆形或“碟形”的双层的结构,大小均匀,直径在100 nm左右(图1A)。纳米粒度仪分析显示外泌体的粒径主要分布在130 nm左右(图1B)。

A:电镜下观察P. gingivalis-Exo的形态;B:Zetasizer Nano分析P. gingivalis-Exo粒径分布。图1 P. gingivalis-Exo的物理表征
2.2P.gingivalis-Exo进入食管癌细胞为进一步研究P.gingivalis-Exo对食管癌细胞的影响,采用共聚焦显微镜观察KYSE-150/KYSE-30细胞对P.gingivalis-Exo的摄取情况。P.gingivalis-Exo与食管癌细胞共培养4 h后,拍照观察。红色荧光表示被DIR染色的外泌体,蓝色荧光表示被DAPI染色的细胞核,合并为明场、红色荧光、蓝色荧光的叠加图。结果显示,大部分红色荧光定位在食管癌细胞胞质中,说明P.gingivalis-Exo可以被食管癌细胞摄取。见图2。

图2 食管癌细胞对P. gingivalis-Exo的摄取
2.3P.gingivalis-Exo促进食管癌的增殖、迁移和侵袭MTT实验常用于检测细胞活力。MTT结果表明,与对照组相比,P.gingivalis-Exo共培养的食管癌细胞增殖能力显著增加(P<0.05,图3A)。采用Transwell法检测P.gingivalis-Exo对食管癌细胞侵袭能力的影响。结果表明,与空白对照组相比,P.gingivalis-Exo共培养组侵袭数量较多(P<0.05,图3B)。通过划痕实验评估了P.gingivalis-Exo对食管癌细胞迁移能力的影响,从图3C可以看出,P.gingivalis-Exo处理后,细胞愈合率明显加快(P<0.05),说明P.gingivalis-Exo显著提高了细胞的迁移能力。以上结果表明,P.gingivalis-Exo对食管癌的增殖、迁移和侵袭具有明显的促进作用。
2.4P.gingivalis-Exo通过TGF-β1/Smad2通路调控食管癌的增殖、迁移Western blot结果如图4所示,与空白对照组相比,P.gingivalis-Exo处理组的食管癌细胞TGF-β1、Smad2蛋白表达呈上升趋势,这表明P.gingivalis-Exo对食管癌细胞恶性行为的调控可能与TGF-β1/Smad2通路有关。
3 讨论
P.gingivalis是口腔关键致病菌之一,其含量异常增加能够导致口腔微生态失衡[6]。口腔微生态失衡不仅能够引起口腔部分组织破坏,还能够通过异常免疫反应损伤远处组织,造成人体多种疾病的发生和发展,如慢性牙周炎、呼吸系统疾病、心血管疾病、糖尿病及多种肿瘤等[20-21]。最近的研究表明,P.gingivalis与食管癌的发生有着密切的关系[22]。牙龈卟啉单胞菌存在于61%的食管鳞状细胞癌组织中,其在癌旁组织中只有12%的患者能够被检测,但在正常人的食管组织中尚未发现[13]。这说明P.gingivalis在食管癌发生发展中扮演着重要的角色。然而,目前对P.gingivalis促进食管癌发生发展确切的分子机制尚不清楚。
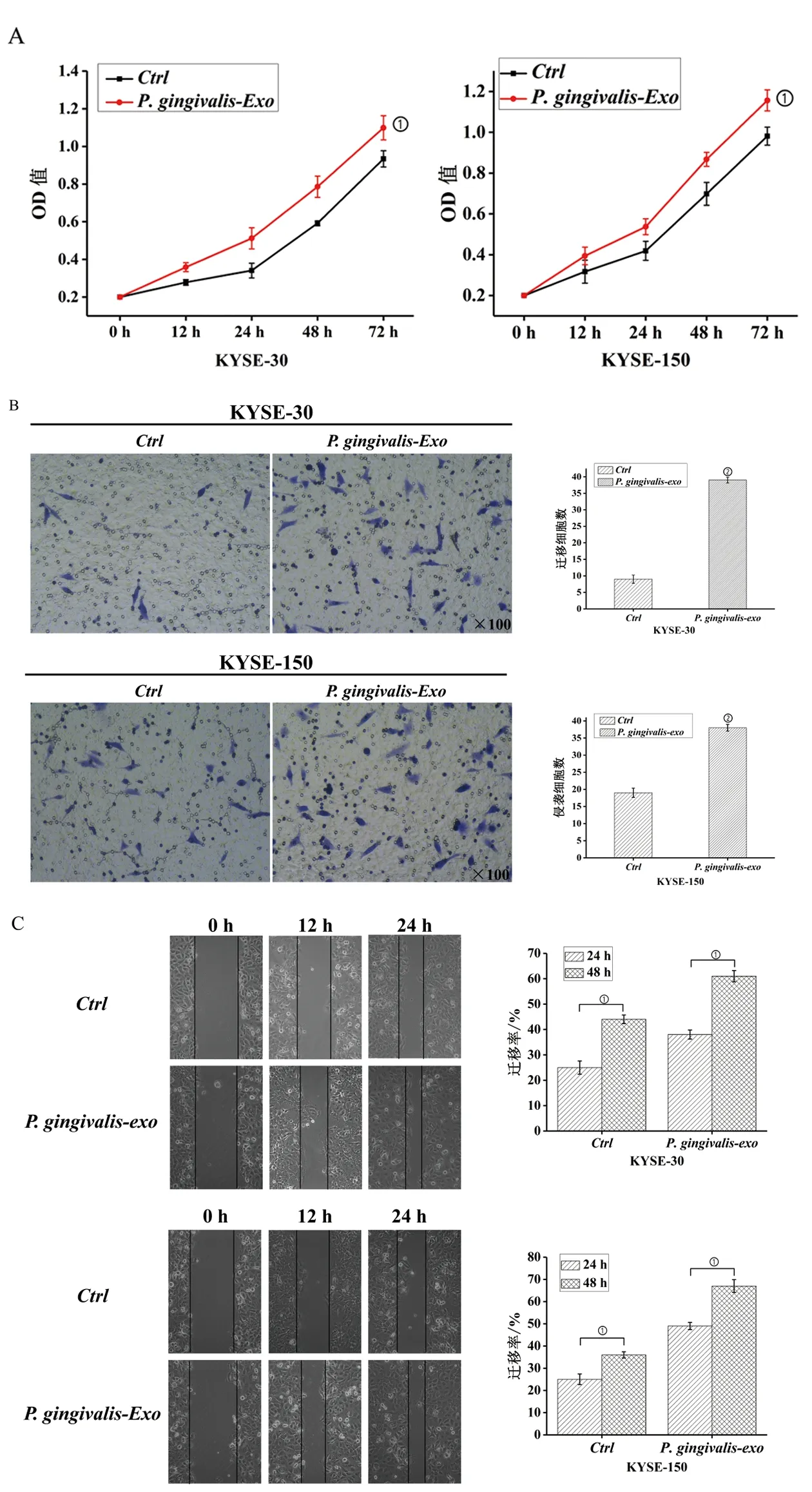
A:MTT实验;B:细胞侵袭实验;C:细胞划痕实验。①P<0.05;②P<0.01。图3 P. gingivalis-Exo对食管癌恶性生物学行为的影响

图4 P. gingivalis-Exo通过TGF-β1/Smad2通路调控食管癌的增殖、迁移
肿瘤-微环境在肿瘤进展、转移和治疗耐药中发挥重要作用。外泌体是一种能被大多数细胞分泌的直径大约为30~150 nm的具有脂质双层膜的微小膜泡。它在体内的传递具有广泛性,是细胞与细胞间通讯的重要分子,能够携带RNA、DNA、蛋白质以及其他信号分子参与细胞间的信号转导。有研究表明,结核杆菌分泌的外泌体能够诱导巨噬细胞释放的促炎因子TNF-α、IL-10、IL-6表达上升,从而影响巨噬细胞的免疫功能[23]。在2017年,Jessica探究了P.gingivalis-OMV在炎性免疫细胞中的作用,发现P.gingivalis-OMV在体内可以募集免疫细胞,引发巨噬细胞中的TNFα、IL-1β和IL-8分泌,从而产生更强的免疫反应,导致多种疾病的发生[24]。本研究通过电镜、粒径等物理表征证明成功提取了牙龈卟啉单胞菌来源的外泌体,粒径约为130 nm,形状如典型的外泌体“圆碟”状,这两种仪器测得的粒径差异可能是由于纳米粒度仪测的是外泌体纳米粒的水动力直径,略大于电镜的结果。采用共聚焦显微镜观察到了DIR标记的外泌体可以进入细胞并通过MTT、Transwell、划痕等体外实验验证了P.gingivalis-Exo对食管癌细胞的增殖、迁移具有显著的促进作用。
转化生长因子-β (TGF-β) 信号通路在生物体和胚胎发育过程中起着至关重要的作用。它们协调着许多细胞过程,包括细胞增殖、分化、迁移和侵袭等[25-26]。大量的文献报道了TGF-β与肿瘤的发生进展有一定的关系,可以促进肿瘤生长和转移[27-29]。其中TGF-β1/Smad信号通路是TGF发挥生物学效应的主要通路。Smads蛋白是目前所知的唯一的TGF-β受体的胞内激酶底物。研究已经证实Smad2是TGF-β/Smads通路中一个关键的分子[30-31]。为了进一步探究P.gingivalis-Exo对食管癌的作用机制,通过Western Blot实验发现,与空白对照组相比,P.gingivalis-Exo处理后TGF-β1、Smad2蛋白表达明显上升,这说明P.gingivalis-Exo可能通过调控TGF-β1/Smad2通路来促进食管癌细胞的增殖、迁移和侵袭。
综上所述,本文首次以P.gingivalis-Exo为对象,探讨了P.gingivalis-Exo对食管癌细胞恶性行为的调控。通过MTT、Transwell、划痕和Western blot实验验证了P.gingivalis-Exo在体外促进食管癌细胞增殖、迁移和侵袭,并初步探究了P.gingivalis-Exo对食管癌的影响机制,这些发现为治疗食管癌提供了一个新的思路,但是P.gingivalis-Exo对食管癌调控的具体分子机制还有待深入研究。

