长链非编码RNA-SLC52A3c在食管癌中的表达特征、功能与临床意义
龙 琳,张家盛,雷 菲,吴健谊,潘 峰,廖连娣,许秀娥,许丽艳,李恩民
食管癌是常见的上消化道恶性肿瘤之一,为全球十大高发肿瘤之一。主要包括食管鳞癌(esophageal squamous cell cancer,ESCC)与食管腺癌(esophageal adenocarcinoma,EAC)两种病理类型。在中国,主要以ESCC为主[1-3]。大多数ESCC患者发病早期无明显或特异性临床症状和体征,发现时多处于中晚期,预后差,5 a生存率仅20%[4-5]。因此,迫切需要从分子水平揭示ESCC发生的分子机制,为食管癌的诊断和防治提供新的线索与策略。
核黄素转运蛋白家族RFVT/SLC52成员SLC52A3是调控核黄素吸收及转运的关键蛋白[6]。研究表明,SLC52A3蛋白在ESCC癌组织中呈现异常高表达,敲降SLC52A3会明显抑制ESCC细胞的增殖能力和平板克隆形成能力;相反,高表达SLC52A3可促进癌细胞增殖,并增强癌细胞在裸鼠上成瘤能力[7]。2018年,本课题组研究发现,SLC52A3蛋白编码基因编码两种不同的蛋白亚型:SLC52A3a和SLC52A3b,它们在食管癌组织细胞中同样异常高表达,SLC52A3a高表达促进癌细胞增殖,并且在细胞核高表达与食管癌患者术后生存时间缩短呈显著正相关[8-9]。近期,又发现了一个新的不编码蛋白的亚型SLC52A3c,然而在ESCC中,此新亚型SLC52A3c对ESCC细胞功能有何影响还不明确,SLC52A3c表达与食管鳞癌患者预后关系也不清楚。因此,本研究检测非编码RNA-SLC52A3c对ESCC细胞增殖和迁移能力的影响,并探讨SLC52A3c表达与食管癌患者预后的关系,期望为探究ESCC发生的分子机制,以及诊断和防治ESCC提供新的理论依据。
1 材料与方法
1.1 细胞培养人食管鳞癌细胞系TE3、KYSE180、KYSE150和KYSE510在含10%胎牛血清(Gibco)的RPMI-1640(Invitrogen)培养基中培养,人食管鳞癌细胞系SHEEC和人永生化食管鳞状上皮细胞系SHEE在含10%新生牛血清的DMEM/F12培养基中培养,香港永生化食管鳞状上皮细胞系[10]NE1和NE2在Defined Keratinocyte-SFM/EpiLife Medium with 60 μM Calcium(含0.5%EpiLife Defined Growth Supplement,EDGS;0.1%Defined Keratinocyte-SFM)培养基中培养。细胞培养条件:CO2浓度5%,湿度80%,温度37 ℃。细胞长成单层后根据后续实验要求,取对数生长期细胞,胰蛋白酶消化后进行接种或传代常规培养。各细胞详细信息详见本课题组之前发表的文章[8,11]。
1.2 3′RACE扩增SLC52A3 cDNA 的3′末端3′RACE实验采用大连宝生物工程有限公司的3′-Full RACE Core Set Ver.2.0(Code No. D314)试剂盒。选用TE3细胞总RNA,按3′RACE说明书进行3′RACE Adaptor的连接,反转录获得双链cDNA,再使用TaKaRa LA Taq®(Code No.DRR02AM)进行套式PCR反应,取5 μL的PCR反应液进行琼脂糖凝胶电泳,确认3′ RACE PCR扩增产物。PCR扩增产物与pGEM-T vector载体连接,转化到Trans5α感受态细胞,取阳性克隆菌送往华大基因公司进行测序,测序结果利用NCBI数据库BLAST进行序列比对分析。3′RACE套式PCR引物见表1。
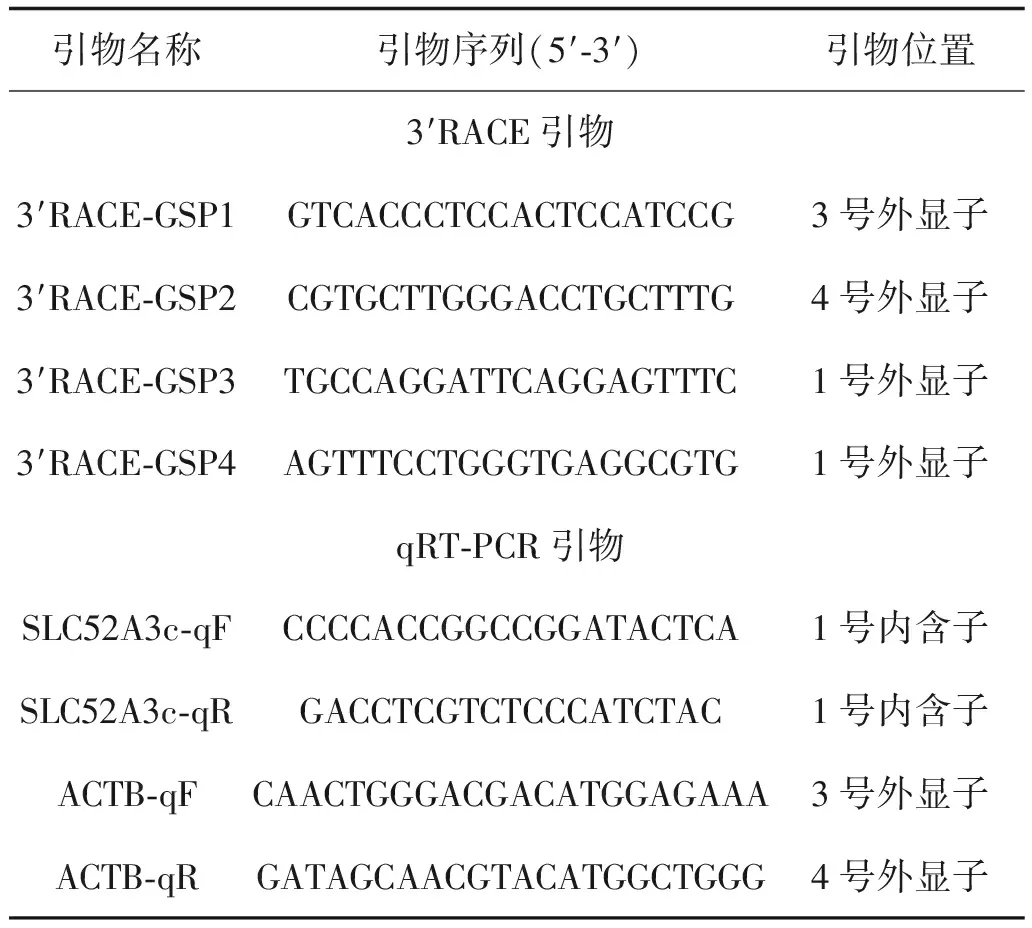
表1 3′RACE扩增SLC52A3本文所使用的引物
1.3 质粒构建和细胞转染根据3′RACE扩增的序列,提交SLC52A3c全长699 bp序列由金唯智公司(GENEWIZ)合成,构建到表达载体pcDNA3.1上获得pcDNA3.1-SLC52A3c质粒,经测序验证,插入序列准确无误。ESCC细胞正常传代后接种到6孔板中,于37 ℃、5% CO2培养箱常规培养至细胞密度为70%左右。按Lipofectamine3000(Invitrogen)说明书将质粒与Lipo3000形成的复合物加入到6孔板中,转染后的细胞继续于37 ℃、5% CO2培养箱中培养。6 h后更换10%新鲜培养基继续培养48 h。
1.4 RNA提取与实时定量PCR食管鳞癌患者的组织以及转染后的细胞选用Invitrogen的TRIzol 试剂提取总RNA。再采用大连宝生物工程有限公司的反转录试剂盒和SYBR Green定量PCR试剂盒对提取的总RNA进行反转录反应和定量PCR检测。以β-actin引物作内参对照。反应结束后确认定量 PCR 的扩增曲线和融解曲线,以2-△△CT方法分析基因表达相对变化。定量PCR引物见表1。
1.5 细胞增殖能力检测细胞增殖能力检测选用实时细胞功能分析(RTCA,xCELLigence Real-Time Cell Analyzer,Roche公司)[12]、平板克隆形成实验和MTS 3种实验方法进行。ESCC细胞转染质粒36 h后,换无血清培养基培养饥饿细胞12 h,再用胰酶消化、重悬,细胞计数后,将细胞浓度调整为1×105个细胞/mL后将细胞分别接种到RTCA E-plate和96孔板中,每孔100 μL(1×104个细胞/孔),另取10 μL细胞悬液到含2 mL培养基的6孔板中(每孔1×103个细胞)。E-plate板中的细胞直接进行细胞增殖能力检测,每15 min扫描1次;96孔板中细胞选用MTS试剂(Promega)分别检测各组ESCC细胞在 0、12、36、60和84 h的活性细胞数量;6孔板中细胞在常规培养条件下培养2周,当有肉眼可见明显的细胞克隆时终止培养,0.5%结晶紫染色后计数每孔的克隆数。
1.6 细胞迁移能力检测细胞迁移能力检测选用划痕实验和Transwell移动实验两种实验方法进行。ESCC细胞转染质粒36 h后,换用相应的无血清培养基培养饥饿细胞12 h,再用胰酶消化、无血清重悬,细胞计数后,将细胞浓度调整为1.25×105个细胞/mL,取400 μL细胞悬液加到Transwell小室上室中,下室加入含血清的正常培养基,CO2培养箱中常规培养 48 h 后弃去培养基,取出小室,用0.5%结晶紫染液染色,显微镜下观察细胞并计数。对于划痕实验,将上述细胞接种到6孔板中,每孔2 mL,4 h后换成含2%血清的培养基培养,并分别于0、24和48 h在显微镜下观察细胞并拍照,计算细胞迁移率。
1.7 临床样本收集本研究实验选取了汕头市中心医院病理科2007年至2012年183例进行了手术的癌患者的食管鳞癌组织,183例配对的手术切缘正常组织。所有病例的临床资料均来自病历记录,根据随访资料,术后因其他原因死亡或有严重术后并发症的病例已剔除。本研究已获得汕头大学医学院伦理委员会和汕头市中心医院伦理委员会的批准。
1.8 统计分析功能实验数据采用 GraphPad Prism 5软件计算平均值及标准差,同时绘制成图。应用SSPS 16.0软件对各组实验数据进行 Two-way ANOVA 检验,确定它们之间差异是否有统计学意义。通过威尔科克森符号秩检验(Wilcoxon)分析SLC52A3c在食管鳞癌患者的食管鳞癌组织和手术切缘正常组织中的表达量是否有差异。然后通过Kaplan-Meier单变量生存期分析分别评估SLC52A3c的表达量与食管鳞癌患者生存和无瘤生存情况的关系。采用多因素Cox风险回归模型逐步向前法评估各临床病理参数及SLC52A3c是否可作为食管鳞癌患者预后的独立影响因素。以P<0.05为差异有统计学意义。
2 结果
2.1 3′RACE扩增SLC52A3-3′UTR为了确定SLC52A3基因不同亚型的3′末端,作者在SLC52A3基因第3、第4外显子以及第1外显子上分别设计了3′RACE引物(见表1)扩增SLC52A3(见图1A),琼脂糖电泳各得到了多个条带,进行DNA测序鉴定后发现其中有亚型SLC52A3a的3′末端和新亚型SLC52A3c(图1B)。从图1C可以看出:① SLC52A3c-lncRNA与来自同一基因结构框架的蛋白编码转录本 SLC52A3a和SLC52A3b是一种同向顺式序列关系;② SLC52A3c-lncRNA的转录起始位点虽与SLC52A3a相同,但其1号外显子序列比Ensemble数据库提供的序列多出115 bp,其2号外显子序列与Ensemble数据库提供的序列相比,多出13 bp,因此其总长为699 bp。SLC52A3c转录本的RNA信息已提交到了GenBank数据库(GenBank:MN534336)。
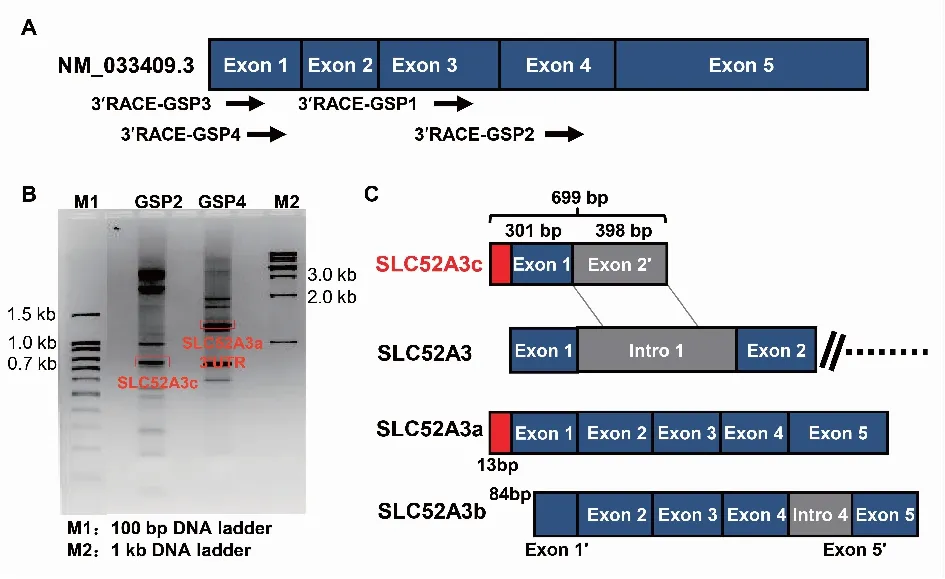
A:3′RACE扩增SLC52A3-3′UTR引物位置示意图;B:3′RACE PCR扩增产物琼脂糖电泳图;C:测序结果模拟图,SLC52A3c全长699 bp。图1 3′RACE鉴定lncRNA SLC52A3c
2.2 pcDNA3.1-SLC52A3c质粒表达鉴定为了获得高表达SLC52A3c的食管鳞癌细胞模型,本研究选用食管鳞癌细胞系TE3、SHEEC、KYSE510和KYSE150分别转染pcDNA3.1-SLC52A3c质粒,然后提取各细胞总RNA,通过定量PCR方法鉴定SLC52A3c的高表达,如图2所示,在各个食管鳞癌细胞系中,SLC52A3c均高表达成功。
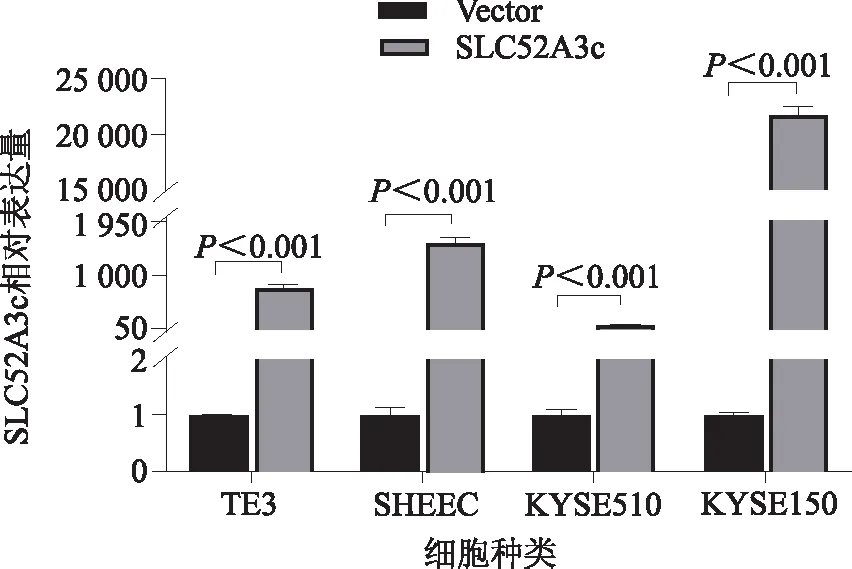
图2 SLC52A3c在食管鳞癌细胞系中的高表达效果
2.3 高表达SLC52A3c抑制食管鳞癌细胞的分裂增殖能力实时细胞功能分析实验、平板克隆形成实验和MTS 3种实验来确认SLC52A3c高表达对食管鳞癌细胞增殖能力的影响。RTCA实验结果如图3A,在TE3、SHEEC和KYSE510细胞中,相对于转染pcDNA3.1空载体的对照组,高表达SLC52A3c后细胞生长曲线较低,细胞的生长速率较慢,细胞的增殖能力明显受到抑制。细胞平板克隆形成实验结果和统计结果如图3B、3C,在TE3、SHEEC和KYSE510细胞中,无论是克隆的大小还是克隆的数量相对于对照组,高表达SLC52A3c后3种食管鳞细胞生长速度均较慢,克隆较小,克隆数目较少,细胞的增殖能力明显受到抑制。在TE3和SHEEC细胞中,用MTS实验进行了重复实验,结果如图3D,高表达SLC52A3c后细胞的生长曲线同样较低,生长速度较慢,食管鳞癌细胞的增殖速度明显减弱。这些结果表明,高表达SLC52A3c可以抑制食管鳞癌细胞的分裂增殖能力。
2.4 高表达SLC52A3c抑制食管鳞癌细胞的迁移能力细胞划痕实验结果如图4A,在食管鳞癌细胞SHEEC和KYSE510中,与对照组相比,转染SLC52A3c后划痕“愈合”速度变慢,SHEEC细胞移动能力显著减弱,相同时间内愈合范围更小。因为SHEEC细胞在划痕实验中划痕“愈合”速度减弱程度更显著,在本实验中再选用SHEEC细胞使用Transwell移动实验确证SLC52A3c高表达抑制食管鳞癌细胞迁移能力的实验结果。实验结果和统计结果如图4B,与对照组相比,SLC52A3c高表达组诱导穿过小室的细胞数目明显减少。上述实验结果提示,在食管鳞癌细胞中SLC52A3c高表达显著抑制癌细胞的迁移能力。
2.5 食管鳞癌细胞系和食管鳞癌组织中SLC52A3c的表达特征细胞功能实验表明,食管鳞癌细胞中,SLC52A3c高表达发挥抑制癌细胞分裂增殖和迁移的作用,那么,在食管鳞癌细胞系和相对正常的永生化食管鳞状上皮细胞系以及食管鳞癌组织与手术切缘正常食管上皮组织中,SLC52A3c表达水平如何?为了解这一情况,作者采用荧光定量PCR方法检测了5种食管鳞癌细胞和3种永生化食管上皮细胞以及183对食管鳞癌组织与手术切缘正常食管上皮组织中SLC52A3c的表达水平,结果如图5所示,SLC52A3c在食管鳞癌细胞中的表达水平显著低于永生化鳞状食管上皮细胞,食管鳞癌组织中SLC52A3c表达水平也明显低于手术切缘正常食管上皮组织,根据这些结果结合功能实验,作者推测SLC52A3c可能发挥抑癌作用。
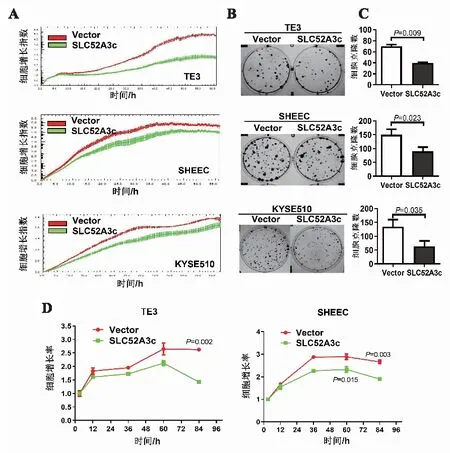
A:食管鳞癌细胞中高表达SLC52A3c,RTCA检测细胞增殖能力变化;B:食管鳞癌细胞中高表达SLC52A3c,平板克隆形成实验检测细胞增殖能力变化;C:细胞增殖能力对比;D:食管鳞癌细胞中高表达SLC52A3c,MTS检测细胞活力。图3 高表达SLC52A3c抑制食管鳞癌细胞的分裂增殖能力
2.6 SLC52A3c高表达与食管鳞癌患者无瘤生存时间正相关接下来,作者进一步将定量PCR结果与有完整生存状态的183例食管鳞癌患者资料结合起来,分析SLC52A3c与患者预后的关系。选用X-tile软件,根据SLC52A3c和病人无瘤生存状态找到Cutoff值,即卡方最大点,将SLC52A3c分成两个组(即High expression组及Low expression组),分析分组后SLC52A3c与食管癌患者生存时间或无瘤生存时间之间的关系。Kaplan-Meier曲线法分析结果发现,SLC52A3c表达水平与总生存时间未见显著相关性(P>0.05),但SLC52A3c表达水平对病人无瘤生存时间发现有明显影响,相对于SLC52A3c低表达的病人,SLC52A3c高表达的病人无瘤生存时间更长,且具有显著相关性(P=0.017)。这些实验结果说明SLC52A3c是一个保护性因子,在食管鳞癌中起抑制肿瘤的作用,SLC52A3c高表达可预警食管鳞癌患者有较好的预后。

A:划痕实验检测高表达SLC52A3c后食管鳞癌细胞迁移能力的变化; B:Transwell移动实验检测高表达SLC52A3c后食管鳞癌细胞移动能力的变化; C:对图B的定量结果。图4 高表达SLC52A3c抑制食管鳞癌细胞的迁移能力
2.7 SLC52A3c高表达是食管鳞癌患者无瘤生存的独立保护因素通过对年龄、性别、饮酒、TNM分期、吸烟、肿物大小与食管鳞癌病人癌组织中SLC52A3c表达量进行单因素及多因素Cox回归分析,结果显示TNM分期(P=0.000)和SLC52A3c(P=0.017)可以作为食管鳞癌术后患者复发转移的独立影响因素,SLC52A3c可作为食管鳞癌组织中独立预后因子,SLC52A3c表达水平越高,病人的预后越好。详见表2。
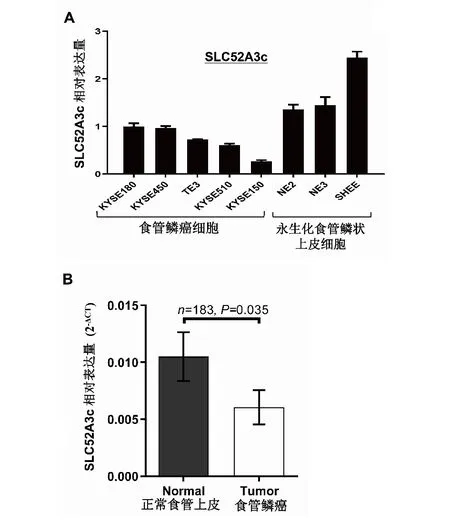
A:定量PCR检测5种食管鳞癌细胞和3种永生化食管鳞状上皮细胞中SLC52A3c的表达量;B:定量PCR检测183对食管鳞癌组织和配对的手术切缘正常食管上皮组织中SLC52A3c的表达量。图5 食管鳞癌细胞系和食管鳞癌组织中SLC52A3c的表达特征
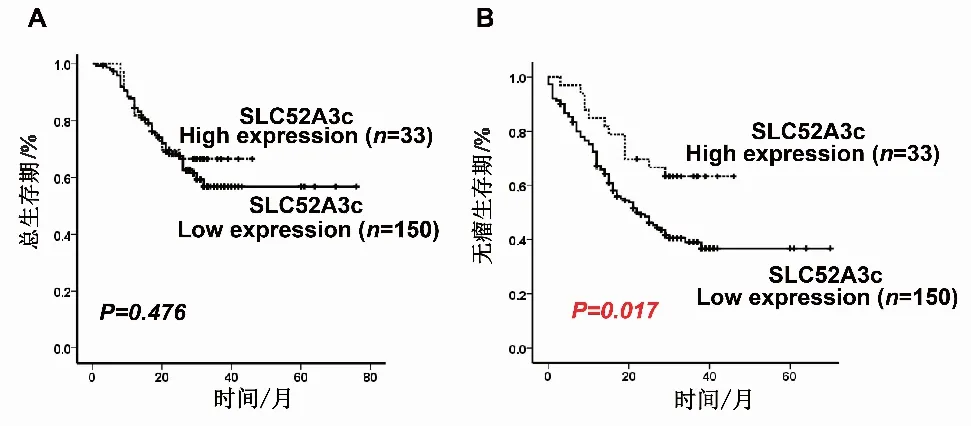
A:SLC52A3c表达水平与食管鳞癌患者总生存时间的Kaplan-Meier分析;B:SLC52A3c表达水平与食管鳞癌患者无瘤生存时间的Kaplan-Meier分析。图6 SLC52A3c表达水平与食管鳞癌患者总生存时间和无瘤生存时间的Kaplan-Meier分析
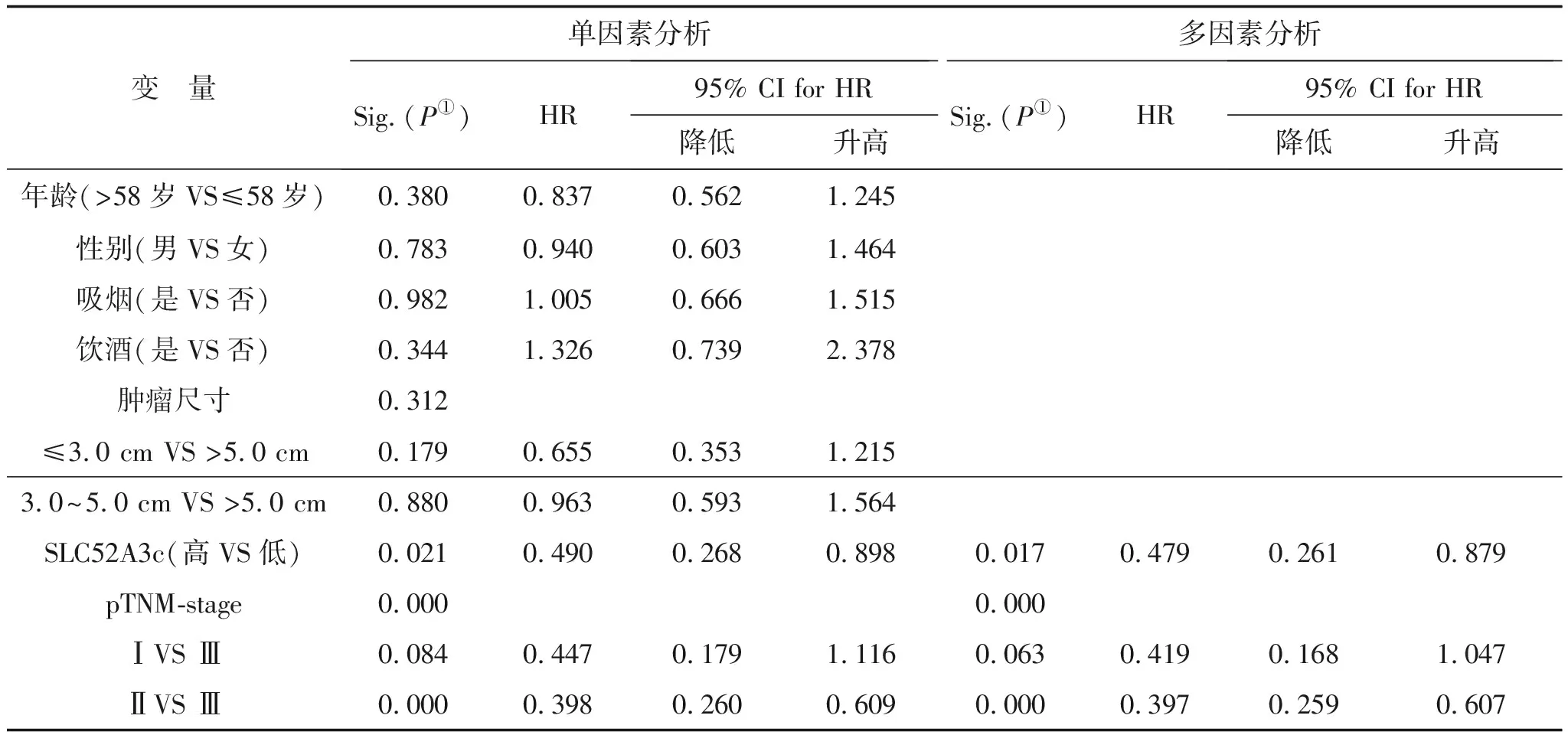
表2 SLC52A3c与食管鳞癌患者无瘤生存预后的单因素和多因素COX回归分析
注:①P<0.05为差异有统计学意义;HR:hazards ratio,风险率;CI:confidence interval,置信区间;多因素分析采用COX比例风险模型;单因素分析采用变量作为预测指标。
3 讨论
核黄素是黄素腺嘌呤单核苷酸(flavin mononucleotide,FMN)和黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)的前体,在细胞能量代谢中起着至关重要的作用,其缺乏可能导致DNA损伤、细胞应激反应和肿瘤的发生[11,13-14]。SLC52A3,SLC52家族的一员,是一个非常重要的核黄素转运者,在维持体内核黄素动态平衡中发挥着至关重要的作用[15-16]。研究表明,SLC52A3在ESCC的发生和发展中同样发挥重要作用。在食管鳞癌细胞中,SLC52A3表达敲降,抑制细胞增殖;SLC52A3a高表达促进细胞增殖,SLC52A3a在细胞核高表达与食管鳞癌患者术后生存时间呈现显著负相关关系,SLC52A3b在细胞质中高表达与食管鳞癌患者术后生存时间呈显著正相关关系,检测SLC52A3 在食管鳞癌组织细胞中表达定位可以预测食管癌患者预后[7-8]。
在本研究中发现了SLC52A3的一个新的非编码蛋白的lncRNA亚型,SLC52A3c,且研究发现SLC52A3c对于食管鳞癌细胞的功能作用与其他亚型作用相反,SLC52A3c高表达抑制食管鳞癌细胞的增殖和迁移。那么,SLC52A3c与SLC52A3a和SLC52A3b的表达调控以及与食管癌发生发展之间究竟有何种联系?分析SLC52A3基因3个不同转录本SLC52A3a/SLC52A3b/SLC52A3c,可以知道它们来自于同一基因结构框架,在SLC52A3 5′侧翼区转录调控区和3′端非翻译区上,序列相互重叠,因此SLC52A3a/SLC52A3b/SLC52A3c三者间在转录层面或转录后可能存在相互作用,相互影响。有研究表明,PTEN基因的其中的一个转录本lncRNA PTENpg1,可作为miRNA海绵捕获靶向PTEN的miRNA,在转录后水平调控PTEN的表达[17]。基于此,可以猜测,SLC52A3c也许同样会通过捕获miRNA来调控SLC52A3的表达,SLC52A3c作为lncRNA,很有可能与SLC52A3一起,形成自反馈调节,影响核黄素的转运和能量代谢途径,改变食管鳞癌的发生发展进程。在今后的研究中,作者拟进一步探究三者表达过程中的相关性,深入探究SLC52A3在食管鳞癌中发挥作用的分子机制。
临床上,治疗食管鳞癌的方案,主要有手术、放疗和化疗等。一般来说,对于那些晚期,可以直接手术的食管鳞癌患者,往往是术后辅助放疗或/和化疗。目前,指导临床食管鳞癌治疗方案选择的标准是TNM分期。与其它恶性肿瘤一样,食管鳞癌有着很强的异质性,这使得仅仅依靠TNM分期,往往并不能达到精准治疗的目的,许多时候会出现治疗不足,或过度治疗的情况。所以,人们寄希望于寻找分子标志物,以完善食管鳞癌患者的治疗方案。以往报道的食管鳞癌以及其他癌症的预后预警分子标志物,主要集中在蛋白编码基因。近年来,miRNA和lncRNA已成为新的肿瘤预后预警分子标志物的研究热点。
HOTAIR是研究最广泛的具有致癌作用的lncRNA之一,在原始乳腺癌的转移中被发现。越来越多的研究表明,HOTAIR高表达使食管癌患者变差,促进淋巴结转移,总生存率变低,促进癌细胞的转移[18-20]。Meta分析发现,高表达的HOTAIR是强有力的预后因子,可作为食管癌患者治疗的靶标[21]。在本研究中发现的新lncRNA-SLC52A3c,在食管鳞癌细胞系中表达水平明显低于永生化鳞状食管上皮细胞,在食管鳞癌组织表达量明显低于手术切缘正常食管上皮组织,并且SLC52A3c高表达与食管鳞癌患者无瘤生存时间正相关,是食管鳞癌患者无瘤生存的独立的保护性因素,这些结果表明SLC52A3c的确是一个抑癌性lncRNA,在食管鳞癌中发挥保护性作用,并抑制食管鳞癌的转移。
综上所述,SLC52A3c作为一个保护性因子,通过抑制食管鳞癌细胞增殖和迁移能力,抑制食管鳞癌的发生发展。在食管鳞癌的lncRNA研究中,许多lncRNA,如HOTAIR、MALAT1、NEAT1、POU3F3和CCAT2均可发挥致癌作用[18,22-26],因此SLC52A3c作为抑制性因子为食管鳞癌中lncRNA研究打开新的局面。此外,SLC52A3c还可成为食管鳞癌的早期诊断、预后预警及分子分型的有效的分子标志物。同时SLC52A3c还可能作为食管鳞癌靶向治疗的分子药靶,开发以SLC52A3c为靶点的食管鳞癌的靶向药物。总之,本研究探究SLC52A3c在ESCC发生的分子机制,为ESCC的早诊和防治提供了理论依据。

