基于3-羟基黄酮的pH荧光探针合成及线粒体靶向荧光成像
王 超,杨方舟,吉鹏博,王婷婷,马养民
(陕西科技大学 化学与化工学院,陕西 西安 710021)
0 引言
线粒体是真核生物细胞中一种至关重要的细胞器,它在细胞能量代谢过程中起着关键性作用,是ATP产生的场所,在此过程中线粒体负责的是最终氧化的共同途径,三羧酸循环与氧化磷酸化.线粒体还参与细胞分化、信息传递和凋亡等过程,并参与调控细胞周期.线粒体功能异常与肿瘤、神经退行性疾病、糖尿病、衰老等众多疾病过程密切相关,因此细胞内线粒体相关功能的研究具有重要意义[1].
荧光探针作为一种新型的可视化的研究工具,具有灵敏度高和非生物破坏性等优点,已被广泛应用于细胞内各种细胞器、生物大分子和离子的标记、检测与成像[2-4].利用荧光探针在活细胞内实时、原位追踪线粒体的形态、分布及其变化为线粒体相关功能研究提供了手段,是当前国内外关于细胞内靶向荧光检测的热门领域[4-8].目前文献报道针对线粒体荧光成像的小分子荧光探针设计,主要是基于线粒体内膜膜电位差形成的基质内碱性,亲脂性的阳离子荧光染料可以特异性的嵌入线粒体内膜并与基质中的负电荷稳定结合,实现对线粒体特异性标记成像的目的[7-11].
综上,本论文设计以邻羟基苯乙酮和对位取代苯甲醛为原料,经Claisene-Schmidt缩合反应和Algar-Flynn-Oyamada氧化反应得到3-羟基黄酮母核,再以3-羟基黄酮为基本骨架,引入三苯基膦靶向基团合成目标探针分子HF-Mito.亲脂性的季鏻盐阳离子可实现对细胞内线粒体的靶向标记;3-羟基黄酮因其分子中羟基与羰基邻近,能形成分子内氢键,易发生激发态分子内质子转移(Excited State Intramolecular Proton Transfer,ESIPT)过程,赋予了它优异的荧光性能[12].并且这一过程易受到质子性溶剂的影响,该探针也可以对线粒体pH进行测定.通过光谱分析与细胞荧光成像实验评价了该荧光探针用于细胞内线粒体特异性荧光成像的可行性.
1 实验部分
1.1 试剂与仪器
1.1.1 主要试剂
2-羟基苯乙酮、对羟基苯甲醛、1-溴-3-氯丙烷、三苯基膦、KH2PO4、Na2HPO4·12H2O、氯化钠、氯化钾、无水硫酸镁、石油醚、1,4-二氧六环、四氢呋喃、乙酸乙酯、二氯甲烷、乙腈、丙酮、乙醇、甲醇、N,N-二甲基甲酰胺、二甲基亚砜、碳酸钾、氢氧化钠、碘化钠、过氧化氢、氘代氯仿,均为市售分析纯.DMEM培养基(Gibco),胎牛血清(生工生物工程有限公司),青霉素-链霉素溶液(碧云天生物技术有限公司).
1.1.2 主要仪器
RE-52系列旋转蒸发仪上海亚荣生化仪器厂);PHS-3E 型 pH 计(上海仪电科学仪器股份有限公司);紫外可见吸收光谱仪(哈希公司DR5000);Lumina荧光分光光度计(赛默飞世尔科技有限公司);ADVANCE III 400 MHz核磁共振波谱仪(bruker公司);二氧化碳细胞培养箱(ESCO);LSM800激光共聚焦荧光显微镜(卡尔蔡司).
1.2 探针HF-Mito的合成
目标分子的合成主要路线如图1所示,总共有3步反应.

图1 线粒体荧光探针HF-Mito的合成路线
1.2.1 化合物1的合成
称取4-羟基苯甲醛(2.5 g,20.3 mmol)和1-溴-3-氯丙烷(4 mL,41 mmol)加入100 mL圆底烧瓶中,用30 mL丙酮溶解,再加入无水碳酸钾(3.0 g)催化,氩气保护条件下,搅拌、回流反应18 h.薄层色谱监测反应完全,停止反应.将反应溶液过滤,用二氯甲烷洗涤滤渣数次,合并有机相,旋蒸除去有机溶剂.对产物进行硅胶柱色谱分离(洗脱剂为石油醚∶乙酸乙酯=10∶1),得到淡黄色油状液体3.1 g,产率78 %.
1.2.2 化合物2的合成
取化合物1(0.39 g,2.0 mmol)和2-羟基苯乙酮(0.3 g,2.2 mmol)加入100 mL茄形瓶中,然后加入氢氧化钠固体0.2 g催化,再加入4 mL无水甲醇,超声使其溶解.搅拌回流反应8 h,然后恢复至室温继续搅拌反应过夜.向反应溶液中加入氢氧化钠溶液(0.5 mol/L,8 mL)和过氧化氢(30 %,2 mL),继续室温搅拌反应约5 h.薄层色谱监测反应完成后,将反应溶液倒入50 mL冰水中,有黄色固体析出,过滤,用水洗涤固体数次后干燥.所得固体进行硅胶柱层析纯化(洗脱剂为二氯甲烷∶甲醇=100∶1),得黄色固体产物303 mg,产率50 %.产物结构经核磁共振氢谱表征.
1H NMR (400 MHz,CDCl3)δ:8.32~8.23(m,3H),7.72(ddd,J=8.6,7.0,1.7 Hz,1H),7.61(d,J=8.5 Hz,1H),7.44(ddd,J=8.0,7.1,1.0 Hz,1H),7.29(s,1H),7.12~7.05(m,2H),4.24(t,J=5.8 Hz,2H),3.81(t,J=6.3 Hz,2H),2.32(p,J= 6.0 Hz,2H).
1.2.3 探针HF-Mito的合成
称取化合物2(20.4 mg,0.06 mmol)和三苯基膦(32.6 mg,0.12 mmol)于100 mL圆底烧瓶中,加入碘化钠(46 mg,0.3 mmol)催化,乙腈(6 mL)为溶剂溶解.氩气保护下,搅拌回流反应2 h.监测反应完全后停止,旋蒸除去溶剂,得到的固体进行硅胶柱层析纯化(洗脱剂为二氯甲烷∶甲醇=100∶1).得到浅红色固体30 mg,产率91%.产物结构经核磁共振氢谱表征.
1H NMR (400 MHz,CDCl3)δ:8.24~8.14 (m,3H),7.84(td,J=12.1,11.4,7.7 Hz,10H),7.73(dd,J=7.6,3.3 Hz,6H),7.58(d,J=8.5 Hz,1H),7.40(t,J=7.5 Hz,1H),7.02(d,J=8.8 Hz,3H),4.45(t,J=5.7 Hz,2H),4.06~3.90(m,2H),2.25(dt,J=14.5,6.6 Hz,2H).
1.3 光谱测试
探针母液的配制:准确称量探针HF-Mito,将其溶于DMSO中,配制成浓度为10 mmol/L的母液备用.工作液:取2 mL溶剂,将2μL探针母液加入不同溶剂及不同pH水溶液中配成浓度为10μM的溶液.将探针溶液进行吸收光谱与荧光光谱测试(激发波长为360 nm,激发狭缝宽度为10 nm,发射狭缝宽度为5 nm).
1.4 细胞培养与荧光成像
MCF-7细胞在37 ℃、5%CO2浓度的培养箱(ESCO)中培养,使用含有10%胎牛血清(FBS)、青霉素(100 U/mL)和链霉素(100μg/mL)的DMEM培养基.用于荧光成像的细胞接种在玻璃底皿(φ=20 mm)中并培养24 h,将探针HF-Mito加入细胞培养液(5μM),对细胞染色45 min.最后用PBS洗涤细胞三次,使用×63物镜对细胞成像,激发波长为405 nm,发射波长为420~520 nm.
2 结果与讨论
2.1 探针HF-Mito的紫外-可见吸收和荧光光谱
探针HF-Mito的结构通过核磁共振氢谱表征,结果如图2所示.

图2 探针HF-Mito的核磁共振氢谱
以乙酸乙酯为溶剂对其光谱进行测定,如图3所示,探针HF-Mito的紫外-可见吸收光谱和荧光光谱,其最大吸收峰为360 nm,最大发射峰为550 nm.吸收峰和荧光发射峰的分离程度很大,斯托克斯位移达到190 nm,激发波长与发射波长的干扰非常小,用于后续细胞成像实验具有背景干扰低的优点.

图3 探针的紫外-可见吸收光谱和荧光光谱
2.2 探针HF-Mito在不同溶剂中的荧光光谱
实验进一步探究了不同溶剂对探针HF-Mito荧光性能的影响.分别选用1,4-二氧六环、乙酸乙酯、四氢呋喃、二氯甲烷、乙腈、N,N-二甲基甲酰胺、二甲基亚砜、乙醇、甲醇、PBS等作为溶剂进行探针的光谱测试,相应荧光光谱如图4所示.

(a)探针HF-Mito在非质子性溶剂中的荧光光谱
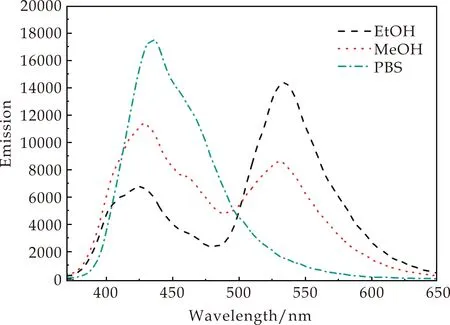
(b)探针HF-Mito在质子性溶剂中的荧光光谱图4 探针HF-Mito在不同溶剂中的荧光光谱
从图4可发现,探针HF-Mito在360 nm的波长激发下会产生两组荧光发射峰,峰位置分别在短波约440 nm处和长波约540 nm处.如图4(a)所示,在二氯甲烷、四氢呋喃和乙酸乙酯等非质子性溶剂中3-羟基黄酮母核中的羟基氢和相邻的羰基氧形成分子内氢键,使探针HF-Mito被激发后发生ESIPT效应,产生质子转移的互变异构体,其能量降低,从而发生光谱波长红移,因此在长波长540 nm处会有最大发射峰.
如图4(b)所示,在甲醇、乙醇和PBS等质子性溶剂中,由于溶剂的活泼氢能与探针羰基形成分子间的氢键,从而阻断了分子内形成氢键,也阻断了ESIPT效应,因此为正常激发态在短波长440 nm的发射峰[13,14].这说明探针HF-Mito的光谱性质会因质子化溶剂的作用而发生变化,据此可以推测,该探针在用于细胞成像时,在细胞质等水环境中会以短波长荧光为主,而探针插入线粒体内膜的疏水环境中,会以长波长荧光发射为主,因此荧光成像也具备了背景干扰低的优点.
2.3 探针HF-Mito在不同pH下的光谱
鉴于质子性溶剂环境对探针HF-Mito光谱性质的影响,进一步考虑溶液酸碱度对于探针HF-Mito的光谱性质有何影响,这对于评价其用于细胞内线粒体荧光成像的可行性是必要的.分别配制了不同pH的PBS溶液,对探针进行了相应光谱测试.
不同pH下探针HF-Mito的紫外-可见吸收光谱如图5所示,探针在350 nm处的吸收峰强度会随着pH的增大而逐渐减弱,而410 nm处的吸收峰强度会随着pH的增大而逐渐增大.这是因为在偏碱性的条件下,3-羟基黄酮的羟基氢很容易被脱去,从而形成阴离子,410 nm处的吸收峰为探针HF-Mito脱去氢离子所形成阴离子化合物的吸收峰,因此随着碱性的增强,阴离子化合物逐渐增多,410 nm处的吸收也在逐渐增强.

图5 探针HF-Mito随pH变化的吸收光谱
不同pH下探针HF-Mito的荧光光谱如图6所示,探针的荧光强度随着pH的增加而减小.在酸性条件下,由于溶液中的氢离子与羰基形成氢键,阻碍了ESIPT效应,从而在短波长440 nm处的荧光会随着酸性的增大而增强;而在碱性条件下,探针会脱去羟基上的氢形成阴离子化合物,既不会发生ESIPT效应也不会形成探针HF-Mito的激发态分子,因此440 nm处的荧光强度随着碱性增强逐渐减弱.据文献报道线粒体基质内pH值约为8,这一弱碱性环境可能对于探针HF-Mito的发光性能有一定影响,但由于探针可以插入线粒体内膜的疏水环境,可减小这一影响,能够满足线粒体荧光成像的需求[15].

图6 探针HF-Mito随pH变化的荧光光谱
2.4 细胞内线粒体荧光成像
为验证探针HF-Mito对细胞内线粒体的靶向标记与成像效果,将探针应用于细胞的激光共聚焦荧光成像实验,选用人乳腺癌细胞(MCF-7)为目标进行染色,探针HF-Mito以5 μM浓度对细胞染色45 min.如图7所示,在405 nm光激发下,细胞在蓝绿色通道(420~520 nm)显现出强烈的荧光,清晰地显示出细胞核部分无荧光,在线粒体集中聚集的细胞质中,可以看到线状的荧光分布,其分布特征与相关文献所报道的线粒体荧光探针细胞成像呈现的融合线粒体形貌一致[10,15].由此推断,荧光探针HF-Mito可以实现细胞内线粒体的特异性标记与荧光成像.

图7 探针HF-Mito标记细胞内线粒体荧光成像
3 结论
本论文以3-羟基黄酮为荧光母核,以三苯基膦为靶向基团合成了一例用于活细胞线粒体特异性成像的荧光探针HF-Mito.该探针的ESIPT效应使其在非质子性溶剂环境中表现出分子内质子转移的互变异构体长波长荧光,而在质子性溶剂环境中表现出正常激发态的短波长荧光,同时,ESIPT效应赋予了探针较大的斯托克斯位移,这都使该探针应用于线粒体成像时具备了背景干扰低的优点.荧光成像实验结果显示线粒体荧光染色清晰,表明探针HF-Mito对活细胞线粒体具有较好的标记特异性,并且可用于线粒体pH的测定,为线粒体形态及功能研究提供了一种性能优异的工具.

