基于β-环糊精改性的水溶性苝酰亚胺的合成及其pH响应性研究
杨 靖,白 阳,安 娜,刘彩萍,陈香李,步怀天
(陕西科技大学 化学与化工学院 陕西省轻化工助剂重点实验室,陕西 西安 710021)
0 引言
3,4,9,10-苝四甲酸二酐(PTCDA)是由两个萘环以sp2杂化构成的具有良好平面性的稠环芳烃,其在结构上拥有大的共轭π体系,也是一类具有强荧光的缺电子分子[1].分子结构中的共轭稠环结构使其具有良好的稳定性,因此PTCDA相较于有相同性质的有机分子而言,光、热、化学稳定性更加突出[2].PTCDA的荧光量子产率几乎接近100%,且荧光寿命较长[3,4],研究表明,PTCDA的吸收波长在接近可见到红外光(400 nm-600 nm)区域.但是PTCDA分子结构中的羰基的吸电子作用使整个分子处于缺电子状态,导致PTCDA易还原难被氧化.同时由于共轭稠环结构刚性大,导致苝核在常见溶剂和水中极易发生π-π堆积[5,6],从而导致PTCDA的溶解性和荧光量子产率大幅度下降,限制了其应用,因此有关其水溶性衍生物的研究是提高其利用度的热点问题.
苝酰亚胺常见的修饰位点有两个,Langhals[7]首先提出“燕尾式”取代方法,即以亚胺位置作为取代位点.Seybold等[8]首次提出可对其湾位进行改性.“燕尾式”取代方法是通过增溶基团之间静电排斥作用、氢键作用以及空间位阻效应等防止分子之间的聚集.湾位的改性会破坏分子的平面结构,扭曲的空间结构减少了分子间的聚集,从而起到增溶作用,但是也会对分子的光学性能产生影响.目前常用的改性方法都建立在对这两个位点的修饰.
本文以PTCDA为原料,采用“燕尾服”式[7,9]取代方法将β-环糊精(β-CD)与PTCDA亚氨基进行共价连接,在改善其水溶性的同时不改变小分子本身的光物理和电化学性能[10].β-CD除了本身良好的水溶性及生物相容性,本身对环境几乎没有污染,并且具有廉价易得的优势.环糊精增溶的原理是通过大环分子之间静电排斥、氢键以及空间位阻效应减弱苝核之间的π-π堆积效应,从而增加溶解性[11].除此之外,环糊精本身与二茂铁,金刚烷等具有良好的包合性能[12].
基于β-CD改性的CD-PDI-CD荧光探针具有良好的水溶性,且亚氨基是一个质子的有效键合位点,对pH有一定的敏感性[13],因此目标产物可在不同浓度和pH条件下调节苝核的聚集程度,从而进一步实现在浓度和酸度变化条件下荧光的变化.
1 实验部分
1.1 试剂与仪器
(1)主要试剂:β-环糊精(β-CD)、甲苯-4-磺酰氯(TsCl)、乙腈、氢氧化钠、丙酮、乙二胺(EDA)、N,N′-二甲基甲酰胺(DMF)、无水乙醇、3,4,9,10-苝四甲酸二酐(PTCDA)、醋酸锌Zn(AcO)2、吡啶、三氟乙酸,冰醋酸,均为分析纯;磷酸盐缓冲液(PBS,pH=4.0,0.05 M;pH=5.0,0.05 M),去离子水.
(2)主要仪器:旋转蒸发器、烘箱、400 MHz核磁共振波谱仪,德国Bruker公司;VECTOR-22型红外光谱仪,德国Bruker公司;UV-2650型紫外可见分光光度计,日本岛津公司;F-7000FL型荧光光谱仪,日本Hitachi公司;XE7型原子力显微镜,韩国Park公司;透射电子显微镜,美国FEI公司.
1.2 探针的合成
荧光探针分子的合成路线和质子化如图1所示.其荧光探针分子具体制备方法如下所述.
1.2.1 磺化环糊精(β-CD-OTs)的制备
参考白阳[14]报道的合成方法合成6位单取代环糊精.在冰水浴下,于1 000 mL三口烧瓶中依次加入NaOH(6 570 mg,164.0 mmol),β-CD(60 000 mg,52.9 mmol),500 mL去离子水.将TsCl(10 080 mg,52.9 mmol)溶于30 mL乙腈中后缓慢滴加到NaOH溶液中,之后在室温下反应2 h.反应结束后抽滤,收集滤液,将滤液置于冰箱中过夜;抽滤后收集滤饼,并分别用稀盐酸、去离子水、丙酮洗涤得粗产物.将粗产物进行重结晶,真空干燥得产物为白色固体7 040 mg,产率12.0%.
1.2.2 胺化环糊精(β-CD-EDA)的制备
于50 mL烧瓶中加入30 mL EDA,在搅拌的条件下加入β-CD-OTs(5 000 mg,387.9 mmol),密封后将烧瓶放置在75 ℃油浴中反应4.5 h.反应结束后待冷却到室温,将反应混合液用冰丙酮沉淀,待丙酮的温度达到室温后抽滤,收集滤饼,真空干燥12 h后得白色粘状物质为粗产物;将粗产物丙酮进行两次沉淀,抽滤,真空干燥,溶剂均为20 mL DMF,最终得产物为白色固体1 250 mg,产率25.0%.
1.2.3 水溶性苝酰亚胺衍生物(CD-PDI-CD)的制备
参考Wang等[15]报道的方法,在N2保护下,于250 mL烧瓶中依次加入β-CD-EDA(490 mg,0.335 mmol),PTCDA(130 mg,0.165 mmol),Zn(AcO)2(36.5 mg,0.165 mmol)和100 mL吡啶,将烧瓶放置在100 ℃油浴中反应48 h.反应结束后,除去溶剂得到红色固体为粗产物,将粗产物用去离子水洗涤,收集滤液,除去滤液中大部分水后用甲醇沉淀、抽滤、真空干燥后得产物为紫红色固体粉末162 mg,产率28.7%.

(a)探针分子的合成路线

(b)探针分子的质子化图1 探针的合成路线和质子化
2 结果与讨论
2.1 化合物的表征
2.1.1β-CD-OTs的表征
(1)红外谱图:如图2中a曲线所示,在1 600 cm-1和1 496 cm-1出现的两个较弱峰为苯环骨架(C=C)的特征吸收峰.1 364 cm-1和1 176 cm-1处为砜基的对称伸缩振动特征吸收峰.816 cm-1和668 cm-1处为苯环上的H(Ar-H)的面外变形振动吸收峰,这些特征峰的出现可以证明对甲苯磺酰基已经连接到了β-CD分子上.
(2)核磁氢谱:如图3(a)所示,1H-NMR(DMSO-d6,TMS),其中δ=2.5为DMSO溶剂峰,δ=7.75、7.43、2.43 分别对应图中a、b、c处的峰值.a、b对应对甲苯磺酰基苯环上的两组质子,c对应对甲苯磺酰基中甲基上的H,根据苯环上的氢与环糊精2,3位羟基氢的比例可以证明单取代的β-CD-OTs已成功合成.
2.1.2β-CD-EDA的表征
(1)红外光谱:将图2中a、b曲线进行比较,可以看出两条曲线的相似度很高,这种情况的出现是因为特征峰的重叠,并且理论上的出峰位置也是相似的,所以想要证明β-CD-EDA分子的合成情况,需进一步使用1H-NMR对化合物的分子结构进行表征.
(2)核磁氢谱:如图3(b)所示,1H-NMR(DMSO-d6,TMS),其中δ=2.5为DMSO溶剂峰,δ=3.1~5.9的特征峰与β-CD-OTs的特征峰完全相同,但是在δ=7.0~8.0没有出现特征峰,即对甲苯磺酰基特征峰均已消失,因此β-CD-OTs上的对甲苯磺酰基被氨基成功取代;并且在δ=2.7~2.9处出现乙基的特征吸收峰,证明乙二胺已经连接到β-CD-OTs分子上形成β-CD-EDA.
2.1.3 CD-PDI-CD的表征
(1)红外谱图:如图2中c曲线所示,在3 300 cm-1处出现的峰为环糊精中-OH的特征峰,1 600 cm-1和1 496 cm-1处出现的两个较弱峰为苯环骨架(C=C)的特征吸收峰,在1 659 cm-1处的峰为酰胺键的特征吸收峰,这些特征峰的出现证明β-CD成功连接到了苝酰亚胺上.
(2)核磁氢谱:如图3(c)所示,1H-NMR(DMSO-d6,TMS),其中δ=2.5为DMSO溶剂峰,在δ=7.0~8.0出现苯环氢的特征吸收峰,δ=5.5~6.0为环糊精2,3位-OH的氢的吸收峰,环糊精分子上羟基的氢与苝核上苯环氢的比例为1∶3.7,接近理论比例1∶3.5,即证明水溶性苝酰亚胺衍生物CD-PDI-CD已成功合成.
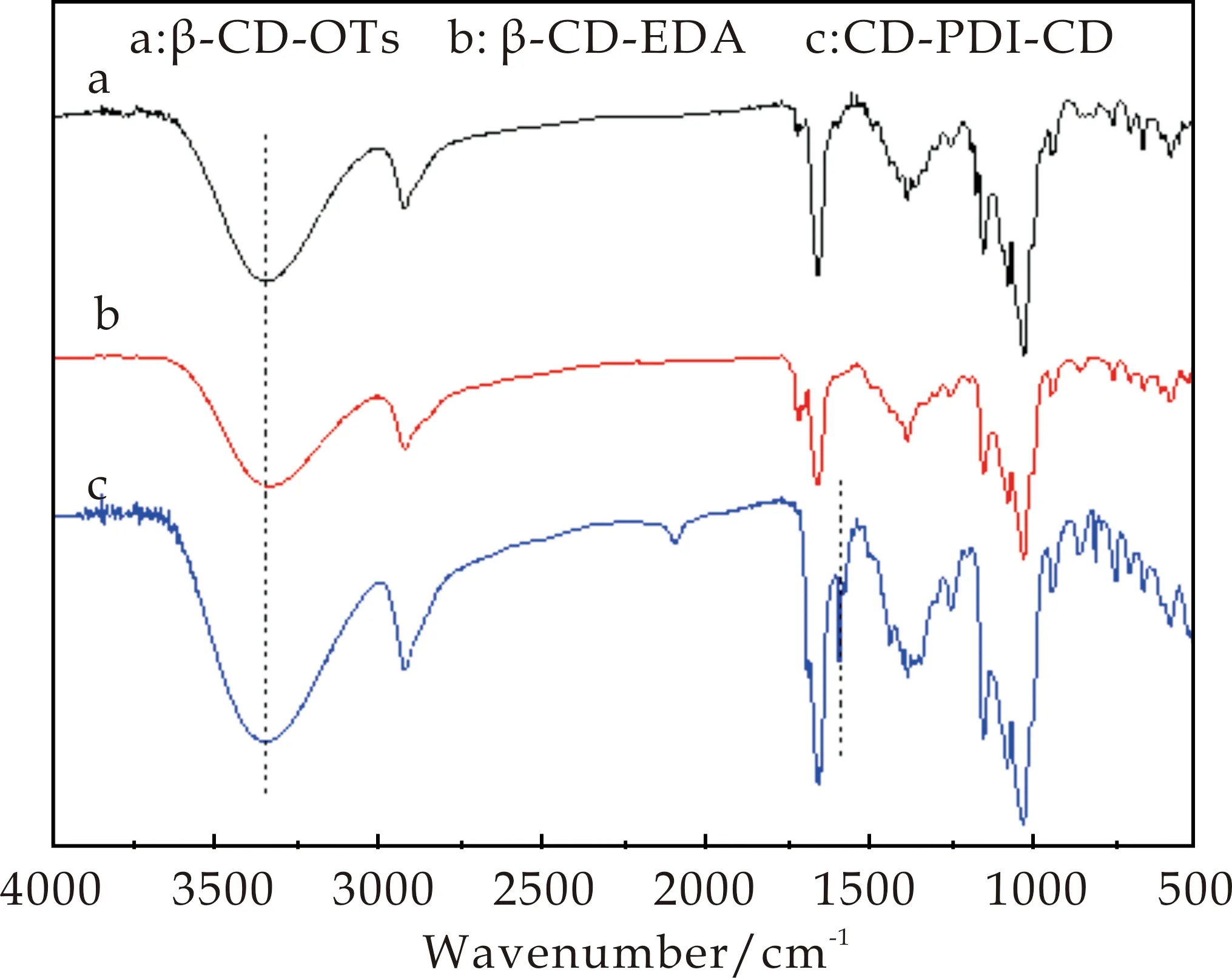
图2 化合物的FT-IR图

(a)β-CD-OTs

(b)β-CD-EDA

(c)CD-PDI-CD图3 化合物的1H-NMR图
2.2 探针的光谱性质和pH响应
探针分子CD-PDI-CD在水溶液中溶解性良好.但是由于苝核的刚性结构,在溶剂中分子不是独立存在的,而是更倾向于分子之间相互聚集这种更为稳定的方式存在[16].如图4所示,(a)和(b)分别为中性和酸性条件下浓度为1×10-4M,1×10-5M,1×10-6M的溶液,在近红外激光的照射下,溶液均显示出丁达尔效应,这一现象可证明溶液中有微小的粒子,即初步证明在溶液中分子之间以相互聚集的形式存在.

(a)中性 (b)酸性图4 丁达尔效应图
丁达尔效应强度随着浓度的变化而发生变化,因此可以推测出在溶剂中苝核的π-π堆积是与浓度相关的[17,18],并且苝核之间的聚集程度对整个水溶液体系的荧光性能具有一定影响.图5中溶液的浓度从左至右依次减小,在加入微量三氟乙酸后,自然光照条件下溶液的颜色没有发生任何变化,而在用345 nm的紫外光照射后显示出强烈的荧光,且荧光强度随浓度的增加而变强.但是中性下的溶液在自然光照和345 nm的紫外光照射后均无任何变化,由此可以说明合成的分子具有一定的荧光性能,并且有一定的pH响应性.

(a)自然光照

(b)345 nm紫外光照图5 不同光照下的显色图
通过UV-vis研究了CD-PDI-CD溶液浓度为1.0×10-4~1.0×10-6M范围内的吸光度变化,如图6所示.图6(a)为中性条件下的UV-vis图,图6(b)为酸性条件下的UV-vis图.在中性条件下,随着浓度的增加500 nm处的峰逐渐增强,且伴随着浓度的增加在545 nm处出现明显的肩峰,肩峰的出现说明在溶液中存在着聚集行为[19,20].酸性条件下,由于探针分子被质子化,500 nm处的峰和545 nm处的肩峰的强度随着浓度的增加而逐渐的上升,这与中性条件下峰值的变化趋势相同.但是质子化前后的峰值对比发现,质子化后500 nm和545 nm处的峰值均大于未质子化的峰值,且500 nm处峰的增幅远远大于545 nm处的峰的增幅.
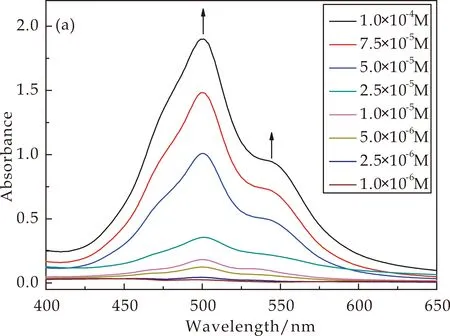
(a)中性
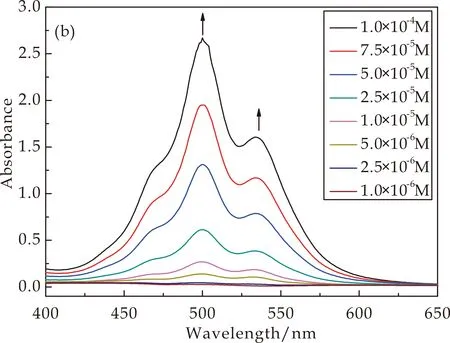
(b)酸性图6 不同条件下CD-PDI-CD溶液的UV-vis
出现这种现象的原因是:β-CD与PTCDA进行桥连,β-CD作为取代基提供水溶性的同时,亚氨基作为良好的电子供体的同时也是一个有效的质子键合位点,亚氨基与质子的结合使苝核之间具有一定的排斥性,所以可以通过pH来调节CD-PDI-CD溶液在水溶液中的聚集行为和荧光性能.氨基上的孤对电子向激发态的荧光基团发生电子转移导致荧光基团发生荧光猝灭.与未质子化的相比,质子化后的最高峰的峰值大于未质子化的峰值,说明质子化可以减少苝核之间的聚集,从而荧光性能也有所提高.
图7为CD-PDI-CD溶液浓度为1.0×10-4~1.0×10-6M范围内的荧光光谱曲线.其中,图7(a)、(c)为中性条件下浓度为1.0×10-6~1.0×10-5M范围内的荧光光谱曲线,图7(a)、(c)中均显示出随浓度的增加,荧光强度逐渐增强,发射峰发生小幅度的红移[15];图7(b)、(d)为酸性条件下浓度5.0×10-5~2.5×10-4M之间的荧光光谱曲线.由图7(b)、(d)可知,当浓度大于1.0×10-5M时,随着浓度的增加荧光强度都出现下降的趋势,这是由于分子之间自发的π-π堆积作用后分子之间的聚集程度增加,所以产生荧光自猝灭现象.
图7(a)和(c)之间形成鲜明对比,质子化后溶液的荧光光谱最大强度约是未质子化的4倍,质子化后荧光增强的原因有两个:一是由于质子化后分子上的亚氨基不再是电子供体,分子内的光诱导电子转移被阻断,所以相对于同浓度的溶液出现荧光增强.二是质子化后分子之间逐渐解聚,分子之间大范围的聚集体由于静电效应而趋向于形成更小的聚集体[13].
CD-PDI-CD溶液的荧光光谱图说明合成的探针分子是有荧光的,并且分子之间存在自猝灭效应.而荧光强弱的直接表现是绝对量子产率的大小,因此对溶液的绝对量子产率采用参比法进行计算,如表1所示.
图7显示溶液的浓度在1.0×10-5M时,中性(未质子化)和酸性(质子化)条件下荧光强度都是最强的,表1可以证实在浓度为1.0×10-5M下绝对量子产率在同一条件下都是最高的.如表1所示,随着浓度的增加,中性条件下和酸性条件下的绝对量子产率都呈现出下降趋势,但是当浓度为2.5×10-4M时,中性溶液的绝对量子产率变为0,证明此时溶液中分子之间存在很大程度的聚集.质子化后的绝对量子产率都远远大于未质子化的绝对量子产率,并且在浓度为1.0×10-5M时质子化后的绝对量子产率是未质子化的30倍,因此pH的变化对溶液的绝对量子产率有着很大的影响,即pH对荧光强度有影响,并且在酸性条件下荧光强度更强.

(a)中性条件,随浓度上升荧光强度上升
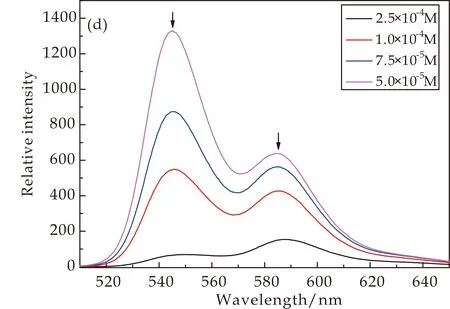
(d)酸性条件,随浓度上升荧光强度下降图7 不同条件下CD-PDI-CD溶液的Fluorescence(λex=500 nm,狭缝宽度=2.5 nm)

表1 不同pH条件下的荧光量子产率(%)
2.3 CD-PDI-CD水溶液中的聚集行为
通过TEM对CD-PDI-CD水溶液中的聚集行为进行表征,其表征结果如图8所示.图8(a)和(b)为pH等于7,浓度分别为1.0×10-4M和1.0×10-5M的TEM图;图8(c)和(d)为pH小于7,浓度分别为1.0×10-4M和1.0×10-5M的TEM图.从图8可以看出,在任何条件下,溶液中的分子都是以聚集的形式存在的.然而由于酸性条件下分子发生质子化,聚集体的分散度更高,即证明酸性条件对分子的聚集程度有一定影响.

(a)pH=7,1×10-4M (b)pH=7,1×10-5M

(c)pH<7,1×10-4M (d)pH<7,1×10-5M图8 CD-PDI-CD溶液聚集程度的TEM图
使用AFM对CD-PDI-CD水溶液中的聚集行为进行表征,其表征结果如图9所示.图9(a)和(b)所用溶液的pH等于7,(c)和(d)所用溶液的pH小于7.通过图9(a)、(b)与(c)、(d)对比可知,pH小于7的溶液中分子的聚集程度更小.浓度为1×10-4M与浓度为1×10-5M的AFM图相比,无论是在中性条件还是酸性条件,浓度为1×10-4M溶液中分子的聚集程度比浓度为1×10-5M溶液中分子的聚集程度更大.即可证明浓度的变化对分子的聚集程度有一定影响,但pH的变化对分子的聚集情况起着决定性作用.由此可以说明无论在何种条件下分子均以聚集态的形式存在,而酸性条件下分子聚集程度更小,从而在紫外光的照射下可以产生荧光,因此可以通过调节溶液的pH来调节溶液的荧光性能.

(a)pH=7,1×10-4M (b)pH=7,1×10-5M

(c)pH<7,1×10-4M (d)pH<7,1×10-5M图9 CD-PDI-CD溶液聚集程度的AFM图
通过以上的表征方式,可以确定浓度及pH对探针分子在水溶液中的聚集程度都有一定影响,而pH的影响十分显著.因此,如图10所示,推测出CD-PDI-CD在水溶液中的聚集程度因浓度和pH改变而发生变化的分子聚集模式图.

图10 溶液中浓度和pH依赖的聚集模式图[15]
2.4 CD-PDI-CD探针分子的应用
基于以上的表征,因此选取浓度为1×10-4M的溶液制作CD-PDI-CD中性荧光板.首先将溶液均匀涂于无荧光的硅胶板上,在60 ℃的烘箱内放置5 h,制作的荧光板如图11(a)所示,经测试在自然光照和345 nm紫外光照射下均无荧光.
图11(b)、(c)、(d)所对应的分别为pH=5.0,0.05 M的PBS溶液、pH=4.0,0.05 M的PBS溶液和冰醋酸分别涂抹于3块CD-PDI-CD中性荧光板上,在345 nm的紫外光照下的显色图.其中,(b)荧光板因为涂抹溶液的酸性最弱,所以显示出最弱的黄色荧光;而冰醋酸(d)因为酸性最强而显示出最强的黄色荧光;(c)荧光板涂抹溶液的酸性介于中间,所以显示出的荧光也处于中等水平,由此可证明随着酸性的增强,荧光逐渐增强.并且在测试过程中,30 min内荧光稳定.因此合成的荧光探针分子有望用于快速检测酸性溶液,并且可根据荧光的强弱判断酸性的强弱,荧光越强则酸性越强,此方法具有操作简单,易于辨别等特点.

(a)中性荧光板 (b)PBS,pH=5.0,0.05 M (c)PBS,pH=4.0,0.05 M (d)冰醋酸图11 345 nm紫外光照下,CD-PDI-CD荧光板涂抹不同酸性溶液的荧光显色图
3 结论
本文以β-环糊精为增溶取代基,3,4,9,10-苝四甲酸二酐为骨架,合成了一种基于的水溶性良好的具有pH响应性的荧光探针.β-环糊精水溶性良好的取代基同时给整个分子骨架提供了大的空间位阻,使苝酰亚胺衍生物中苝核的π-π堆积减弱,从而达到合成拥有良好水溶性和pH响应的荧光性能探针分子.亚氨基作为电子供体对调节苝酰亚胺衍生物的光学性质起到关键作用,质子化之前亚氨基上的孤对电子有效的淬灭激发态苝酰亚胺的荧光,质子化后亚氨基带上正电荷,起到静电斥力的作用使得聚集体的堆积作用减弱,苝核之间的π-π堆积减弱,因此可以通过调节pH控制分子的聚集和调节荧光性能,并且对于不同酸性的在345 nm紫外光照射下可发出不同程度的荧光有望应用于对不同酸性溶液的快速检测.

