CYP2C19 多态性对健康志愿者单剂量口服埃索美拉唑PK 的影响*
黄 旭,孙国先,2,沈怡雯,张宏文,谢利军,陈 娟,刘 晋,刘 云,丁 黎,孙鲁宁**,王永庆**
1 南京医科大学第一附属医院 临床药理研究室,南京 210029;2 扬州大学附属医院 药剂科,扬州 250001
埃索美拉唑是奥美拉唑S 型异构体,于2003年在我国上市销售。临床常用于治疗胃及十二指肠溃疡、反流性食管炎和卓-艾综合征等酸相关性疾病。本品口服吸收后在肝内大约27%经CYP3A4 代谢,其余经CYP2C19 代谢,并产生3 种非抑酸活性产物排出体外[1]。CYP2C19 是一种重要的药物代谢酶。CYP2C19 基因位点突变,通常会引起CYP2C19酶活性降低或升高,从而导致个体间临床治疗效果的差异[2]。
鉴于埃索美拉唑主要代谢途径CYP2C19 的基因多态性[3,4],本研究通过比较38 名健康志愿者不同CYP2C19 基因分型的药动学参数,初步探讨其对埃索美拉唑药动学的影响。
1 材料与方法
1.1 仪器与设备
Triple Quad TM 5500 串联质谱仪,配Analyst 1.4.2 数据处理系统(AB Sciex);CPA225D 分析天平(Sartorius);PCR 反应扩增仪(ABI 公司);H6-1 微型电泳槽(上海精益有机玻璃制品仪器厂);SC850凝胶成像系统(上海山富科学仪器有限公司);3730XL 测序仪(ABI 公司)。
1.2 药品与试剂
埃索美拉唑镁肠溶片,每片40 mg,批号:ZGGB,阿斯利康制药有限公司生产。
乙腈为色谱纯;醋酸铵为分析纯;试验用水为超纯水。
1.3 研究对象
筛选38 名健康受试者,年龄18~35 岁,体重指数19~27 kg·m-2,试验前经病史询问,既往无烟酒嗜好,无药物过敏史及既往严重病史;对埃索美拉唑或质子泵抑制剂类药物或本品不过敏;体格检查和实验室检查(心电图、血压、血常规、尿常规、肝肾功能、病毒学)未发现有临床意义的异常;2 周内未服用任何药物。
试验方案和知情同意书均经南京医科大学第一附属医院伦理委员会审核批准。
1.4 研究方案
38 名受试者禁食10 h,次日早晨空腹口服埃索美拉唑镁肠溶片40 mg,240 mL 温开水送服,分别于服药前(0 h)和服药后1、1.5、1.75、2、2.25、2.5、2.75、3、3.5、4、5、6、7、8、10、12 h,在黄光灯下静脉采血。每个血液样品放置于预先标记好的含肝素钠的试管中(4 mL/管)。每次取血后在黄光灯下处理和分离血浆;置于超低温冰箱中保存(温度控制在-70±10 ℃)。血样采集后冷藏避光转运。服药后2 h 内禁水,4 h 内禁食。所采集的全血于4 ℃、3500 r·min-1离心8 min,对分离出的血浆样品进行分析。
1.5 埃索美拉唑镁血药浓度测定及药代动力学参数
1.5.1 色谱条件 选用Agilent 1290 Infinity 液相色谱仪,Zorbax Eclipse Plus C18柱(50 mm×2.1 mm,3.5 μm,Agilent),Security Guard Cariridges C18预柱(4 mm×3.0 mm,Phenomenex);流动相A:含0.05%甲酸和5 mmoL·L-1醋酸铵的水溶液,流动相B:100%甲醇梯度洗脱:A 50%(0~2 min),A 10%(2.3~2.6 min),A 50%(2.8~4.0 min);柱温:40 ℃;流速:0.4 mL·min-1;进样体积:7 μL(每个样品的分析时间为4 min)。
1.5.2 质谱条件 电喷雾离子源(ESI),正离子方式监测;电喷雾电压(IS):4000 V;温度:600 ℃;源内辅助气1(GS1,N2)压力:345 kPa;源内辅助气2(GS2,N2)压力:379 kPa;气帘气(CUR,N2)压力:276 kPa;碰撞气(CAD,N2)压力:9 Unit;扫描方式为多重反应监测(MRM)。检测离子通道为m/z 346.1→198.1(埃索美拉唑镁)和m/z 349.1→198.1(d3-埃索美拉唑),解簇电压(DP)分别为50 V 和55 V,碰撞能量(CE)分别为15 V 和14 V。
1.5.3 血浆样品处理 精密吸取血浆50 μL 置于1.5 mL 塑料离心管中,加入30 μg·mL-1内标工作液(d3-埃索美拉唑)50 μL,振摇1 min 后加入纯甲醇220 μg,继续强烈振摇10 min,于4000 r·min-1、10 ℃下离心10 min,取上清液20 μL 置于1.5 mL 塑料离心管中,以50%甲醇溶液480 μL 稀释,密封后充分振摇10 min,精密吸取100 μL 置于进样瓶中进行液质联用仪(LC-MS/MS)分析。
1.5.4 方法学验证 参照报道方法作单剂量口服40 mg 血浆中埃索美拉唑镁浓度测定的方法学考察,结果表明,方法的专属性好,埃索美拉唑镁线性范围为0.500~2000 ng·mL-1(r>0.99),精密度(RSD)≤15%;准确度(RE)在±15%的范围以内,平均提取回收率>90%,血浆样本低温储存稳定性好,符合方法学生物样本测定要求。
1.6 基因分型方法
CYP2C19*2(rs4244285)、CYP2C19*3(rs4244285)测定采用PCR 扩增和测序的方法,由上海生工生物工程有限公司完成。①提取基因组DNA 用采血针抽取每名受试者静脉血2 mL,置于枸橼酸钠抗凝管中,充分混匀,从中吸取500 mL 全血,用天根血液基因组DNA 提取试剂盒(离心柱型)提取基因组DNA。②PCR 引物CYP2C19*2 位点扩增的正向引物:TACAACCAGAGCTTGGCAT,反向引物:CCTTGACCTGTTAAACATCCGTA;CYP2C19*3 位点扩增的正向引物:ATGCATGCCAAACTCTTTTT,反向引物:CTCCAAAGTGCCTGGATGTC。③PCR 反应体系10X Taq Buffer 缓冲液2.5 μL,25 mmol·L-1MgCl22.0 μL,10 mmol·L-1dNTP Mix 0.5 μL,模板DNA 1.0 μL,正、反向引物(10 pmol·μL-1)各1.0 μL,Taq DNA 聚合酶(5 U·μL-1)0.5 μL,灭菌去离子水加至25 μL。④PCR 扩增条件:第一步94 ℃预变性5 min;第二步94 ℃变性20 s,63 ℃退火30 s,72 ℃延伸40 s,进行10 个循环;第三步96℃变性20s,58℃退火20s,72℃延伸40s,进行36 个循环;第四步72℃继续延伸5min,并于10 ℃复性7 min,得到目标片段长度:CYP2C19*2 为476 bp,CYP2C19*3 为679 bp。⑤确定基因型:测序结果与人类基因库中的CYP2C19*2、CYP2C19*3 基因序列比对,确定待测突变位点上的基因型。
1.7 数据处理
埃索美拉唑的血药浓度用LC-MS/MS 法测定,色谱图用Analyst 1.4.2 程序分析,主要药动学参数和药-时曲线采用Phoenix WinNonlin 软件计算,消除数率常数(ke)由血药浓度对时间的半对数图斜率求算;消除半衰期(t1/2)以公式求算:t1/2=0.693/ke;AUC采用梯形法计算,Tmax和ρmax采用实测值。其他药代动力学参数还包括清除率(CL)、表观分布容积(Vd)。
采用SPSS 17.0 软件进行数据分析,受试者按CYP2C19 代谢型分组,分为EM 组(CYP2C19*1/*1)、IM 组(CYP2C19*1/*2 和CYP2C19*1/*3)和PM组(CYP2C19*2/*2 和CYP2C19*2/*3)。采用非参数Kruskal-Wallis 检验。P<0.05 为显著性差异。以ρmax、Tmax、AUC0-12h、AUC0-∞、t1/2、CL/F、Vd/F 作为应变量,分别以基因型(X1)、性别(X2)分组作为自变量,与每个应变量构建线性回归方程。采用逐步回归筛选变量方法(后退法),剔除标准P>0.1,得到以下回归方程:F=a+b1X1+b2X2。
2 结果
2.1 CYP2C19 基因型分布及人口学数据
以38 例受试者PCR 扩增产物测序结果与人类基因库中CYP2C19 基因序列比较,得出基因分型结果,携带CYP2C19*1/*2 基因型的比例最高,达57.9%;携带CYP2C19*2/*3 基因型的比例最低,为5.3%。分布结果经检验符合Hardy-Weinberg 平衡(P<0.05)。按代谢型分类,属于IM 组的为26 例,占68.4%;属于EM 组的为10 例,占26.3%;属于PM组最少,占5.3%。见表1。
2.2 血药浓度-时间曲线
38 例受试者分成3 组代谢型,每组用浓度均值作血药浓度-时间曲线图,见图1。从图1 可见,EM组的血药浓度达峰时间明显早于PM 组,也略早于IM 组,浓度明显低于PM 组和IM 组。
2.3 不同代谢组药动学参数比较
单剂量口服给药后,3 个代谢组Kruskal-Wallis检验结果显示:除Tmax无显著差异(P=0.413),其余PK 参数均有显著差异(P<0.05);对后者采用Bonferroni 法校正显著性水平作两两比较发现,PM 和IM 各参数间,均无显著差异(P>0.05);PM 和EM 比较,ρmax、Tmax、AUC0-12h、AUC0-∞、t1/2、均有显著差异(P<0.05);EM 和IM 比较,除Tmax外,其余参数均有显著差异(P<0.05)。不同代谢组PK 参数见表2。

表1 不同基因型试验对象人口学数据
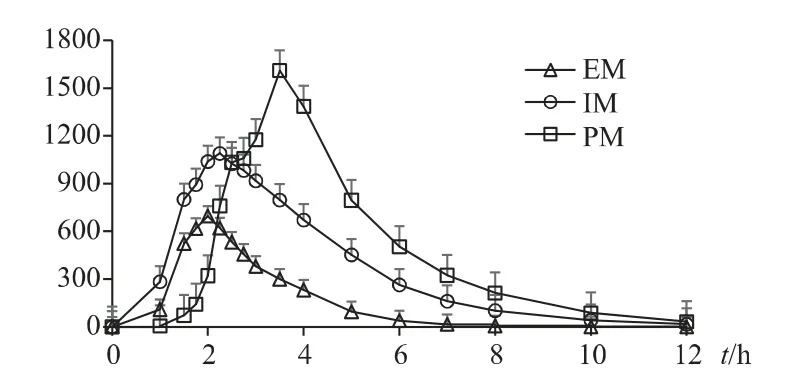
图1 CYP2C19 不同代谢型的平均血药浓度-时间曲线

表2 CYP2C19 不同代谢组的药动学参数
2.4 多元线性回归分析
多元回归分析结果显示,应变量Tmax与自变量年龄和基因型分组均不相关,相关系数分别为0.155、0.012,其余药动学参数与年龄和基因型分组相关。见表3。

表3 PK 参数差异的影响因素多元回归分析
3 讨论
本研究显示,38 例受试者单剂量空腹口服埃索美拉唑镁肠溶片40 mg 后,药动学参数与该药相同剂量国内外文献的报道[5,6]基本一致。
CYP2C19 在中国人群中有两个常见的等位基因变异体,即 CYP2C19*2 和 CYP2C19*3。CYP2C19*2 可导致剪接缺失,CYP2C19*3 引起终止密码子突变。有报道称[7,8],CYP2C19*2 所致PM 在东方人群中发生率为75%~85%,CYP2C19*3 所致的PM 为20%~25%。另有文献证实[9],CYP2C19*2和CYP2C19*3 等位基因纯合的受试者是CYP2C19底物表型差的慢代谢者,在中国人群的发生率为15%~17%。另一个等位基因变异体CYP2C19*17 编码的CYP2C19 酶活性增强,在欧洲白人及非洲黑人人群中占15%~25%。但是,中国人群的突变发生率仅为0.5%~4%[7]。
本研究采用PCR 扩增和测序的方法,发现CYP2C19 不同基因型中PM 组受试者2 例,占5.3%。与已发表的中国人群结果不相一致[7],可能与地区人群遗传特征差异及样本量较少有关。
由本试验结果看出,CYP2C19 基因对不同代谢型埃索美拉唑血药浓度影响明显,这从图1 可见,从服药后2.5 h 起,3 组间埃索美拉唑的血药浓度为PM>IM>EM,表明CYP2C19 与埃索美拉唑代谢密切相关。鉴于慢代谢组只有2 人,PK 参数非正态分布,3 组代谢型Kruskal-Wallis 检验显示:除Tmax无显著差异(P>0.05),其余PK 参数均有显著差异(P<0.05),这与回归分析结果相同。各代谢组进一步两两比较,在PM/IM 比较中,PK 参数均差异不显著(P>0.05)。EM 和另两组比较,AUC 与ρmax均差异显著(P<0.05),说明空腹状态下口服埃索美拉唑镁肠溶片吸收速度及达峰时的暴露量不同。EM 和另两组的t1/2差异显著(P<0.05),可见EM 的药物清除快于IM 和PM。此外,本研究发现,性别和基因型分组可对PK 参数有影响,线性回归方程分析认为,除Tmax之外,代谢型分组和性别与其它PK 参数线性相关(P<0.05)。因此,依据基因型分组的药代动力学参数比较结果能够部分解释各组代谢类型,这与Hunfeld NG、Lou HY 等[5,10]研究结果一致。
国内外多个临床研究表明[11-13],埃索美拉唑的疗效与CYP2C19 基因型无关,在酸控制方面人际差异少。然而,本研究从药动学角度揭示了CYP2C19 基因多态性对PK 参数的影响,并为临床疗效的差异提供了佐证。由于本研究共入选38 名健康受试者,样本例数较少,研究结果仍需要大样本的临床试验来支持。

