高分辨外周骨定量CT评估阻塞性睡眠呼吸暂停患者的骨质情况
乔一娴,肖 毅,夏维波,罗金梅,黄 蓉,王晓娜,苏琳凡
中国医学科学院 北京协和医学院 北京协和医院 1呼吸与危重症医学科 2内分泌科 国家卫生健康委员会内分泌重点实验室,北京 100730
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)以睡眠时重复的上气道塌陷或狭窄为特征,引起夜间间歇性低氧、睡眠片段化、打鼾及日间嗜睡,在人群中的发病率2%~4%,在肥胖人群中的发病率高达35%~45%[1- 2]。OSA常引起其他系统的并发症,如高血压、心律失常、中风等,严重增加了患者的病死率及死亡率。骨质疏松症是一种常见的慢性骨骼系统疾病,以骨量的减少及骨微结构的破坏为特征,引起骨强度下降、骨骼脆性增加、骨折发生率升高[3],是老年人死亡率及病死率升高的重要危险因素之一,早期的识别及治疗可以有效降低后期的骨折率。目前已有大量研究证实,OSA与多种慢性疾病如冠心病、2型糖尿病及高血压等密切相关,但关于OSA和骨代谢的研究甚少[4- 7]。有研究认为,OSA所引起的夜间低氧、继发的炎症反应、内皮功能障碍、氧化应激等会干扰正常的骨代谢[8- 13],但也有研究认为,OSA的间歇性低氧可以刺激间充质干细胞动员,增强成骨作用[4],尤其对年龄相关的骨密度减少具有一定的保护作用[7]。OSA患者常为超重或肥胖体型,有研究认为OSA患者较大的体重所产生的机械性负荷对骨的形成可能具有一定的正面作用[14]。2016年,Upala等[15]对前人的研究成果进行荟萃分析显示,在队列研究中,OSA患者的骨质疏松发生率高于对照组,但在横断面研究中未发现两者具有相关性。因此,目前对于OSA和骨质疏松之间是否具有联系仍具有争议。双能X线吸收仪(dual energy X-ray absorptiometry,DEXA)为传统的测量骨密度的工具[8],目前国内外的研究绝大部分采用DEXA对OSA患者进行骨质情况的评估,但该方法存在两大不足。首先,体表层叠的软组织会引起X射线的衰减,形成射束硬化伪影,故DEXA在测量肥胖患者[体质量指数(body mass index,BMI)≥25 kg/m2]的骨密度时准确度欠佳,而OSA患者多数为超重或肥胖体型[16- 17]。其次,DEXA只能检测骨质的二维特性,对体积骨密度及骨微结构评估不足,得到的结果非常狭隘。高分辨外周骨定量CT(high-resolution peripheral quantitative computed tomography,HR-pQCT)是一种新型的、无侵袭性、低辐射的评估骨质的方法,通过重建人体骨骼三维立体结构,测得体积骨密度和骨微结构的定量参数,不受体型的影响,其敏感性及特异性均高于传统的DEXA[18]。本研究利用HR-pQCT的检测技术,检测不同严重程度的OSA患者及对照组的骨强度及结构,寻找其在骨几何参数、体积骨密度及骨微结构等方面的差异,探寻OSA和骨质疏松症的联系。
对象和方法
对象连续收入2017年8月至2019年1月于本院睡眠呼吸中心就诊的男性患者,年龄30~59岁,BMI≤30 kg/m2。对照组纳入因各种原因就诊于本院行多导睡眠监测但结果阴性的人群。其中,符合以下条件的需被排除:(1)中枢性睡眠呼吸暂停;(2)患有影响骨骼代谢的疾病,如甲状腺功能低下/亢进、原发性甲状旁腺功能低下/亢进、肢端肥大症、库欣综合征、慢性肾脏疾病、恶性肿瘤及胶原血管病等;(3)患有急性病、心血管疾病、颅面部畸形、肺病、神经系统疾病或心理疾病;(4)已经接受过持续正压通气治疗;(5)近5年有制动史或长期使用轮椅的记录;(6)摄入影响骨代谢的药物,如抗骨质疏松药、糖皮质激素、钙剂、维生素D、甲状旁腺素、骨钙素、双磷酸盐、安眠药、质子泵抑制剂、抗凝血药、抗惊厥药及化疗药等。本研究符合最新版的赫尔辛基宣言,已通过本院伦理委员会审查(审查号:ZA- 1502),所有患者均签署知情同意书。
一般资料所有纳入者均记录身高、体重,计算BMI。颈围的测量位置为喉结下0.5 cm水平,腰围的测量位置为第12前肋下缘和髂脊的中点水平,臀围则为髋骨上缘最突出的水平,并计算腰臀比(腰部与臀部围度的比值)。采用标准水银柱血压计量取血压值,测量前嘱研究对象坐位休息5 min,于右臂测量2次,间隔1 min以上,取平均值。所有入组者需详细记录疾病史、用药史、吸烟饮酒史等。
问卷所有入组者均行爱普沃茨睡眠量表(Epworth sleepiness scale,ESS)评分,评估其日间嗜睡症状的严重程度。问卷提供了8种情景,根据调查者在此情景下有无犯困症状及犯困的程度,分别予0~3分,总分0~24分,分数越高,日间嗜睡症状越严重。
睡眠监测所有纳入者均行夜间多导睡眠监测(polysomnography,PSG)(Embla N7000),监测时间为晚23∶00(熄灯)至次日晨6∶00(开灯),期间持续进行脑电、心电、肌电、呼吸气流、胸腹运动及指尖氧饱和度等的监测。睡眠及呼吸事件参照美国睡眠医学会颁布的细则(v2.3)进行分图,根据指南将呼吸暂停事件定义为呼吸气流较基线下降90%,持续10 s以上;低通气事件定义为呼吸气流较基线下降30%,持续10 s以上,同时伴氧饱和度下降3%以上或微觉醒。呼吸暂停低通气指数(apnea-hypopnea index,AHI)为每小时发生呼吸暂停或低通气事件的次数,AHI≥5 次/h可以诊断OSA。依据AHI将符合OSA的患者分为轻度(5 次/h≤AHI<15 次/h),中度(15 次/h≤AHI<30 次/h)以及重度(AHI≥30 次/h)3组,同时纳入平均血氧饱和度、最低血氧饱和度及血氧饱和度低于90%的时间占睡眠总时间(total sleep time,TST)的百分比(TST<90%)作为夜间氧合情况的评估指标。睡眠效率则定义为TST/总记录时间×100%。
HR-pQCTHR-pQCT(Xtreme CTII;Scanco Medical AG,Bruttisellen,瑞士)采用标准模式(68 kVp,1462 μA,100 ms),分辨率为61 μm。测量时被检查者需保持安静,测量部位选非优势侧的胫骨及桡骨。每个部位共采集168张CT层面,由同一位医师进行描图分析。事后通过重建人体骨骼的三维立体结构,得到以下指标:(1)骨几何参数:总骨面积(total area,Tt.Ar)、皮质骨周径(cortical perimeter,Ct.Pm)、皮质骨面积(cortical area,Ct.Ar)、骨小梁面积(trabecular area,Tb.Ar);(2)骨密度指标:总体积骨密度(total volumetric bone mineral density,Tt.vBMD)、松质骨体积骨密度(trabecular volumetric bone mineral density,Tb.vBMD)、皮质骨体积骨密度(cortical volumetric bone mineral density,Ct.vBMD);(3)骨微结构指标:骨小梁体积分数(trabecular bone volume fraction,BV/TV)、骨小梁数量(trabecular number,Tb.N)、骨小梁厚度(trabecular thickness,Tb.Th)、骨小梁分离度(trabecular separation,Tb.Sp)、皮质骨厚度(cortical thickness,Ct.Th)、皮质骨孔隙度(intra-cortical porosity,Ct.Po)[18]。
统计学处理数据分析采用SPSS软件(v25.0,IBM,USA)。所有数据均进行正态性检验,正态分布数据、倾斜数据及分类数据分别表示为均数±标准差、中位数(四分位数方差)及比例(百分比)。4组间平均数的比较:正态分布的连续型变量采用单因素方差分析(事后比较:方差齐者选用Bonferroni法进行校正,方差不齐者选用Games-Howell法),非正态分布的连续型变量则采用Kruskal-Wallis H(K)检验,分类变量采用卡方检验。两个变量间的相关性:正态分布的连续型变量采用Pearson相关性分析,否则采用Spearman相关性分析。采用逐步多元回归分析(设置P<0.05时引入,P≥0.1时剔除相关变量)寻找影响骨密度及骨微结构等的独立影响因素。上述结果呈现为95%的可信区间,P<0.05为差异有统计学意义。
结 果
一般资料与睡眠监测本研究共纳入83名受试者,总体平均年龄为(46.6±5.8)岁,平均BMI(25.7±2.1)kg/m2。其中,轻、中、重度及非OSA组的人数分别为21、18、34及10人。4组人群在年龄、血压(包括收缩压、舒张压及平均压)、部分体型指标(腰围、臀围及腰臀比)以及ESS评分等方面差异均无统计学意义(P>0.05),但在BMI和颈围上差异有统计学意义(F=4.234,P=0.008;F=3.100,P=0.031)(表1)。将4组数据进一步行两两比较显示,重度OSA组的BMI明显大于对照组及轻度OSA组(P=0.043,P=0.041),重度OSA组的颈围明显大于对照组(P=0.031)。各组人群合并代谢性疾病(如高血压、糖尿病及血脂异常等)的比例及不良生活习惯(抽烟、饮酒)等方面差异无统计学意义(P>0.05)。多导睡眠监测显示,4组人群在TST、睡眠效率以及N1、N2、N3、快眼动(rapid eye movement,REM)期所占的比例方面差异均无统计学意义(P>0.05)。重度OSA患者的夜间氧饱和度水平明显差于另外3组,主要表现为夜间平均血氧饱和度、最低血氧饱和度均低于另外3组(χ2=20.164,P=0.000;χ2=38.136,P=0.000),且TST<90%明显高于另外3组(χ2=3.257,P=0.000)(表1)。
HR-pQCTHR-pQCT结果显示,4组研究对象桡骨的各指标差异均无统计学意义(P>0.05)。4组胫骨骨几何参数指标Ct.Ar差异有统计学意义(F=3.937,P=0.011);骨微结构指标Tb.Th及Ct.Th差异有统计学意义(F=6.247,P=0.001;F=3.746,P=0.014)(表2)。进一步两两比较可见,重度OSA组的Ct.Ar明显高于轻度OSA组(P=0.019);对照组的Tb.Th明显高于轻、中度组(P=0.006,P=0.001)。
相关性分析结果年龄与桡骨的Tt.vBMD(r=-0.312,P=0.004)、Tb.vBMD(r=-0.285,P=0.009)、Ct.vBMD(r=-0.278,P=0.011)、BV/TV(r=-0.300,P=0.006)、Tb.Th(r=-0.265,P=0.015)以及胫骨的Tt.vBMD(r=-0.328,P=0.002)、Tb.vBMD(r=-0.270,P=0.014)、BV/TV(r=-0.254,P=0.021)、Tb.Th(r=-0.280,P=0.010)、Ct.Th(r=-0.263,P=0.016)呈负相关。BMI则与桡骨的Ct.Ar(r=0.391,P=0.000)、Tt.vBMD(r=0.240,P=0.029)、Tb.vBMD(r=0.317,P=0.004)、BV/TV(r=0.325,P=0.003)、Tb.N(r=0.256,P=0.019)、Tb.Th(r=0.299,P=0.006)、Ct.Th(r=0.295,P=0.007)以及胫骨的Ct.Ar(r=0.473,P=0.000)、Tt.vBMD(r=0.369,P=0.004)、Tb.vBMD(r=0.363,P=0.015)、BV/TV(r=0.367,P=0.013)、Tb.Th(r=0.416,P=0.010)、Ct.Th(r=0.389,P=0.000)呈正相关。在反应体型的其他指标中,尤其臀围也与桡骨和胫骨的多项指标成正相关(r>0,P<0.05)。血压(包括收缩压、舒张压及平均压)及ESS评分与各项骨指标相关性不大(P≥0.05)。在PSG所测得的数据中,AHI、反应夜间氧和情况的3项指标(包括最低氧饱和度、平均氧饱和度及TST<90%)与各项骨指标均无相关性(P≥0.05)。另外,桡骨的多项指标,包括Ct.Ar、Th.Ar、Tt.vBMD、Tb.vBMD等均显示与睡眠效率呈正相关(r>0,P<0.05)(表3)。

表1 OSA患者及对照组的一般临床资料及睡眠监测数据Table 1 Demographic characteristics and polysomnography data of OSA patients and controls
1 mmHg=0.133 kPa;OSA:阻塞性睡眠呼吸暂停;BMI:体质量指数;ESS:爱普沃茨睡眠量表;AHI:呼吸暂停低通气指数;TST:总睡眠时间;TST<90%:血氧饱和度<90%所占总睡眠时间的比例;N1/2/3:非快眼动1/2/3期;REM:快眼动
OSA:obstructive sleep apnea;BMI:body mass index;ESS:Epworth sleep scale;AHI:apnea-hypopnea index;TST:total sleep time;TST<90%:percentage of TST with SpO2<90%;N1/2/3:non-rapid eye movement stage 1/2/3;REM:rapid eye movement
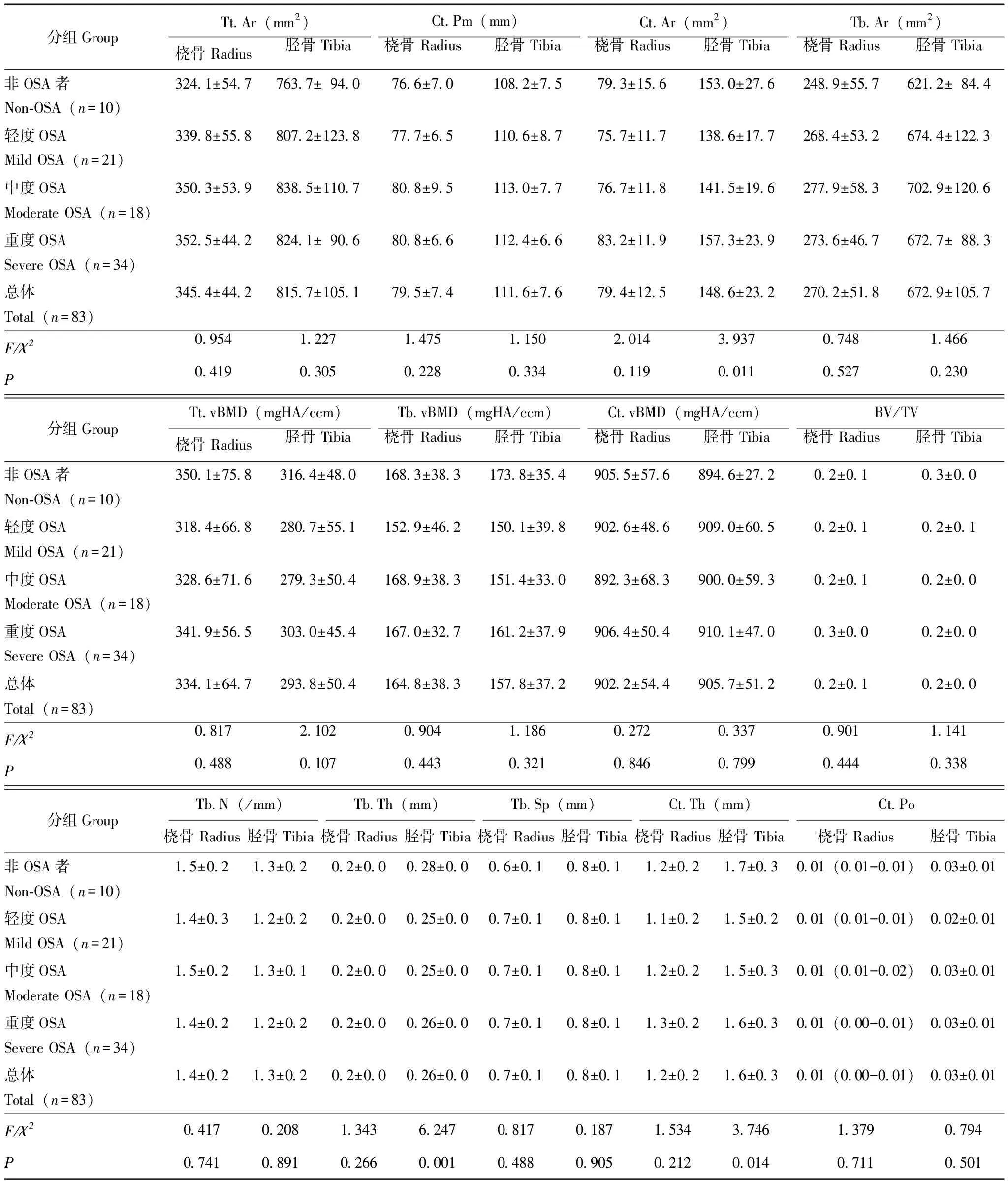
表2 OSA患者和对照组的高分辨外周骨定量CTTable 2 High resolution peripheral quantitative computed tomography of OSA patients and controls
Tt.Ar:总骨面积;Ct.Pm:皮质骨周径;Ct.Ar:皮质骨面积;Tb.Ar:骨小梁面积;Tt.vBMD:总体积骨密度;Tb.vBMD:松质骨体积骨密度;Ct.vBMD:皮质骨体积骨密度;BV/TV:骨小梁体积分数;Tb.N:骨小梁数量;Tb.Th:骨小梁厚度;Tb.Sp:骨小梁分离度;Ct.Th:皮质骨厚度;Ct.Po:皮质骨孔隙度
Tt.Ar:total area;Ct.Pm:cortical perimeter;Ct.Ar:cortical area;Tb.Ar:trabecular area;Tt.vBMD:total volumetric bone mineral density;Tb.vBMD:trabecular volumetric bone mineral density;Ct.vBMD:cortical volumetric bone mineral density;BV/TV:trabecular bone volume fraction;Tb.N:trabecular number;Tb.Th:trabecular thickness;Tb.Sp:trabecular separation;Ct.Th:cortical thickness;Ct.Po:intra-cortical porosity
多元回归分析结果采用多元逐步回归进一步分析显示,骨指标多与体型指标、年龄有关,各项指标与AHI均无相关性。胫骨的Ct.Ar、Tb.Th、Ct.Th均仅与年龄和体型指标相关,表现为与BMI呈正相关(β=0.723,P=0.000;β=0.494,P=0.000;β=0.698,P=0.000),与年龄(β=-0.025,P=0.016;β=-0.306,P=0.003;β=-0.299,P=0.002)和颈围(β=-0.353,P=0.005;β=-0.331,P=0.015;β=-0.458,P=0.000)呈负相关。另外,睡眠效率显示与多项骨指标呈相关性,包括桡骨的Ct.Ar、Tt.vBMD、Tb.vBMD、BV/TV、Tb.Th、Ct.Th(β=0.234,P=0.022;β=0.312,P=0.002;β=0.231,P=0.023;β=0.280,P=0.007;β=0.202,P=0.042;β=0.332,P=0.002);夜间平均血氧饱和度则显示与桡骨的Tt.vBMD、Tb.Th(β=-0.249,P=0.012;β=-0.221,P=0.027)及胫骨的Tt.Ar、Ct.Pm及Tb.Ar(β=0.233,P=0.029;β=0.235,P=0.028;β=0.242,P=0.025)均呈相关性(表4)。

表3 HR-pQCT与一般资料和睡眠情况的相关性Table 3 Correlation of HR-pQCT with general information and sleep status
HR-pQCT:高分辨外周骨定量CT;aP<0.05,bP<0.01
HR-pQCT:high-resolution peripheral quantitative computed tomography;aP<0.05,bP<0.01
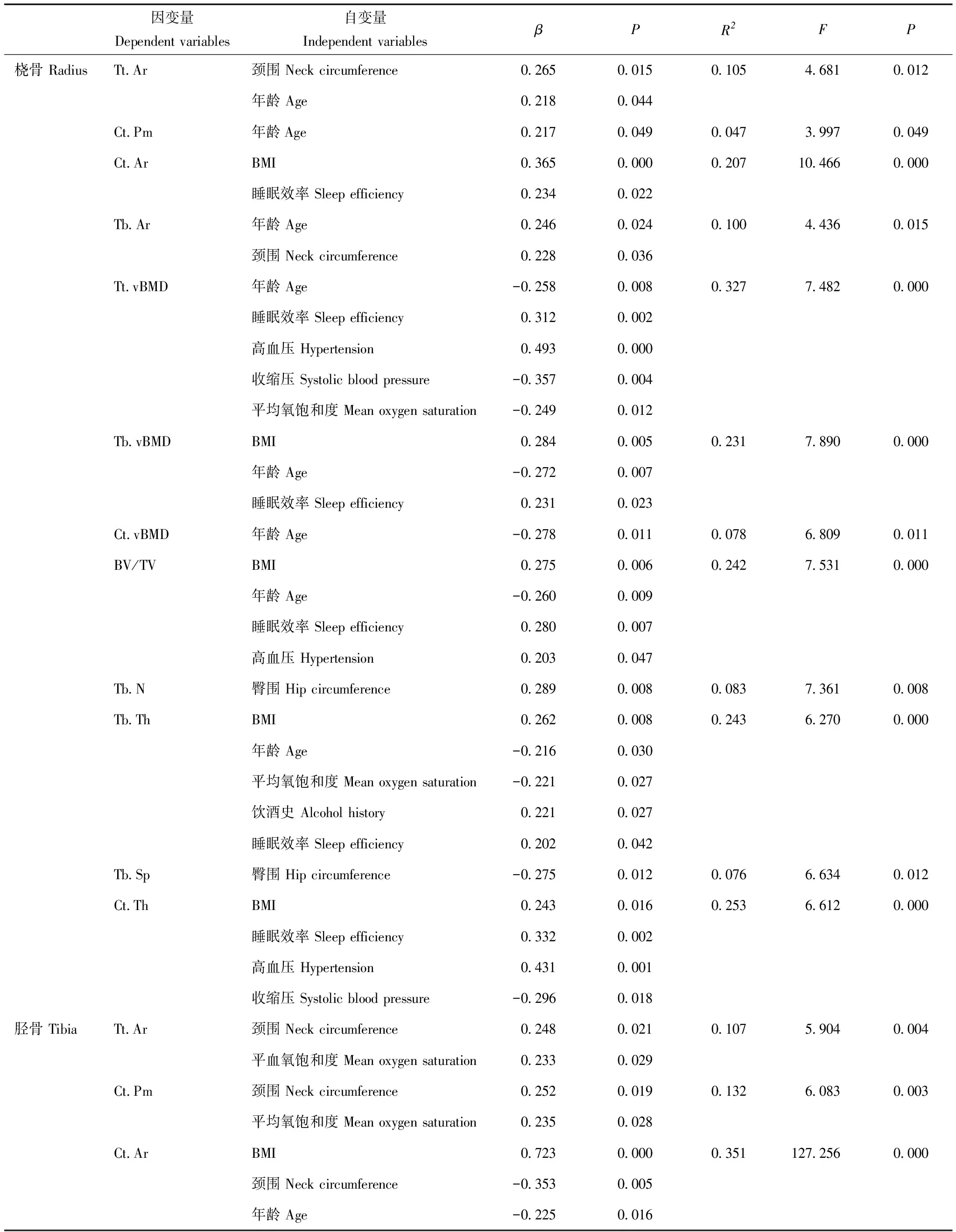
表4 HR-pQCT指标的逐步多元回归分析Table 4 Stepwise multivariate regression analysis of HR-pQCT data
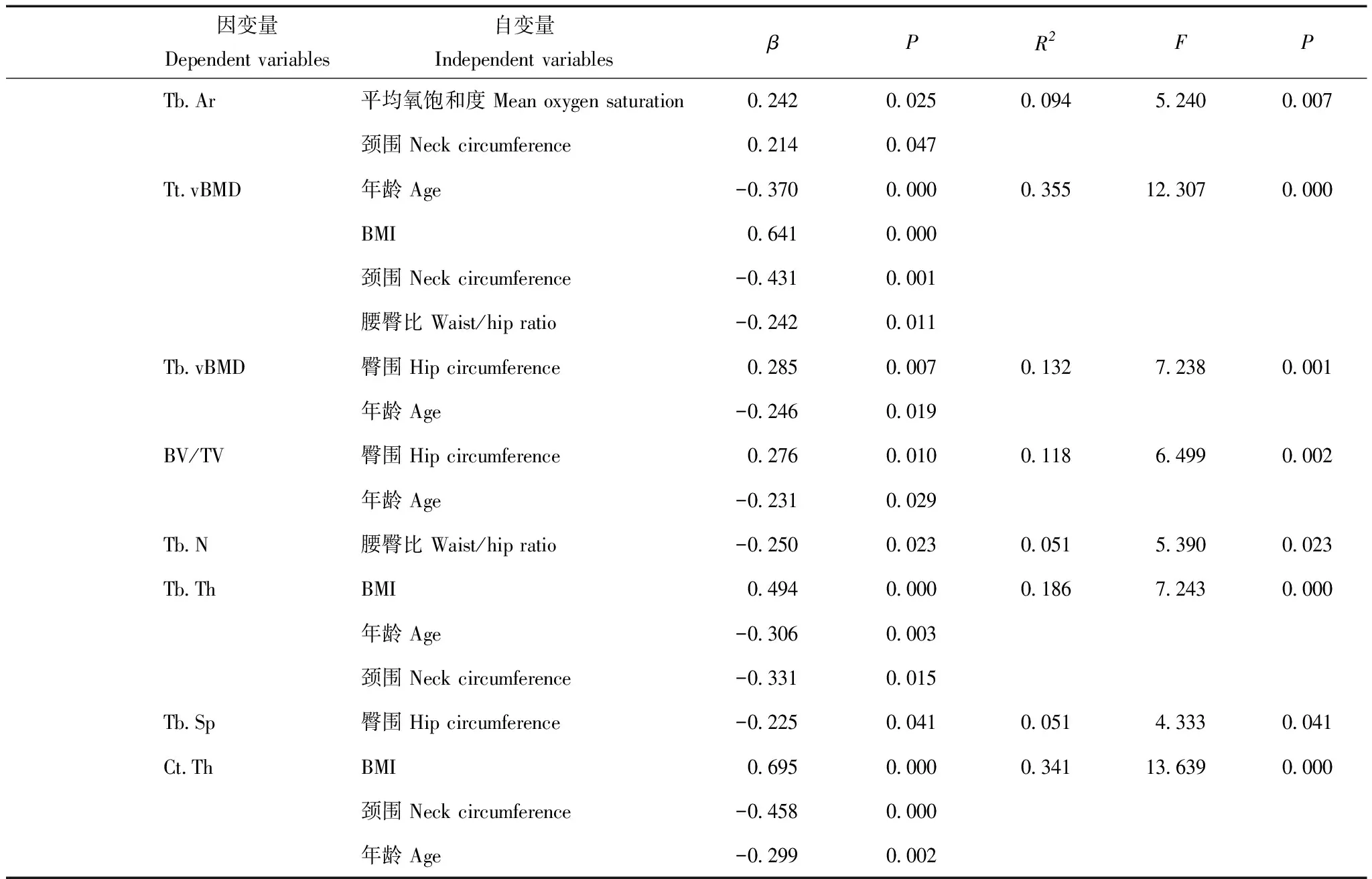
续表4
讨 论
本研究显示,在非老年男性人群中,OSA主要引起胫骨Tb.Th、Ct.Th的下降。骨强度及结构的改变主要与年龄及体型相关,在一定范围内,骨质与年龄的增长呈负相关,与体重的增长呈正相关,与睡眠效率及OSA相关的夜间平均血氧饱和度的下降亦具有一定的相关性。
本研究所有受试者采用随机方式入组。既往研究显示,肥胖与颈围的增粗为OSA的重要危险因素[19],这一点与本研究一致。另外,4组研究对象在ESS评分上差异无统计学意义,考虑本研究入组的OSA患者本身日间嗜睡症状不明显,即患者虽然有夜间打鼾的症状,但未导致严重的日间嗜睡表现,且ESS评分量表受患者主观因素影响较大,可能存在一定程度的误差。各组间PSG监测结果的差异基本与其病情严重程度相一致。既往研究显示,OSA患者常引起深睡眠的减少、浅睡眠的增加,且与病情的严重程度有关[20- 21]。本研究4组受试者的睡眠分期差异无统计学意义,考虑可能与样本量偏少及单次睡眠监测存在一定的误差有关。
本研究4组人群在胫骨指标上的差异较为明显,考虑可能原因为下肢的受重较大,体重对下肢骨的影响要大于上肢骨。OSA组与非OSA组的差异集中体现在胫骨的Tb.Th和Ct.Th上,表现为非OSA组的均值优于OSA组。相关性及回归分析显示,该两项指标仅与年龄及体型指标具有相关性,与包括AHI在内的其他OSA相关的指标无相关性,同时推测OSA组Tb.Th和Ct.Th水平下降的主要机制与其体型特点有关。同时,因重度OSA组的BMI较高,而BMI与Ct.Ar呈正相关,这一点可解释为什么重度OSA组的Ct.Ar较轻度OSA组偏高。另外,因睡眠效率与夜间平均血氧饱和度在回归分析水平上与多项指标呈现相关性,考虑睡眠效率与OSA相关的夜间氧饱和度的下降可能会对骨质产生一定的影响。
目前国内外关于OSA和骨质疏松相关性的研究仍较少,且结论尚未达成一致。2012年,Mariani等[14]招募了115例肥胖的OSA患者(56男性、59女性,BMI 30~40 kg/m2),利用DEXA测量其腰椎、总髂及股骨颈的骨密度(bone mineral density,BMD),经分析显示,不同严重程度的OSA患者之间未显示上述部位BMD的差异,回归分析亦未显示AHI和BMD有明确相关性。2013年,Sforza等[7]招募了832例老年OSA患者,利用便携式睡眠监测仪及DEXA检测显示,其股骨和脊椎的BMD均高于健康对照组,BMI、AHI和氧减指数与BMD均密切相关,故其认为OSA的低氧可以促进老年人的骨重建,该研究样本量充足,但所选用的仪器准确性不佳。2016年,Hamada等[22]对234名研究对象(180名男性、54名女性)通过CT进行评估,认为重度OSA患者的腰椎BMD低于正常对照组,但相关性分析显示,男性BMD水平主要受年龄、高血压、肺泡动脉氧分压差的影响,而女性则是年龄因素为主,该研究对照组的ESS评分较高,考虑不排除合并其他未察觉疾病的可能。2012年,台湾一个大样本的队列研究表明,OSA患者发生骨质疏松的概率是非OSA患者的2.74倍,但作者本人指出,该研究的对照组中可能混有未诊断的OSA患者,且不能完全排除诸如体重、年龄等对BMD带来的影响[8]。
与上述研究相比,本研究存在以下几大优势:首先,本研究为国内首例在CT层面上对OSA患者进行骨质情况的研究,从骨几何学参数、体积骨密度及骨微结构3方面对骨质进行系统的评估,类似的研究在国外亦非常稀少。其次,评估手段方面,PSG较便携式监测仪更准确,HR-pQCT则较DEXA更合理。再次,本研究对混淆因素的控制更为严格。在研究对象的选择上,因人体的骨质一般在60岁以后会有剧烈流失[23],故本研究招募的人群限制在60岁以下的非老年男性;因女性的骨密度受年龄及内分泌系统的影响很大,为求数据的准确性及一致性,本研究只纳入了男性人群。另外,本研究在数据分析阶段,排除了OSA患者因年龄、体型等问题对骨质产生的间接影响,从OSA疾病本身出发,探讨其与骨质疏松的关系。
本研究尚存在一些不足。首先,未评估入组者的营养状况、运动量等会影响到骨代谢的客观因素;其次,未添加血液里的相关骨代谢指标;另外,本研究未纳入女性患者及老年人,目前所得结论无法延伸至全部人群,且样本量偏少,未能发现各个组在睡眠分期上的明显差异。
综上,本研究借助HR-pQCT这一新型的检测手段探讨了OSA和骨质疏松的关系,考虑OSA对骨质的负面影响主要体现在胫骨骨皮质和骨小梁厚度的减少,骨质的改变主要与年龄和体型相关,与睡眠效率及OSA相关的夜间血氧饱和度水平亦具有一定的相关性。在将来,仍需纳入更大的样本量,涵盖更全面的人群,并从内部机制入手,进一步探索OSA和骨质疏松症的关系。

