乳酸菌对糯玉米黏豆包品质的影响
马佳歌 徐 丽 倪春蕾 张高鹏 郭莲东 程建军
(东北农业大学食品学院 哈尔滨 150030)
发酵谷物食品是通过自然环境或人工加入微生物而发酵所获得的制品,其具有特殊的风味及质地,具有较长的保存期[1]。糯玉米黏豆包是我国北方满族的一种民族特色食品,其历史悠久,深受人们的喜爱。黏豆包的传统生产多以糯玉米为主要原料,借助于自然环境和天然附着在谷物上的乳酸菌等有益微生物,初始乳酸菌数较低,发酵进程较为缓慢,产品质量不易控制[2]。随着消费者对食品安全的日益关注及食品工业的迅速发展,迫切地需要实现糯玉米黏豆包加工的标准化及规范化,而采用人工接种发酵剂正好能满足这一需求。与传统发酵谷物食品相比,在谷物制品中添加乳酸菌可以扩大所需微生物的数量,既能缩短发酵周期,提高品质的稳定性,又可使产品形成更好的风味化合物,改善食品的品质[3]。
为了阐明微生物在黏豆包发酵过程中的作用机制,李琦等[4]从糯玉米自然发酵过程中分离出优势植物乳杆菌,发现其具有生长量大,产酸速度快等优越性能。杨健等[5]采集不同东北黏豆包的发酵面团,经聚合酶链式反应-变性梯度凝胶电泳技术发现植物乳杆菌和条带丰度最高,此外柠檬明串珠菌、乳酸乳球菌等呈现多态性。乳酸菌作为发酵谷物中常用的发酵剂被人们广泛利用,在发酵过程中起优势主导菌群的作用。此外,也有很多关于乳酸菌复合发酵剂用于发酵谷物制品的报道,证实了其在产品质量及风味的改善,抑制致病微生物增殖等方面具有很大的优势[6-7]。
本试验前期确定了糯玉米黏豆包发酵剂的菌种及其配比,并对其培养基成分和培养条件进行了研究。在此基础上,将获得的发酵剂应用于糯玉米黏豆包的发酵生产中,探讨人工接种发酵获得的黏豆包新产品与传统自然发酵黏豆包成品的感官及质构品质,期望对黏豆包的标准化、工业化生产提供理论支撑。
1 材料与方法
1.1 材料与试剂
供试菌种:植物乳杆菌 (Lactobacillus plantarum A9)和弯曲乳杆菌 (Lactobacillus curvatus A2)是本实验室从黑龙江省哈尔滨市阿城区亚沟镇自然发酵的黏豆包样品中分离、筛选出的性状和发酵性能优良的两株优势乳酸菌,保存于东北农业大学食品学院实验室。肠膜明串珠菌(Leuconostoc mesenteroides LN1),植物乳杆菌(Lacto-bacillus plantarum V3),植物乳杆菌(Lactobacillus plantarum BG112)为商业购买的菌株。
培养基:MRS液体培养基:葡萄糖20 g/L,蛋白胨10 g/L,牛肉膏10 g/L,酵母浸粉5 g/L,乙酸钠 5 g/L,K2HPO42 g/L,柠檬酸铵 2 g/L,吐温-80 1 g/L,MgSO4·7H2O 0.58 g/L,MnSO4·4H2O 0.25 g/L,pH 6.8,121℃下高压灭菌20 min。
糯玉米糁:市售;玉米汁:将糯玉米糁粉碎,加水1 L后于80℃下煮2 h,边煮边捣碎然后用纱布过滤,最后补足失水至所需体积。其余试剂均采用分析纯。
1.2 仪器与设备
SW-CJ-1D型超净工作台,苏州净化设备有限公司;HZQ-F100型恒温振荡培养箱,哈尔滨市东联生化仪器有限公司;TDL-40B型离心机,上海安亭科学仪器有限公司;TA-XT Plus物性测定仪,英国SMSTA公司。
1.3 方法
1.3.1 pH和酸度的测定 发酵液的pH值使用具有E-201-C型电极的pH计进行测量。总酸度的测定采用滴定酸度法,参照GB5009.239-2016和董英丽等[8]的研究方法。
1.3.2 活菌总数的测定 采用平板菌落计数法[9]。
1.3.3 黏豆包发酵剂的研究 分别将5株乳酸菌以体积分数3%的接种量接入100 g/L脱脂乳培养基中,控制发酵温度为37℃,每隔4 h取发酵液测定其pH和发酵液的酸度,通过菌株的产酸特性及活菌数,确定用于发酵生产黏豆包的发酵菌株。
1.3.4 黏豆包发酵剂培养基的研究 在预试验的基础上,确定脱脂乳添加量、碳源、氮源及营养因子的种类和添加量,采用按表1所示的因素水平表设计 L16(45)的正交试验。

表1 正交试验方案设计Table1 Factors and levels of orthogonal experiment
1.3.5 黏豆包发酵剂培养条件的研究 在预试验的基础上,选取培养温度(20,25,30,35,37℃)、初始 pH(5.8,6.2,6.6,7.0,7.4)、装料量 (20,30,40,50,60 mL/250 mL)作为影响因素,以发酵剂的活菌数为指标进行试验。
1.3.6 糯玉米黏豆包的制作 糯玉米→筛选淘洗→沥干→加水浸泡(为原料质量的3倍)→接种乳酸菌发酵剂发酵(接种量3%)或自然发酵→清水投洗→胶体磨磨浆→脱水→包馅→成型→冷冻→蒸煮成熟→糯玉米黏豆包成品[10]。
1.3.7 人工接种发酵与自然发酵糯玉米黏豆包的品质研究
1.3.7.1 黏豆包发酵液pH和酸度的测定 参照1.3.1节中的方法。
1.3.7.2 黏豆包感官品质的测定 分别取待测黏豆包样品10个/种,采用10名具有专业知识储备的人组成评鉴小组,对不同的黏豆包产品进行评分。选取气味、色泽、外观形态、口感、滋味作为判断黏豆包成品品质的评价指标,各项指标的分值均为20分,详见表2。
黏豆包成品的综合得分=(气味+色泽+外观形态+口感+滋味)/5
1.3.7.3 黏豆包质构品质的分析 将制作好的样品糯玉米黏豆包于常温放置5 min后,置于测试台上进行质构测定(texture profile analysis,TPA)。糯玉米黏豆包TPA具体参数设置为[11]:采用P/0.5S球形质构探头;触发值为5 g;压缩距离为5 mm;测试前速度为2.00 mm/s;测试速度为1.00 mm/s;测试后速度为5.00 mm/s。检测的指标包含:硬度、黏性、弹性、粘聚性、胶着性、咀嚼性和回复性。
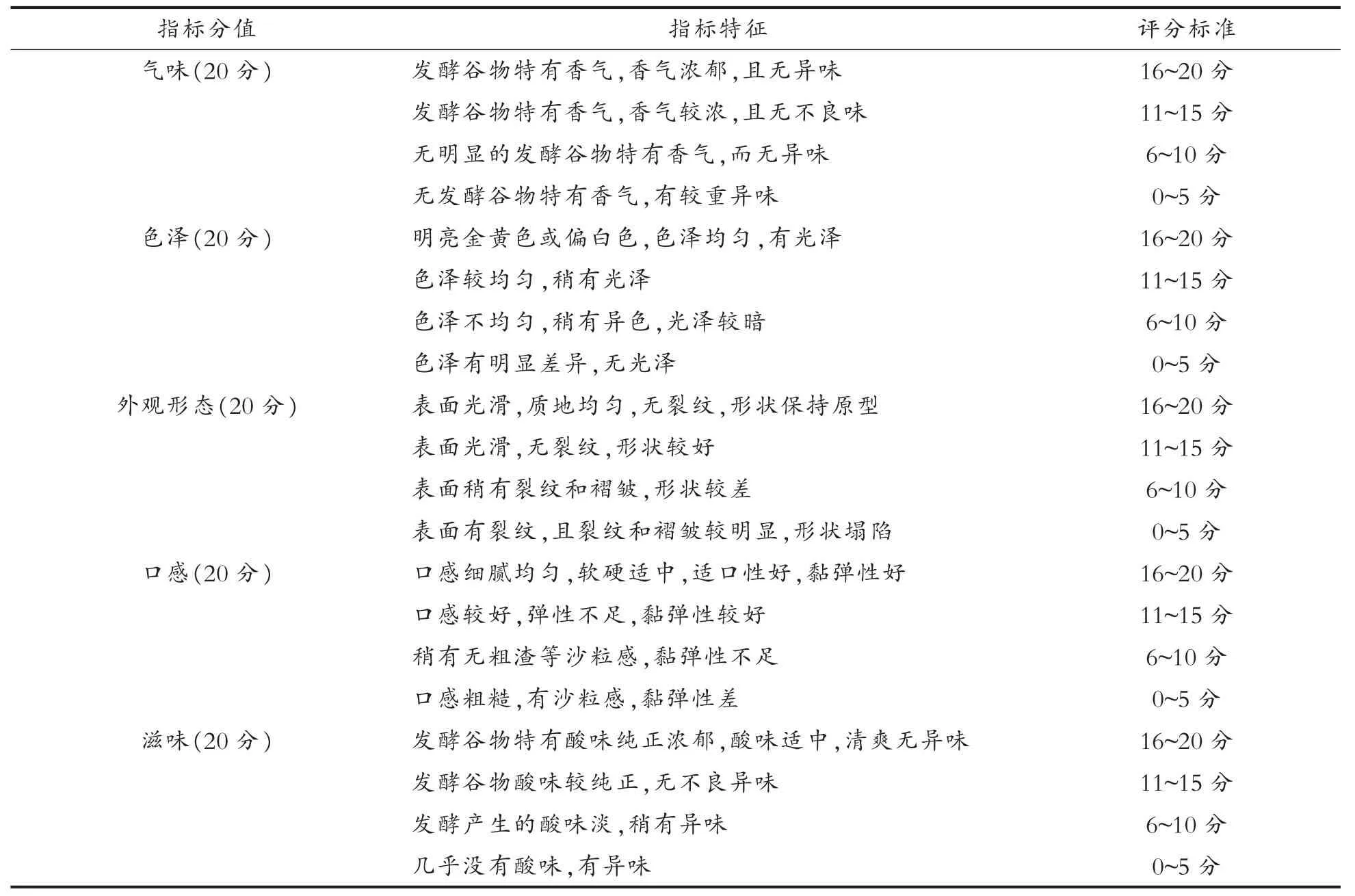
表2 黏豆包成品的感官评价Table2 Sensory evaluation of the fermented Niandoubao
1.3.8 数据处理方法 试验数据的平均值和标准差通过Microsoft Excel 2007软件进行计算,指标之间的差异通过SPSS statistics 19软件进行分析,并采用Origin 8.0软件作图。
2 结果与分析
2.1 黏豆包发酵剂的菌种选择
2.1.1 黏豆包发酵菌种的选择 对5株发酵性能优良的供试菌株进行发酵特性的研究,在发酵24 h过程中发酵液的pH值变化规律如图1所示。发现5株菌株都可以较好的适应脱脂乳培养基的环境。随着发酵时间的延长,各菌株对应的pH值均下降较快,而后趋于稳定。发酵初期4 h内,pH值下降多较为缓慢,乳酸菌多数处于生长的迟缓期[12];从4 h开始至16 h,乳酸菌的代谢活力旺盛,乳酸大量积累,pH值下降迅速,这是由于此时菌体的活力旺盛,分泌乳酸、乙酸等有机酸[13]。16 h至24 h的pH变化不显著(P>0.05)。发酵24 h时,5株乳酸菌的pH值下降到4.21±0.06至4.63±0.03并基本保持稳定,其中植物乳杆菌A9的pH显著低于其它4株乳酸菌发酵液的pH值(P<0.05),此外植物乳杆菌V3、肠膜明串珠菌LN1、植物乳杆菌BG112和弯曲乳杆菌A2的发酵液pH值依次升高。
由图2可知,5株乳酸菌的产酸曲线呈上升趋势,发酵24 h后其酸度含量在(0.90±0.02)%至(1.02±0.01)%范围内。酸度的快速升高能有效抑制腐败微生物的繁殖[14]。植物乳杆菌A9的产酸速率最快,酸度最高可达(1.01±0.02)%,显著高于另外4株乳酸菌(P<0.05)。早有研究表明在谷物发酵初期肠膜明串珠菌多为优势菌[15],而本研究中肠膜明串珠菌LN1的产酸量居中,且作为异型发酵乳酸菌,其代谢产物除乳酸外还包含乙酸、琥珀酸、和乙醇等,能增强产品的特征风味[16]。因此,优选植物乳杆菌A9和肠膜明串珠菌LN1复配。
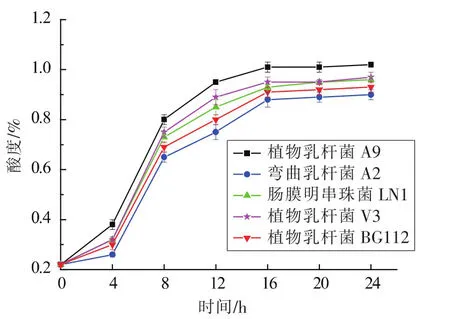
图1 发酵产物pH值随时间的变化规律Fig.1 Changes of pH value during fermentation
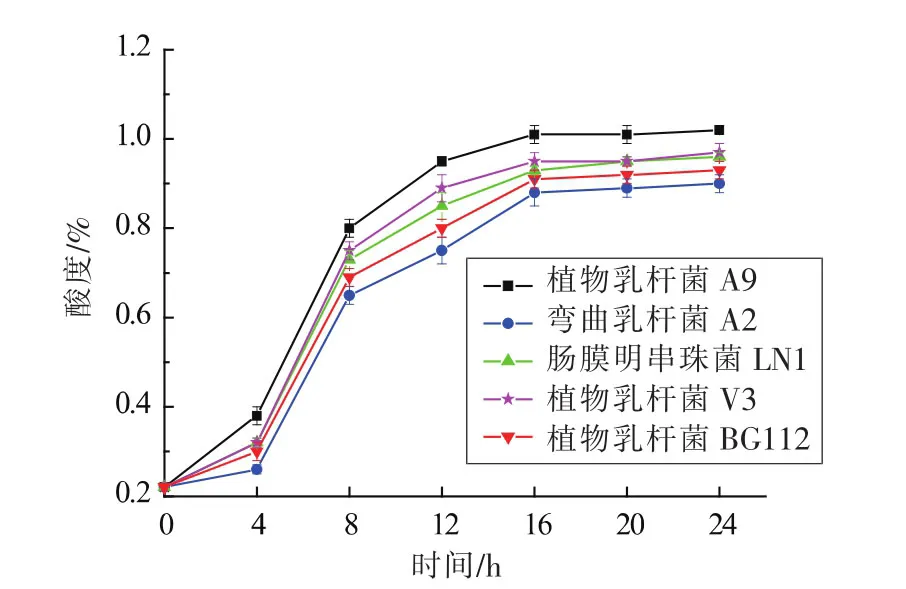
图2 发酵产物可滴定酸度随时间的变化规律Fig.2 Changes of titratable acidity during fermentation
2.1.2 黏豆包发酵菌种配比的选择 菌种发酵产酸能力的强弱和活菌数的多少是衡量其发酵性能的主要指标。优选菌株植物乳杆菌A9和肠膜明串珠菌 LN1 的配比分别为 3∶1、2∶1、1∶1、1∶2、1∶3时,发酵过程中产物的pH和活菌总数随发酵时间的变化情况如图3和图4所示。经24 h体系pH在3.69±0.01至4.05±0.06范围内,且均显著低于图1中任意一株菌株单独培养(P<0.05),这说明两株乳酸菌以不同配比培养可以良好的生长,活菌数均显著增加。随着培养时间的增加,不同配比菌株在培养基中的生长趋势和速度相当,这表明两种乳酸菌之间没有拮抗作用,可复配用于共同发酵。并且,当植物乳杆菌A9和肠膜明串珠菌LN1的比例为2∶1时,其产酸和活菌数均高于其它比例。因此,选择植物乳杆菌A9和肠膜明串珠菌LN1之间的比例为2∶1用于之后的研究。
图3 菌种比例对发酵产物pH值的影响Fig.3 Effect of lactic acid bacteria ratio on pH value of products
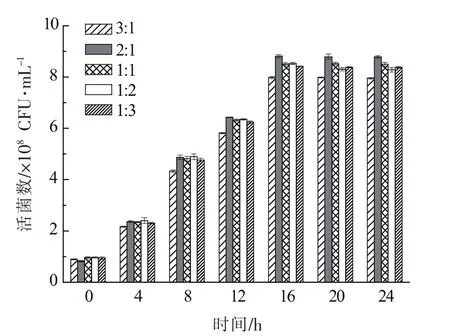
图4 不同菌种比例对发酵产物活菌数的影响Fig.4 Effect of lactic acid bacteria ratio on viable cells of products
2.2 黏豆包菌种发酵培养基的确定
在单因素试验的基础上,以活菌数作为目标值,研究培养基配方对菌体生长的影响。L16(45)正交试验的结果如表3所示。
如表3所示为正交试验的直观分析表,由极差分析结果可知,在本试验范围内各因素对活菌数影响的大小依次为D>B>A>C,即玉米汁浓度>葡萄糖浓度>脱脂乳浓度>玉米蛋白粉浓度。目标值活菌数越大越好,故较佳的组合为:A2B3C2D3。进行3次重复试验验证,得到活菌数为1.57×109CFU/mL,该配方下的活菌数高于A1B3C3D3的结果。因此,脱脂乳150 g/L,葡萄糖30 g/L,玉米蛋白粉10 g/L,玉米汁40 g/L为黏豆包发酵培养基的较优配方。
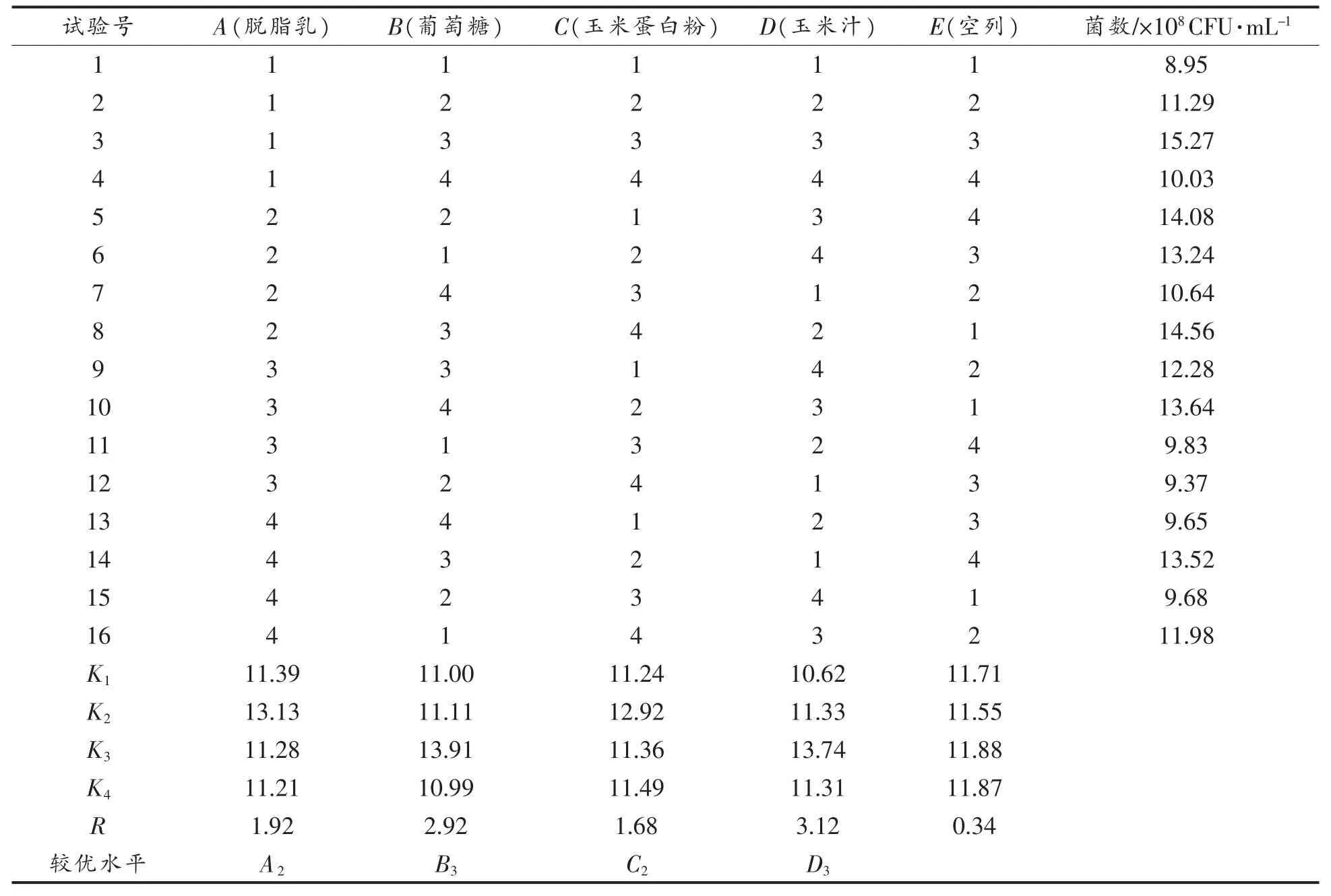
表3 正交试验结果Table3 Results of orthogonal experiment
2.3 黏豆包菌种发酵培养条件的确定
2.3.1 培养温度对活菌数的影响 分别控制菌体的培养温度为 20,25,30,35,37℃,对不同初始培养温度下的活菌数进行比较,结果如图5所示。发酵温度不同,培养基中的活菌总数亦不同,温度对培养基中的活菌数影响较大。温度变化会影响酶促反应速率和细胞膜流动性,进而影响细胞物质的合成、营养物质的吸收及代谢产物的分泌,最终影响微生物的生长[17]。过低或过高的培养温度对菌体的生长繁殖均可造成不良影响。培养基中活菌数在30℃时达到最大值。因此,在本试验的范围内确定发酵剂的最佳培养温度为30℃。
2.3.2 初始pH对活菌数的影响 本试验对不同初始pH值条件下的活菌数进行了比较,结果如图6所示。pH对微生物的代谢活动有显著的影响[18]。由图6可知,乳酸菌发酵剂的初始pH值不同,其活菌数也不尽相同,当控制发酵剂的初始pH值为6.6时,培养基内的活菌数达到最大水平,显著高于其它初始pH值条件下的活菌数 (P<0.05)。因此,选择发酵剂的初始pH值为6.6进行下一步研究。
2.3.3 装料量对活菌数的影响 装料量从20 mL/250 mL至60 mL/250 mL变化时,培养基中活菌数的变化情况如图7所示。如图可知,当培养时间达到16 h时,装料量为40 mL/250 mL培养基中的活菌数达到最高水平 (2.04±0.06)×109CFU/mL,这可能是由于装料量会对溶氧量造成影响,继而影响菌体生长[19]。因此,选择发酵剂的装料量为40 mL/250 mL较为适宜。
2.4 人工接种发酵与自然发酵糯玉米黏豆包的品质分析
2.4.1 黏豆包发酵液的pH及可滴定酸度 在发酵谷物生产黏豆包的过程中,发酵液的pH和酸度是衡量发酵是否结束的重要指标之一。一般认为,当发酵液pH达到3.5~4.0左右时,制成黏豆包风味最佳。由图8可以看出,随着发酵时间的增加,黏豆包发酵液的pH均逐渐降低,酸度逐渐升高。前期,加入发酵剂的发酵液pH值及酸度变化较为显著,而自然发酵则较为缓慢。加入乳酸菌发酵剂在发酵初期0~2 d,乳酸菌代谢活力旺盛,这可能是由于乳酸菌发酵剂的加入使优势菌群主导发酵,体系内的pH值迅速下降[20]。从第3天开始,产酸能力稍有降低,pH及酸度变化放缓。由于营养物质等条件的限制,第8天开始进入衰亡期,乳酸菌数量减少,活力降低,酸度开始上升。9 d后发酵液变得浑浊,影响食用品质,故应该在第9天前停止发酵。传统自然发酵周期较长,11 d后感官较好,且从第12天开始,制成成品产生酸臭异味,不宜食用,故应在12 d前停止发酵。由此表明,采用乳酸菌发酵剂能将发酵时间从12 d左右缩短至9 d左右,明显缩短发酵周期,提高了生产效率。
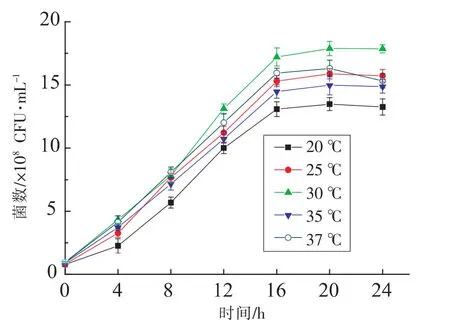
图5 发酵温度对发酵产物活菌数的影响Fig.5 Effects of different fermentation temperatures on viable cell counts of products
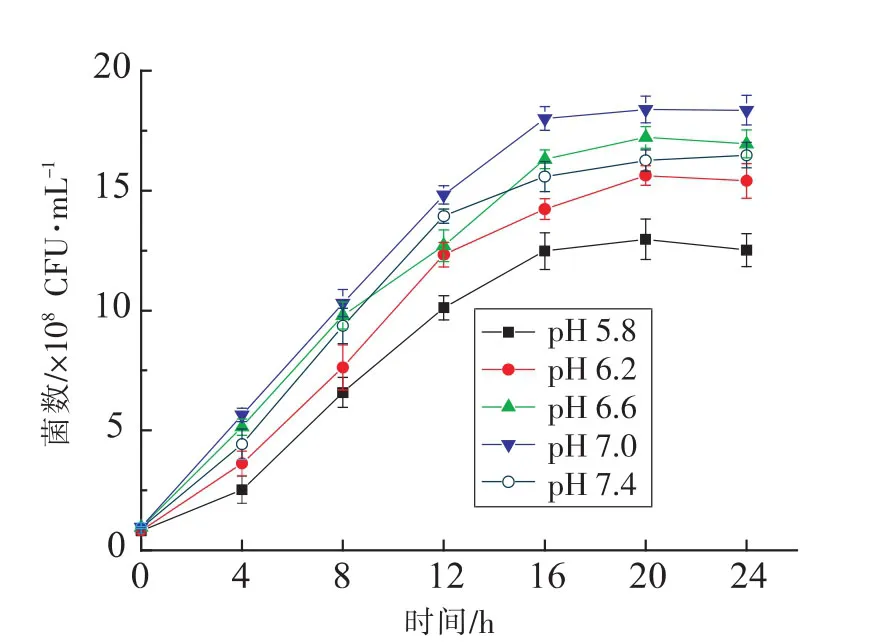
图6 初始pH对发酵产物活菌数的影响Fig.6 Effects of different initial pH value on viable cell counts of products
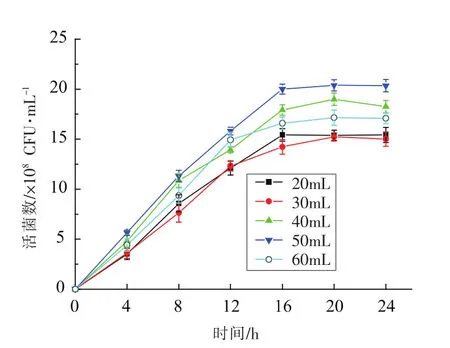
图7 装料量对发酵产物活菌数的影响Fig.7 Effects of different quantity of medium on viable cell counts of products
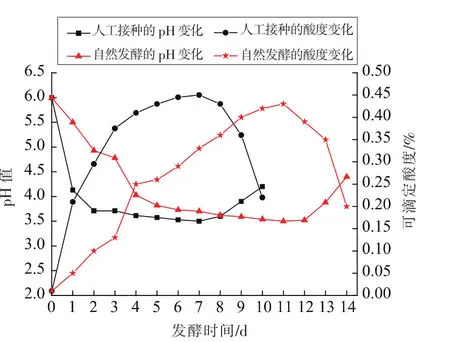
图8 在黏豆包发酵过程中发酵液的pH值和可滴定酸度的变化Fig.8 pH and titratable acidity of the fermentation broth during the fermentation process
2.4.2 黏豆包的质构品质分析 将人工接种发酵剂生产的糯玉米黏豆包与自然发酵糯玉米黏豆包的质构品质进行比较,结果如表4所示。
由表4可知,人工接种发酵剂生产的糯玉米黏豆包和自然发酵糯玉米黏豆包的硬度、弹性、粘聚性、胶着性及回复性的数值大致相似,且不存在显著的差异(P>0.05)。而人工接种发酵糯玉米黏豆包的黏性和咀嚼性均显著高于传统自然发酵糯玉米黏豆包(P<0.05),这可能是由于乳酸菌发酵剂的加入使优势菌群主导发酵,乳酸菌的代谢产物及淀粉颗粒的改性对于黏豆包质构的形成有重要影响[21]。
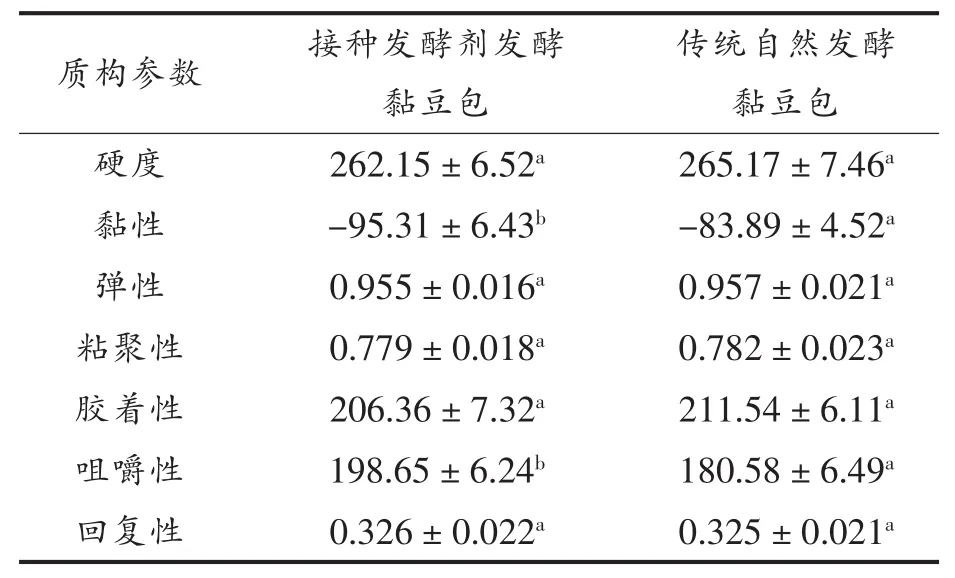
表4 糯玉米黏豆包质构品质的分析Table4 Analysis of texture quality of fermented waxy corn Niandoubao
2.4.3 黏豆包的感官品质分析 将人工接种发酵剂生产的糯玉米黏豆包与自然发酵糯玉米黏豆包的感官品质进行比较,结果如表5和图9所示。由表5可知,不论是人工接种发酵获得的糯玉米黏豆包还是自然发酵产品,其感官品质都能令人较为满意,评分均达到70分以上,且接种发酵剂生产的黏豆包的感官评分显著高于传统自然发酵(P<0.05)。这可能是由于传统自然发酵时间过长,导致游离脂肪酸含量上升,易产生不洁气味[22],且杂菌较多会产生较多不良风味物质,导致黏豆包的感官较差。

表5 糯玉米黏豆包感官品质的分析Table5 Analysis of sensory quality of fermented waxy corn Niandoubao
图9可以直观地看出,人工接种发酵剂和自然发酵的各项感官指标虽大致相似,却可以显著区分,人工接种发酵剂发酵的雷达图面积及周长均大于传统自然发酵;此外,人工接种发酵剂的黏豆包在气味、口感和外观形态等方面的评分明显高于传统自然发酵。这可能是由于乳酸菌在抑制腐败菌生长及赋予产品风味等方面具有明显作用[23-24]。
加入乳酸菌发酵剂会使黏豆包的感官品质及质构特性发生一定的改变,这就为乳酸菌菌剂在黏豆包发酵领域中应用提供了可能,研究结果对提高糯玉米黏豆包的品质、保证糯玉米黏豆包的品质安全具有借鉴意义,为继续深入地研究糯玉米黏豆包的工业化生产提供了重要的参考。
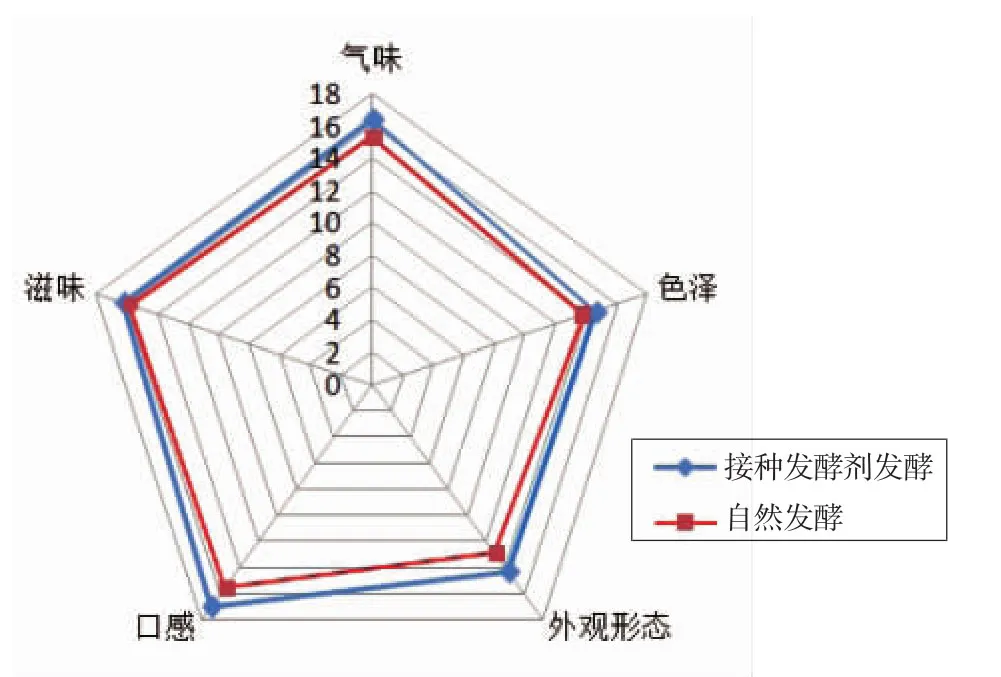
图9 黏豆包感官评分的雷达图分析Fig.9 Radar chart of sensory scoring of Niandoubao
3 结论
1)根据菌株的发酵性能及生长特性,筛选植物乳杆菌A9和肠膜明串珠菌LN1作为糯玉米黏豆包的发酵菌种。二者混合培养时发酵性能良好,以菌种比例为2∶1作为发酵剂时,产酸量和活菌数具有显著优势。
2)采用单因素和正交试验法优化的最佳培养基配方为脱脂乳150 g/L,葡萄糖30 g/L,玉米蛋白粉10 g/L,玉米汁40 g/L;最佳培养条件为培养温度30℃,初始pH值为6.6,装料量40 mL/250 mL,最终活菌数可达(2.04± 0.06)×109CFU/mL。
3)通过人工接种乳酸菌发酵剂生产糯玉米黏豆包可使发酵过程快速启动,得到糯玉米黏豆包的黏性、咀嚼性及感官质量要优于传统自然发酵(P>0.05)。人工接种乳酸菌发酵剂具有发酵周短、利于工业化生产等优势,可应用于糯玉米黏豆包的生产。

