万古霉素对hVISA生物膜构成的影响
桑瑞瑞,郜梦露,夏金星,沈继龙,徐元宏,
异质性万古霉素中介金黄色葡萄球菌(heterogeneous vancomycin-intermediateStaphylococcusaureus, hVISA)被定义为在万古霉素敏感性金黄色葡萄球菌(vancomycin-susceptibleStaphylococcusaureus, VSSA)中,万古霉素中介耐药亚群的存在频率为10-5~10-6CFU的金黄色葡萄球菌[1]。van Hal et al[2]报道糖肽类药物治疗hVISA感染比VSSA感染的失败率提高2.37倍。然而,这种治疗失败的机制尚未明确[3]。最近有报道,耐甲氧西林金葡菌(methicillin-resistantStaphylococcusaureus, MRSA)长时间暴露于万古霉素诱导而来的hVISA,其生物膜厚度明显增加[4]。金黄色葡萄球菌产生主要由蛋白质、细胞外多糖黏附素(polysaccharide intracellular adhesin, PIA)和细胞外DNA (extracellular DNA, eDNA)组成的细胞外基质(extracellular matrices, ECM)[5],从而获得对抗生素的抵抗性。目前,万古霉素对金黄色葡萄球菌生物膜构成的影响存在争议[6-7]。该研究旨在探讨不同浓度的万古霉素对hVISA的标准菌株Mu3和临床hVISA菌株生物膜构成以及对生物膜中主要成分的影响,从而探讨万古霉素治疗hVISA感染失败率高的原因。
1 材料与方法
1.1 菌株来源实验中所用临床菌株来自安徽医科大学第一附属医院的血液感染的样本。Mu3由安徽省立医院赠送。ATCC29213是质控菌株,来自安徽医科大学第一附属医院检验科。
1.2 实验试剂脑心浸液(brain heart infusion, BHI)和Mueller-Hinton肉汤 (MHB)购于杭州百思生物技术有限公司;考马斯亮蓝、替考拉宁、万古霉素和小麦胚凝集素购于法国Sigma公司;结晶紫(crystal violet, CV)和辣根过氧化物酶标记的链霉亲和素购于上海生工生物工程股份有限公司;Bradford蛋白质检测试剂盒和牛血清白蛋白(bovine serum albumin, BSA)购于美国Boster公司;DNase Ⅰ购于美国Thermo Fisher Scientific公司;FilmTracer TM LIVE/DEAD®Biofilm Viability Kit购于美国Invitrogen公司。
1.3 实验仪器酶标仪(美国Perkin Elmer EnSpire公司);共聚焦激光扫描显微镜(德国Carl Zeiss公司);电泳仪器和化学发光检测装置(美国BioRad公司)。
1.4 菌株筛选在该研究中使用两株hVISA菌株,临床菌株05307和标准菌株Mu3。从血液感染的样本中收集36个MRSA并通过纸片扩散法进行验证。将阳性菌株通过菌群谱型分析-曲线下面积[the population analysis profile(PAP) with an area under the curve(AUC) ratio,PAP/AUC]法来确定hVISA的临床菌株[1]。计算测试菌株与Mu3的AUC比率。比率小于0.9的被认为是VSSA,比率为0.9~1.3和>1.3的分别是hVISA和VISA。
1.5 最低抑菌浓度(minimal inhibitory concentration, MIC)的测定用临床和实验室标准化协会(the clinical and laboratory standards institute, CLSI)推荐的标准微量肉汤稀释法,测定Mu3和菌株05307的MIC[8]。
1.6 生物膜总量的测定挑取血琼脂平板上的菌落,在补充有0.5%(w/v)葡萄糖的BHI中,在35 ℃下培养过夜,并用BHI肉汤稀释细菌悬浮液至OD600为0.05。 将稀释的细菌悬浮液(每孔200 μl)一式三份加入含有不同浓度万古霉素(1/4×MIC、1/2×MIC、1×MIC)的96孔平底聚苯乙烯微量滴定板孔中,分别记为(1/4×MIC组、1/2×MIC组、1×MIC组),并在35 ℃下静止孵育18 h。单独的肉汤和不含抗生素的细菌悬液分别作为阴性和阳性对照组。每个实验进行2次。
CV染色用于测定生物膜总量。 CV染色测定:每孔用0.9%Nacl冲洗两次,并将干燥的黏附生物膜在室温下用0.4%(w/v)CV染色约10 min。除去游离CV并用0.9% NaCl洗涤2次。每孔用200 μl乙醇溶解CV。最后,使用酶标仪在590 nm处读板。
1.7 激光共聚焦显微镜(confocal laser scanning microscopy, CLSM)评估生物膜厚度将金黄色葡萄球菌在如上所述的条件下培养,除了用于CLSM的35 mm玻璃培养皿代替96孔聚苯乙烯微量滴定板之外,其余与上述相同。根据制造商的方法使用FilmTracer TM LIVE/DEAD®Biofilm Viability Kit对生物膜中的活/死细胞染色。使用ZEISS LSM880共聚焦显微镜在40× 0.7NA 3.3 mm WD水物镜下以1.0 μm为间隔收集Z-stack图片,从而评价玻璃皿上形成的生物膜。使用Imaris 7.2.3软件构建三维图形。
1.8 测量分离的ECM中蛋白质组分根据之前的报道从生物膜中提取ECM[9]。 通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)分离ECM中的蛋白质组分,然后进行考马斯亮蓝染色。据制造商的说明书,使用Bradford蛋白质测定试剂盒定量分离的ECM中蛋白质总量。用酶标仪在590 nm处测量浓度。BSA用作标准品。
1.9 PIA的半定量检测如上所述,在6孔细胞培养板中制备生物膜。通过将每孔中的细胞重悬于100 μl 50 mmol/L EDTA(pH8.0)中,然后在100 ℃温育5 min。离心(12 000 r/min,5 min)后,将40 μl上清液与10 μl蛋白酶K在37 ℃下孵育2 h。然后将3 μl转移到PVDF膜上。印迹后,将膜在65 ℃下烘烤,浸入含有3%小牛血清白蛋白和0.05%吐温20的PBS中,并在室温下温育30 min。然后将膜置于含有3.2 μg/ml小麦胚凝集素的PBS中,并在室温下温育1 h。将膜用PBS洗涤4次,每次10 min。加入辣根过氧化物酶标记的链霉抗生物素蛋白。使用化学发光检测装置和软件Image J对由斑点印迹产生的图像进行定量。
1.10 生物膜对酶DNase Ⅰ的敏感性的检测在不除去培养基的情况下,将能够降解eDNA的DNase1(100 U/ml)直接加入到已形成的生物膜中,并将混合物在37 ℃温育2 h。使用如上所述的CV染色测定生物膜总量。
1.11 统计学处理通过GraphPad Prism 5采用Dunnett-t检验比较所有万古霉素处理组与阳性对照组所收集的数据,P<0.05为差异有统计学意义。
2 结果
2.1 菌株筛选和MIC的检测菌株ATCC29213与Mu3的PAP/AUC比率为0.54,表明在质控范围内。菌株05307与Mu3的PAP/AUC比率为0.95,其在0.9和1.3之间,被鉴定为hVISA,见图1。万古霉素对菌株ATCC 29213、Mu3和菌株05307的MIC分别是0.5、2、1 mg/L。
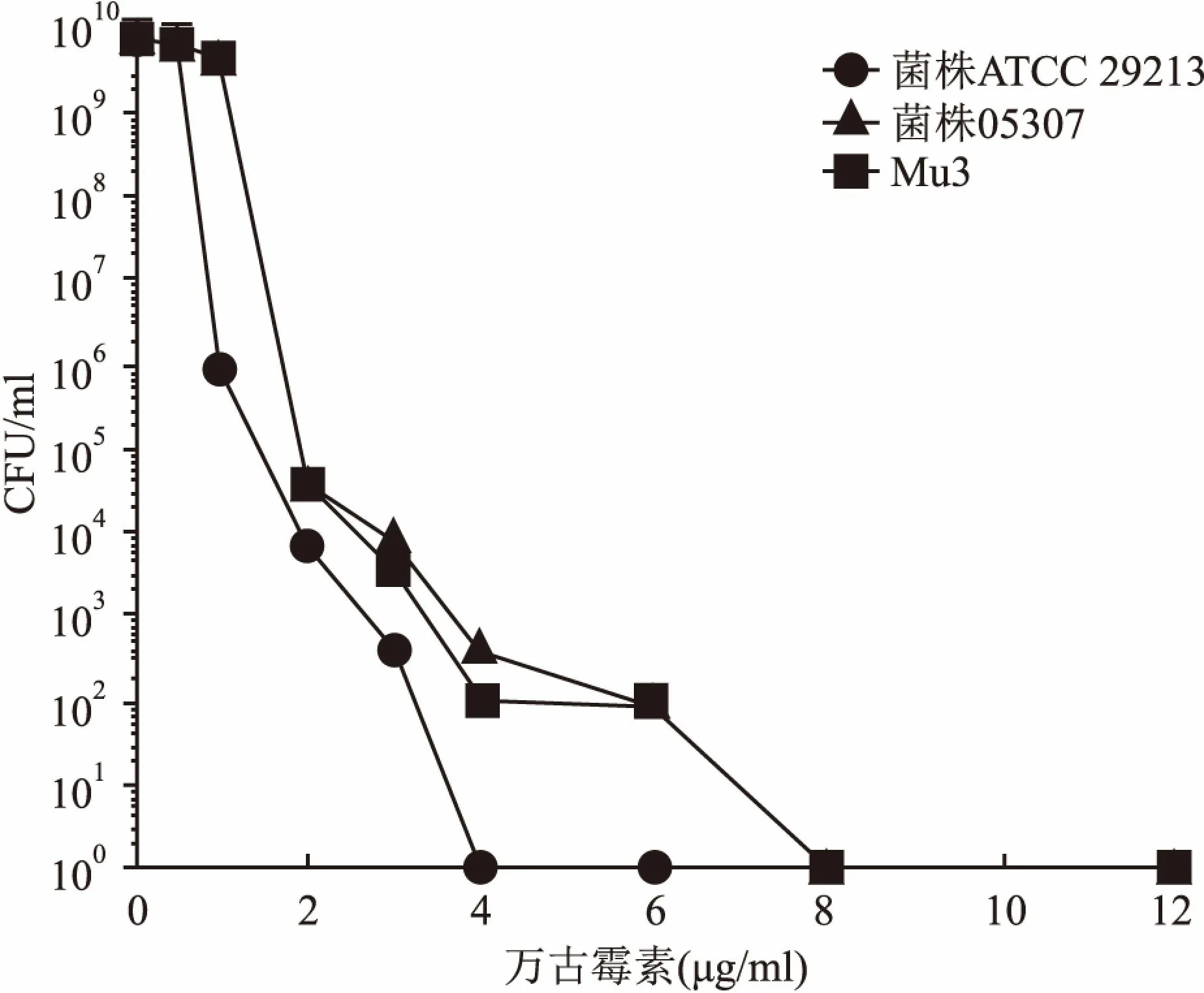
图1 PAP/AUC
2.2 不同浓度的万古霉素对生物膜形成以及厚度的影响CV染色结果表明,与阳性对照组(Mu3:0.653±0.077;菌株05307:1.424±0.057)相比,1×MIC万古霉素处理Mu3(0.964±0.050)和菌株05307(0.964±0.050),其生物膜总量明显增加,差异有统计学意义(F=8.639、7.350,P<0.01),但是当两种菌株暴露于亚MIC(浓度分别为1/4×MIC、1/2×MIC)的万古霉素时,对Mu3和菌株05307生物膜的构成没有明显影响(P>0.05),见图2A。用Biofilm Viability Kit染色,死亡的细菌被碘化丙啶染成红色,SYTO 9染色活细菌细胞并染成绿色,并通过CLSM使得生物膜可视化,以便进一步研究这些生物膜。图2B、2C显示了对照组和万古霉素处理组的金黄色葡萄球菌生物膜的三维图像。图2D显示了所有测试菌株的生物膜厚度。与CV染色测定结果一致,在1×MIC万古霉素处理后,与阳性对照组(Mu3:9.555±0.882;05307:11.556±1.667)相比,1×MIC万古霉素处理Mu3(14.888±0.781)和菌株05307(10.222±0.972),两株菌株均观察到生物膜厚度的显著增加,差异有统计学意义(F=61.996、46.507,P<0.01),但是当两种菌株暴露于亚MIC(浓度分别为1/4×MIC、1/2×MIC)的万古霉素时,对Mu3和菌株05307生物膜的构成没有明显影响(F=61.996、46.507,P>0.05),见图2D。
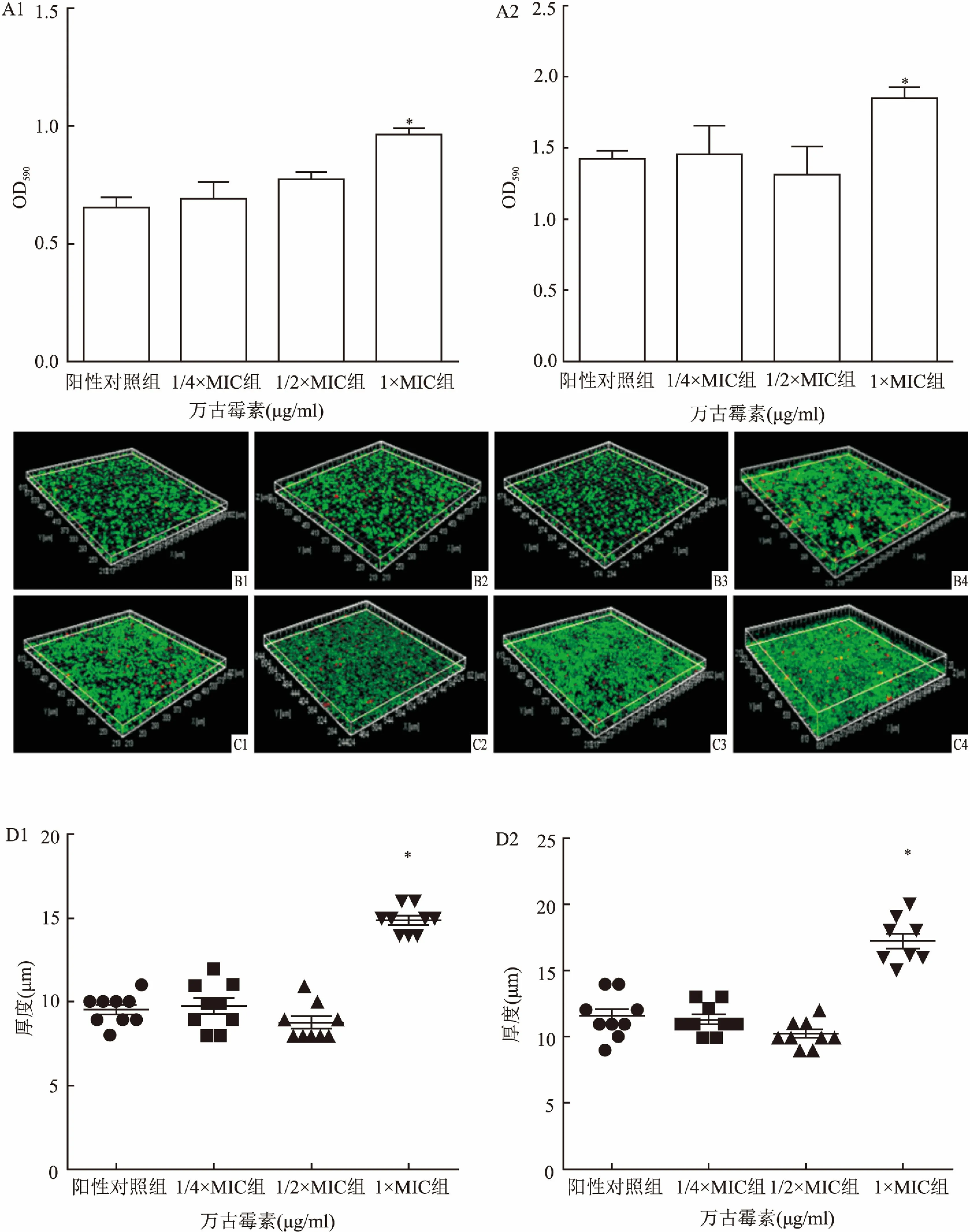
图2 生物膜形成的评估
A:通过CV染色来定量生物膜总量;1:Mu3;2:菌株05307;B:CLSM下Mu3暴露于各种浓度的万古霉素中的生物膜图像;C:CLSM下菌株05307暴露于各种浓度的万古霉素中的生物膜图像;1:阳性对照组;2:1/4×MIC组;3:1/2×MIC组;4:1×MIC组;D:生物膜厚度;1:Mu3;2:菌株05307;与阳性对照组比较:**P<0.01
2.3 各种浓度的万古霉素对生物膜中蛋白质和PIA表达的影响Mu3和菌株05307暴露于不同浓度(分别为1/4×MIC、1/2×MIC、1×MIC)的万古霉素,各处理组与对照组之间未观察到ECM中蛋白质含量有统计学差异(F=0.572、4.292,P>0.05),见图3。类似地,当用不同浓度(分别为1/4×MIC、1/2×MIC、1×MIC)的万古霉素处理两株菌株时,各处理组在ECM中仅有基础水平的PIA表达,与阳性对照组相比,没有统计学差异(F=2.719、0.614,P>0.05),见图4。
2.4 加入DNase Ⅰ后观察生物膜形成总量的变化分别在Mu3和菌株05307加入DNase Ⅰ后,1×MIC万古霉素诱导的生物膜形成被显著抑制到与亚MIC(浓度分别为1/4×MIC、1/2×MIC)的万古霉素处理组和阳性对照组相近的水平,差异没有统计学意义(F=2.504、5.849,P>0.05),见图5,这与在没有添加酶的情况是相反的。而且通过对比图2A和图5,表明加入DNase Ⅰ后,两株菌株的生物膜总量均降低。
3 讨论
该研究结果表明,1×MIC万古霉素诱导hVISA的生物膜形成。ECM的存在和细胞代谢状态的异质性使得生物膜包埋的细菌对大多数抗菌剂的耐药性比其浮游状态高出1 000倍[10]。最近的一项研究[11]表明,连续和间歇输注方案中万古霉素的最高平均稳态浓度分别为(24.88±12.75)和(55.02±17.36)μg/ml,而血清中最低浓度分别为(19.89±10.15)和(12.43±12.86) μg/ml。因为万古霉素组织穿透性差,所以部分组织中的浓度甚至更低。因此,在抗生素浓度低于有效剂量的外周或深部组织中可能发生抗生素增强生物膜形成的现象,hVISA菌株可以存活并且很有可能增强此位点的生物膜构成。因此,万古霉素增强生物膜的构成可能是万古霉素治疗hVISA感染失败率高的原因之一。当外界环境中营养源丰富时,嵌入生物膜的细菌将开始溢出并在远端再次聚集[12],这可能部分地解释了由hVISA引起的持续性感染的现象。
进一步评估ECM中各组分的变化,发现1×MIC万古霉素不影响hVISA生物膜构成过程中蛋白质组分和PIA的表达。 该结论似乎与先前的报道不同[8],hVISA长时间暴露于万古霉素中可增加生物膜形成,这可能是由FnbA-和PIA依赖性途径介导的,而且atlA和sarA的上调也可能有助于增强生物膜形成。然而,在本实验中,菌株仅在万古霉素中暴露18 h,并且这个结果与先前报道万古霉素对Mu50生物膜影响的结果一致[13]。
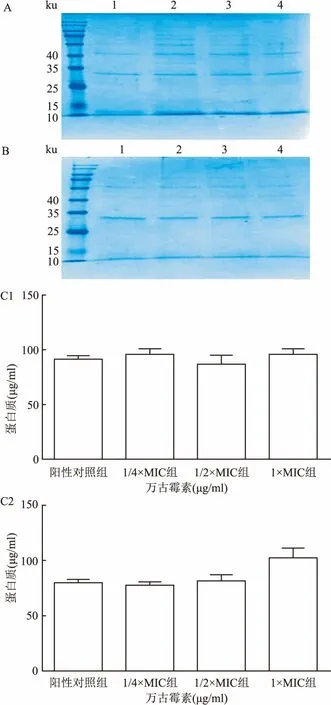
图3 蛋白质组分的测量
A:通过SDS-PAGE分析从Mu3的生物膜中提取的蛋白质组分;B:通过SDS-PAGE分析从05307的生物膜中提取的蛋白质组分;1:阳性对照组;2:1/4×MIC组;3:1/2×MIC组;4:1×MIC组;C:对蛋白质进行定量;1:Mu3;2:菌株05307
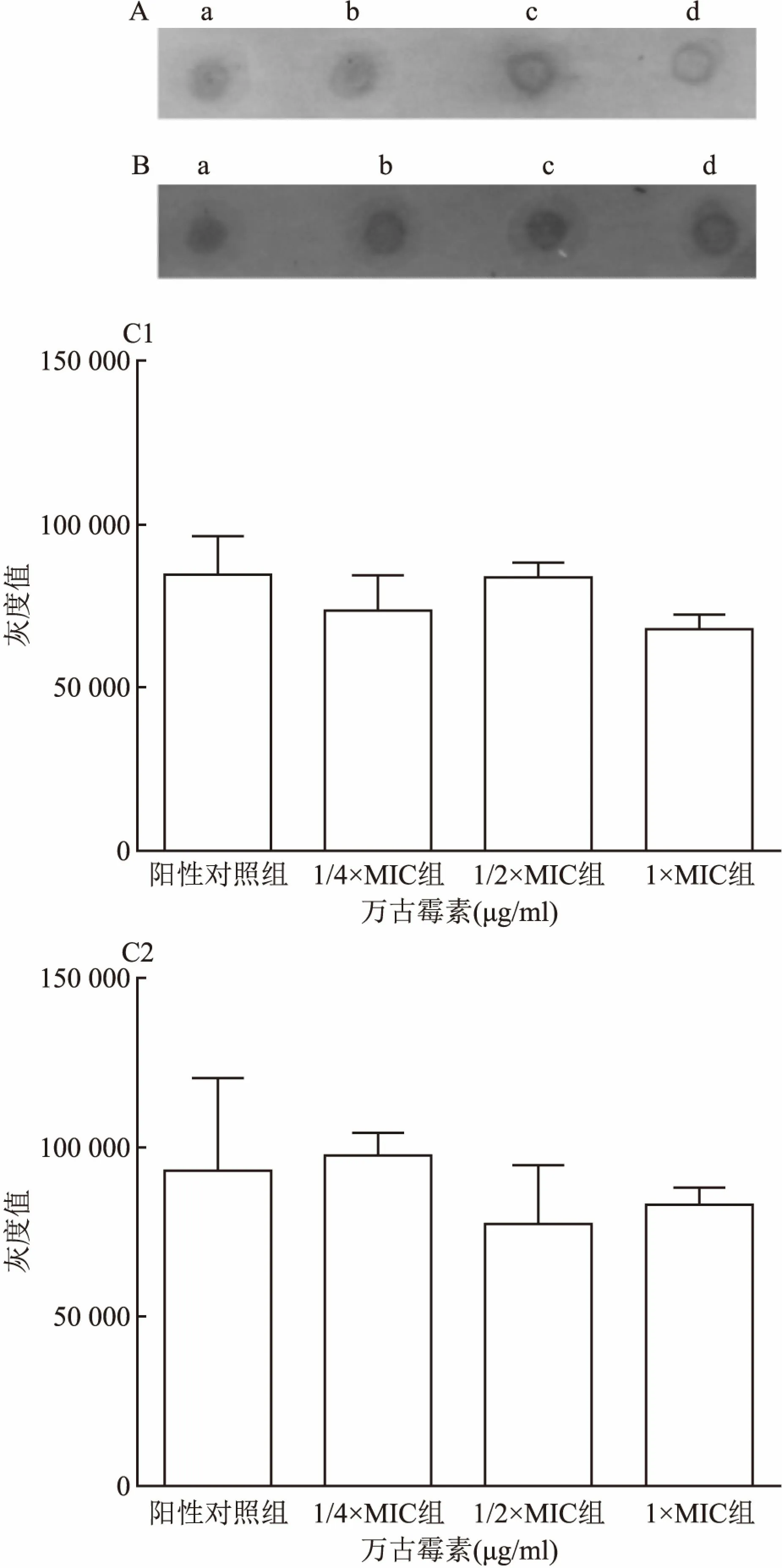
图4 PIA的半定量
A:斑点印迹法检测Mu3生物膜中PIA;B:分斑点印迹法检测菌株05307生物膜中PIA;a:阳性对照组;b:1/4×MIC组;c:1/2×MIC组;d:1×MIC组;C:通过使用软件Image J对灰度值进行定量;1:Mu3;2:菌株05307
eDNA是金黄色葡萄球菌生物膜发育中的重要基质成分,并且对于在生物膜发育的初始阶段和对生物膜成熟的调节具有显著影响[13]。eDNA来源于细胞裂解[14]。因此可以认为,当万古霉素达到一定
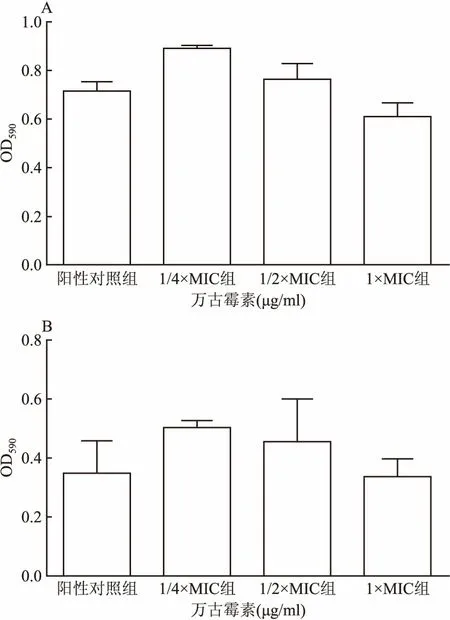
图5 生物膜对Dnase Ⅰ敏感性的检测
A:加入DNase Ⅰ后各处理组Mu3的生物膜总量;B:加入DNase Ⅰ后各处理组菌株05307的生物膜总量
浓度(1×MIC)时,可诱导细菌自溶、eDNA释放和生物膜形成。当然仍然还需要其他方法来阐明hVISA临床菌株中生物膜发育的机制,以及万古霉素在该过程中的作用。
该研究分析了万古霉素对hVISA临床分离株生物膜构成过程中主要成分的影响,表明1×MIC万古霉素诱导的eDNA释放与hVISA生物膜形成密切相关,这也可能是万古霉素治疗hVISA感染失败率高的原因。 因此抑制eDNAs产生可能是提高hVISA感染治愈率的潜在策略。

