干扰DOT1L基因抑制胃癌MGC-803细胞增殖、侵袭和迁移
王庆康,宋早智,刘 雪,钱 军
在我国,胃癌发病率和病死率分居恶性肿瘤的第二位和第三位,晚期胃癌的5年生存率小于5%[1- 2]。放化疗主要用于中晚期胃癌患者的治疗,但因其不良反应较多,患者通常难以耐受。类端粒沉默干扰体-1(disruptor of telomeric silencing-1, DOT1)是一种在哺乳动物进化过程中发挥作用的保守蛋白,其在人类基因中被称为DOT1-like(DOT1L)[3]。DOT1L可使组蛋白H3的第79位赖氨酸(H3K79)发生甲基化[4]。对肺癌A549或NCI-H1299细胞DOT1L基因干扰后,细胞常表现出非增殖的多核表型[5]。上皮间质转化(epithelial mesenchymal transition,EMT)是胃癌发生发展的关键驱动因素,在胃癌侵袭、复发转移的早期阶段均发挥重要作用[6]。有研究[7]表明,EMT与H3K79甲基化修饰有一定相关性。该研究通过干扰胃癌MGC-803细胞中DOT1L基因,下调H3K79甲基化水平,进而观察DOT1L基因对胃癌MGC-803细胞增殖的影响,并探索迁移及侵袭能力改变与EMT的相关性。
1 材料与方法
1.1 细胞株与试剂MGC-803、BGC-823、SGC-7901细胞株均由本实验室提供;RPMI -1640培养基、1%青霉素-链霉素混合物均购自美国Gibco公司;胎牛血清购自杭州四季青生物工程材料有限公司;Real-time PCR试剂盒购自美国Promega公司;TRIzol试剂购自美国Invitrogen公司;Primescript RT试剂购自日本Takara公司;CCK-8试剂盒、RIPA裂解液、BCA蛋白浓度测定试剂盒、0.1%结晶紫均购自上海碧云天公司;Transwell小室购自北京Unique生物公司;matrigel基质胶购自美国BD公司;polybrene、嘌呤霉素、胰酶均购自美国Sigma公司;DOT1L、H3K79me1、H3K79me2、H3K79me3、EMT标识基因蛋白一抗(鼠抗)均购自美国ABclonal公司;β-actin一抗(鼠抗)、DOT1L、H3K79me1、H3K79me2、H3K79me3、EMT标识基因蛋白、β-actin二抗(羊抗鼠)均购自美国Abbkine公司;DOT1L基因相关的上下游PCR引物(上海生工生物有限公司);上海吉玛公司构建DOT1L-shRNA(正义序列:5′-CCGGGCCCGCAAGAAGAAGCTAAACCTCGAGG-TTTAGCTTCTTCTTGCGGGCTTTTTG-3′;反义序列:5′-AATTCAAAAAGCCCGCAAGAAGAAGCTAAACC-TCGAGGTTTAGCTTCTTCTTGCGGGC-3′),命名为pLKO.1puro-DOT1L-shRNA;阴性对照shRNA(正义序列:5′-CCGGCCTAAGGTTAAGTCGCCCTCGC-TCG AGCGAGGGCGACTTAACCTTAGGTTTTTG-3′;反义序列:5′-AATTCAAAAACCTAAGGTTAAGTCGCCCT CGCTCGAGCGAGGGCGACTTAACCTTAGG-3′),命名为pLKO.1puro-shNC。
1.2 Western blot法比较3种不同胃癌细胞株DOT1L基因的表达水平收集MGC-803、BGC-823、SGC-7901离心后细胞沉淀,提取总蛋白。检测蛋白浓度后,使用RIPA裂解液调整各组蛋白样品至等体积等浓度后,加入上样缓冲液,沸水煮浴10 min使蛋白变性。取等体积3组蛋白样品组上样。110 V恒压电泳完成后电转移至0.45 μm PVDF膜上,经5%脱脂牛奶封闭2 h后,转移至孵育盒中,加入TBST稀释后的DOT1L抗体和β-actin的抗体并4 ℃孵育过夜。次日用TBST洗膜3次,每次10 min。加入二抗室温摇床孵育2 h,洗膜3次,每次10 min。ECL发光液发光显色,使用Image J软件图像分析,计算出各组细胞中DOT1L基因蛋白的相对表达量。
1.3 选取胃癌MGC-803细胞进行病毒感染将胃癌MGC-803细胞均匀接种于6孔板中,每孔约种5×105个细胞,控制polybrene终浓度为6 μg/ml,按使用说明,用pLKO.1puro-DOT1L-shRNA和pLKO.1puro-shNC分别感染胃癌细胞。病毒感染48 h后更换含10%血清培养基,加入调整后浓度为3 μg/ml的嘌呤霉素,筛选MGC-803细胞2周后继续扩增。
1.4 Real-time PCR检测DOT1L基因的转染提取总RNA,使用Primescript RT试剂对不含DNA的RNA逆转录合成cDNA。通过使用Step One Plus Real-time PCR系统,用SYBR Green RT-PCR试剂盒进行所有qRT-PCR的mRNA分析。以下引物用于qRT-PCR:DOT1L上游引物:5′-CATCACTATGGCGTCGAGAAA-3′,下游引物:5′-CGCCTCTCTCCAATGTGTATT-3′;β-actin上游引物:5′-CAGGAAGGAAGGCTGGAAG-3′,下游引物:5′-CGGGAAAT CGTGCGTGAC-3′。PCR反应总体系为10 μl:ddH2O 3.2 μl、Rox 0.2 μl、上游和下游引物各0.3 μl、Mix 5 μl、cDNA 1 μl。PCR扩增条件:95 ℃预变性30 s,95 ℃变性5 s后60 ℃退火34 s,共40个循环。β-actin作为内参,实验重复3次。各组Ct值与β-actin的Ct值相减得到△Ct,用2-△△Ct方法比较。
1.5 Western blot法检测转染效果按1.2项步骤,检测MGC-803细胞转染慢病毒后,各组细胞中H3K79甲基化水平。
1.6 细胞集落克隆实验和CCK-8实验检测细胞增殖能力
1.6.1细胞集落克隆实验 消化各组细胞并计数,以1×103/孔的密度接种在6孔板中,每组均设置3个亚孔。培养至肉眼下可见细胞集落后,弃培养基并加入PBS洗涤,加入600 μl 0.1%的结晶紫染色。室温下晾干,倒置显微镜40倍镜下相同拍照位置拍照,计算单克隆集落数并作图。
1.6.2CCK-8实验 消化细胞并计数后,调整细胞密度为3×103/孔并接种接种于4块96孔板,每组均设置3个亚孔。培养24、48、72、96 h后向各孔中加入10 μl CCK-8溶液,37 ℃孵育1.5 h后。在波长450 nm下检测各组细胞吸光度值,绘制增殖曲线图。
1.7 细胞划痕损伤实验检测MGC-803细胞体外迁移能力6孔板每孔约接种5×105个细胞,各组均设3个亚孔。待细胞隔夜刚长满贴壁,吸出培养基,加入PBS洗涤3次。经皿底垂直划直线,加入PBS洗去漂浮细胞。使用不含血清的RPMI 1640培养基进行细胞培养,0、24 h后显微镜下拍照并标记拍照位置。用Photoshop软件测量细胞划痕距离。本实验重复3次。划痕愈合率=(1-24 h距离/0 h距离)×100%。
1.8 Transwell实验检测MGC-803细胞迁移和侵袭能力
1.8.1细胞迁移实验 无血清培养基调整细胞密度为5×105/ml,加入100 μl至Transwell上室,每组均设置3个亚室。下室加入含15%血清的培养基500 μl。培养24 h后,弃去小室内培养基,PBS洗涤并用棉签轻轻擦拭滤膜上层。甲醇和结晶紫分别进行固定和染色,时长均为20 min,相同位置下取5个高倍视野进行细胞计数。
1.8.2细胞侵袭实验 将提前24 h预冷的10 μl Matrigel与60 μl的无血清培养基混匀,晾干后还需加入50 μl无血清培养基水化基底膜。培养箱中孵育30 min。余步骤同Transwell细胞迁移实验。
1.9 Western blot法检测EMT标识基因蛋白表达水平按1.2项步骤检测胃癌细胞中E-Cadherin、N-Cadherin和Vimentin蛋白的表达水平。
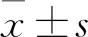
2 结果
2.1 Western blot法比较胃癌MGC-803、BGC-823、SGC-7901细胞DOT1L表达水平Western blot结果显示,3种胃癌细胞系中,胃癌MGC-803细胞DOT1L表达水平最高。本研究拟挑选胃癌MGC-803细胞进行后续实验,见图1。
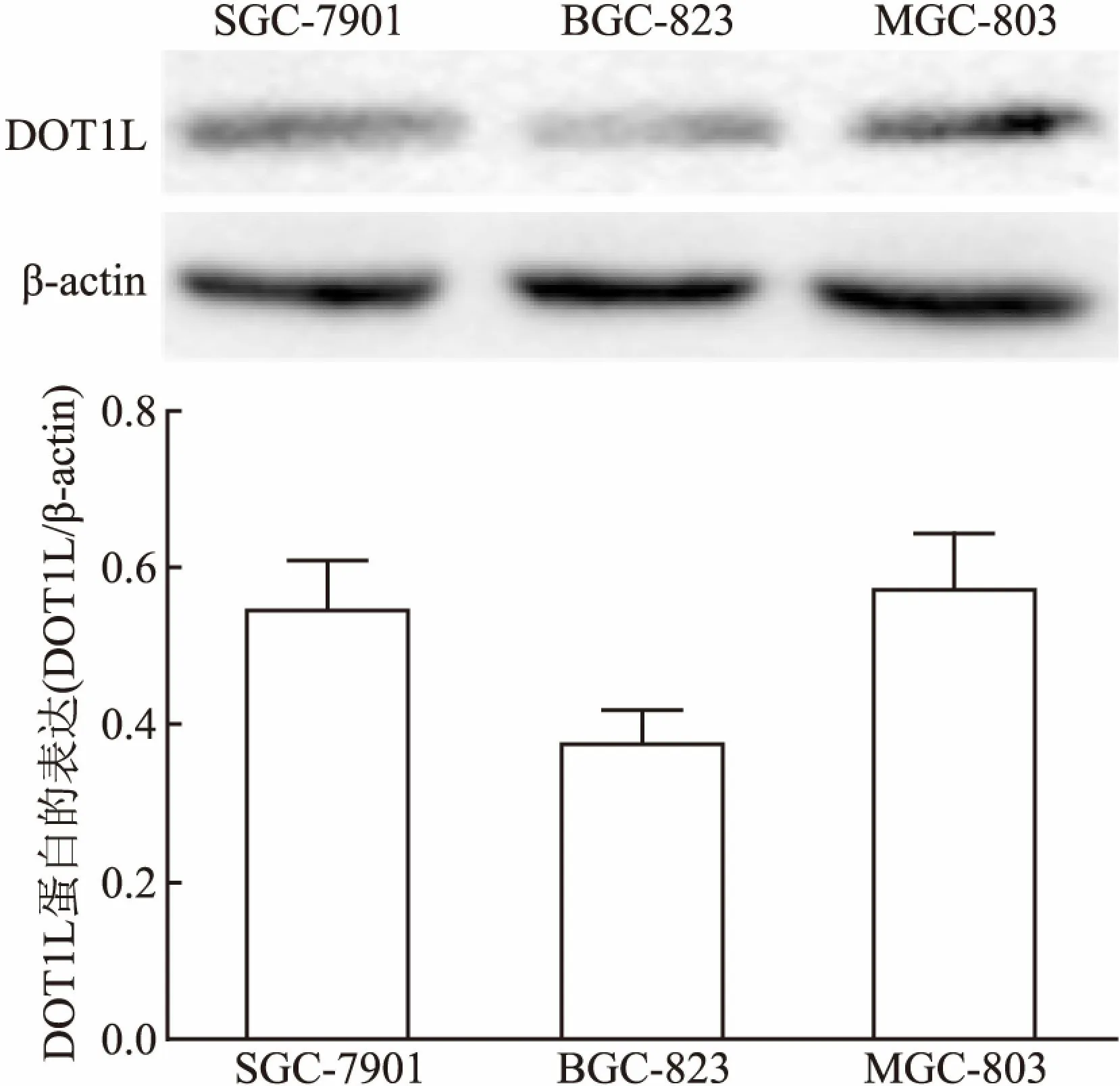
图1 Western blot法检测3种胃癌细胞株中 DOT1L基因蛋白的相对表达水平
2.2 Real-time PCR检测DOT1L mRNA表达水平将pLKO.1puro-DOT1L-shRNA和pLKO.1puro-shNC分别感染胃癌MGC-803细胞,检测3组细胞中DOT1L mRNA的表达水平。结果表明,感染慢病毒shDOT1L组细胞mRNA表达水平较空白对照组和阴性对照组明显下调,差异有统计学意义(F=54.200,P<0.05),见图2。
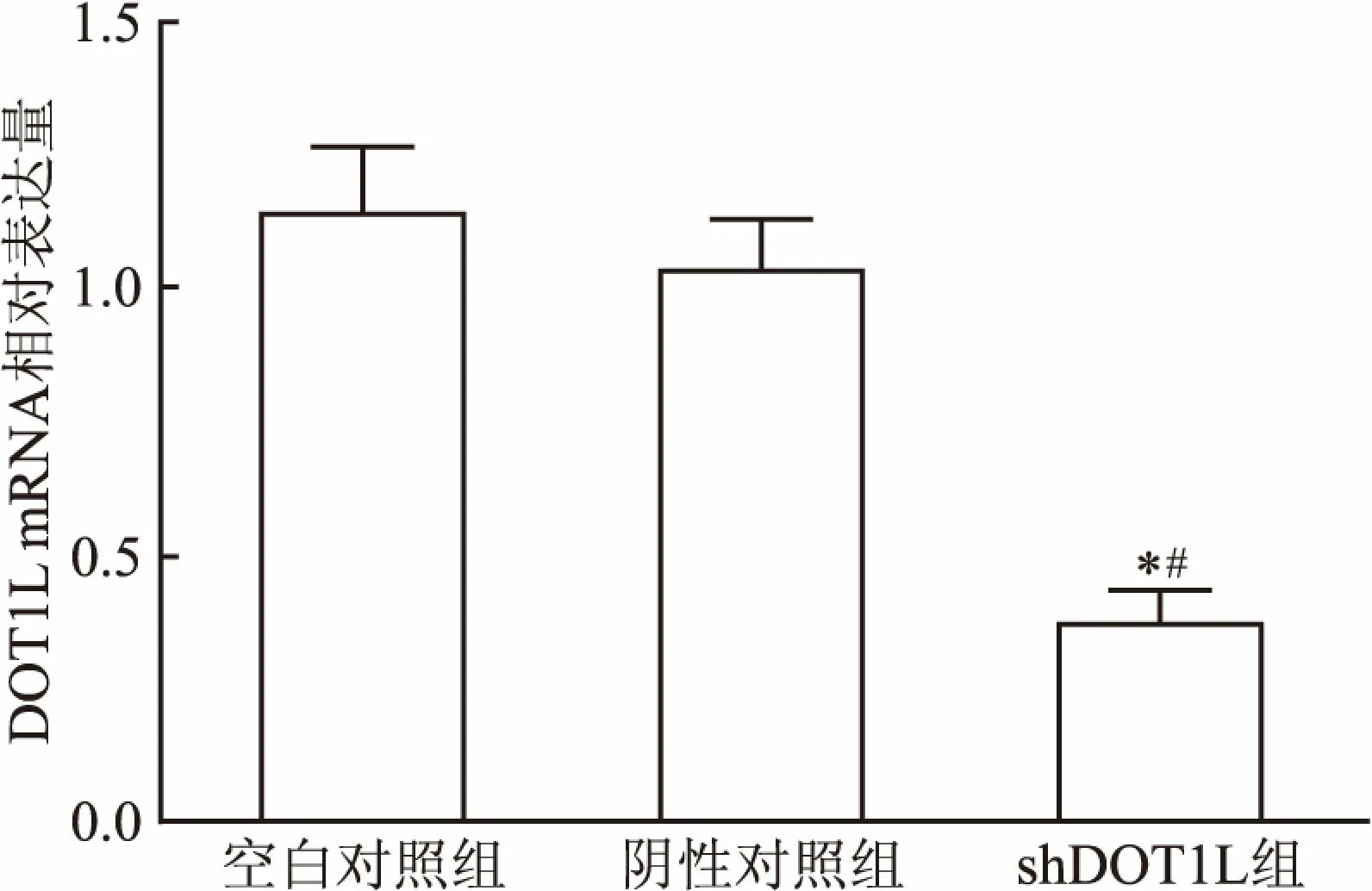
图2 Real-time PCR检测DOT1L mRNA水平
与空白对照组比较:*P<0.05;与阴性对照组比较:#P<0.05
2.3 Western blot法检测3组细胞DOT1L甲基化水平shDOT1L组细胞内H3K79me1、H3K79me2和H3K79me3的表达水平显著降低,灰度值差异具有统计学意义(F=71.100,P<0.05;F=104.800,P<0.05;F=33.940,P<0.05)。H3K79甲基化水平下调表明MGC-803细胞的DOT1L基因干扰有效。这与荧光定量PCR结果一致,证明该细胞可用于后续实验,见图3。
A:Western blot法检测干扰DOT1L表达对H3K79甲基化蛋白相对表达水平的影响;B:干扰DOT1L表达对H3K79甲基化蛋白相对表达量的影响;与空白对照组比较:*P<0.05;与阴性对照组比较:#P<0.05
2.4 细胞集落克隆实验和CCK-8法检测细胞增殖能力① 细胞集落克隆结果显示,转染DOT1L-shRNA慢病毒后细胞形成的集落密度大小尚不及对照组。选取5个固定位置,使用倒置显微镜40倍镜下拍照,空白对照组、阴性对照组及shDOT1L组平均集落数分别为(11.80±0.97)、(12.00±1.00)和(4.20±0.66),差异有统计学意义(F=24.920,P<0.05),见图4。② CCK-8实验结果显示, shDOT1L组细胞在48、72、96 h的增殖效率明显低于空白对照组和阴性对照组,差异有统计学差异(F=21.440,P<0.05;F=11.390,P<0.05;F=36.620,P<0.05)。以上结果提示干扰DOT1L基因表达抑制MGC-803细胞的增殖能力,见图5。
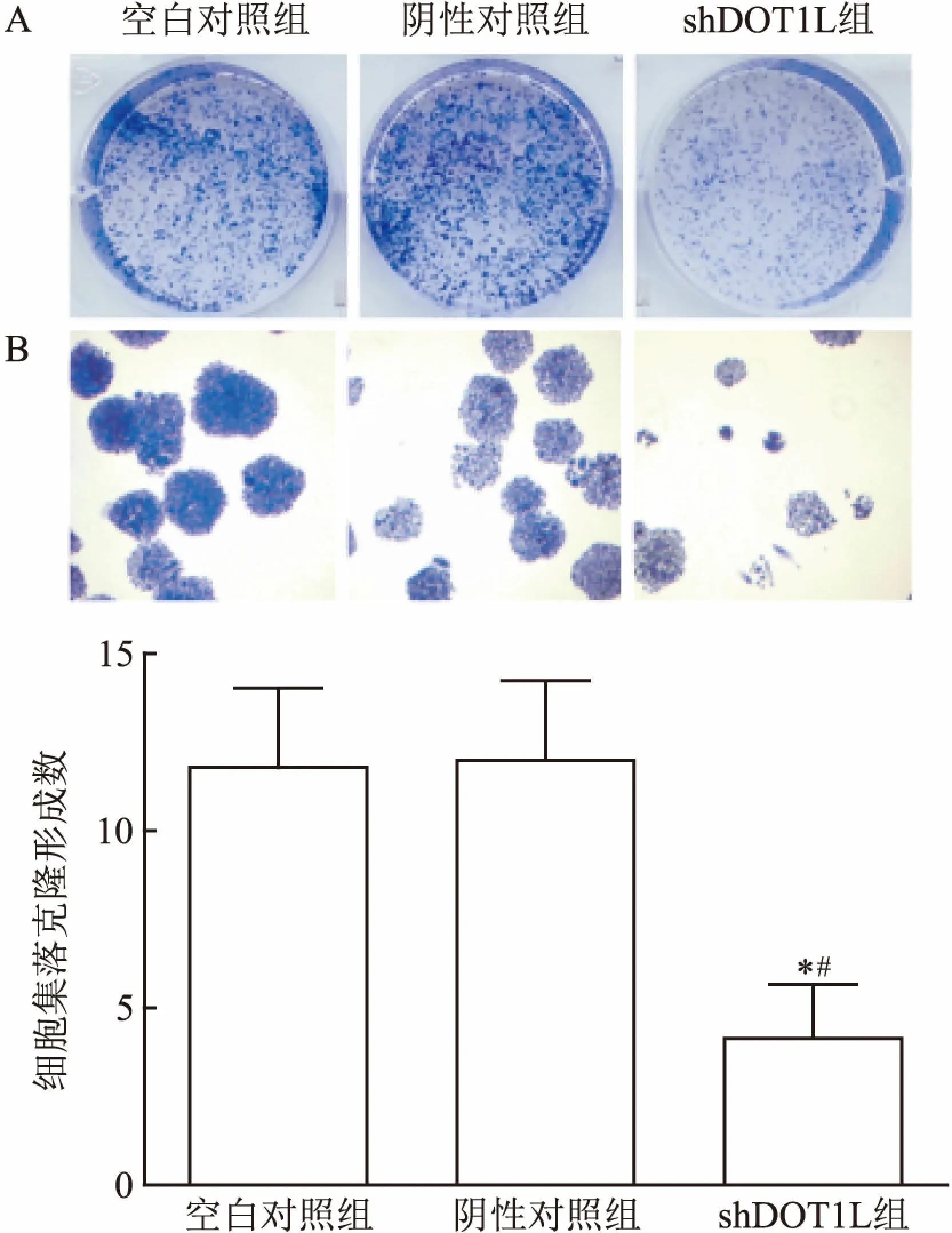
图4 细胞集落克隆实验检测MGC-803细胞增殖效率
A:不同组别细胞平板克隆结晶紫染色结果;B:不同组别倒置显微镜下细胞团块数量×40;与空白对照组比较:*P<0.05;与阴性对照组比较:#P<0.05
2.5 划痕实验检测细胞体外迁移能力空白对照组及阴性对照组细胞迁移率为(56±1.05)%、(51±1.31)%,shDOT1L组迁移率为(25±1.33)%。结果表明,干扰DOT1L表达的MGC-803细胞24 h的迁移能力显著降低,差异有统计学意义(F=43.600,P<0.05),见图6。
2.6 Transwell实验检测细胞迁移及侵袭能力Transwell侵袭实验结果显示,24 h后shDOT1L组迁移细胞数(62.33±6.89)较空白对照组(226.70±9.39)和阴性对照组(208.30±12.67)显著减少,差异有统计学意义(F=82.190,P<0.05)。Transwell迁移实验结果显示, 24 h后空白对照组、阴性对照组和shDOT1L组细胞穿膜数分别为(356.70±21.17)、(331.30±12.81)、(169.00±9.64),差异具有统计学意义(F=44.110,P<0.05)。这表明干扰DOT1L基因表达能够明显减弱MGC-803细胞的迁移和侵袭能力,见图7。
2.7 Western blot法检测EMT标识基因蛋白表达水平结果显示,干扰DOT1L表达可以减少MGC-803细胞中N-Cadherin和Vimentin的表达, 差异具有统计学意义(F=20.400,P<0.05;F=23.730,P<0.05),而E-Cadherin蛋白表达增加(F=76.060,P<0.05)。这一结果说明,下调DOT1L基因能部分逆转MGC-803细胞的EMT表型,见图8。
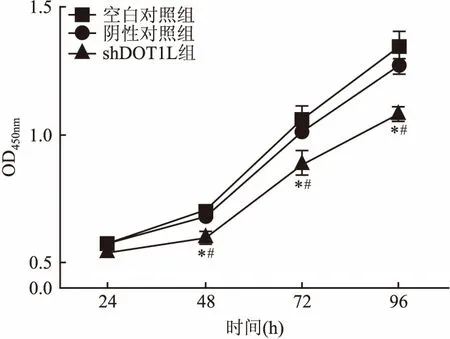
图5 CCK-8验检测细胞增殖效率
与空白对照组比较:*P<0.05;与阴性对照组比较:#P<0.05
3 讨论
DOT1L是一种赖氨酸甲基转移酶,可以使组蛋白H3的第79位赖氨酸(H3K79)产生单甲基、二甲基和三甲基化[8]。在哺乳动物体内,H3K79甲基化与转录的活性相关[9]。有研究[10]表明,在混合谱系白血病中,DOT1L抑制剂让机体可以产生较强的抗肿瘤作用。针对DOT1L基因高表达的肺癌和乳腺癌以及伴有MYCN扩增的的神经母细胞瘤,DOT1L基因同样也是潜在的治疗靶点[11-13]。然而,目前DOT1L对胃癌的发生发展有何影响,尚无相关报道。
本研究以DOT1L基因高表达的胃癌细胞系MGC-803为研究对象,设计针对DOT1L的pLKO.1puro-DOT1L-shRNA感染MGC-803细胞。成功筛选出DOT1L低表达的细胞株后,探讨其对细胞增殖能力的改变以及EMT与迁移侵袭能力改变与的相关性。结果显示,转染后实验组mRNA和相关蛋白的表达均较对照组显著降低,表明转染模型成功建立。通过CCK-8法验证其抑制MGC-803细胞的增殖活性。细胞集落克隆形成实验结果显示,DOT1L表达能力降低可显著抑制MGC-803细胞集落的形成能力,表现为集落数目显著减少,细胞形态多种多样,而对照组细胞大小形态一致,集落生长旺盛。该结果表明,DOT1L基因在胃癌MGC-803细胞恶性增殖过程中发挥着重要作用。迁移实验结果显示,干扰DOT1L表达后,胃癌MGC-803细胞体外迁移速度明显减慢,Transwell上室的穿膜细胞数明显减少。在Transwell侵袭实验中,自上室侵袭至下室的细胞数目同样减少。因此,DOT1L基因表达降低也会减弱MGC-803细胞的迁移和侵袭能力。

图6 细胞划痕实验检测胃癌MGC-803细胞迁移能力
A:不同组别细胞划痕实验结果×100;B:不同组别细胞迁移率结果比较分析;与空白对照组比较:*P<0.05;与阴性对照组比较:#P<0.05
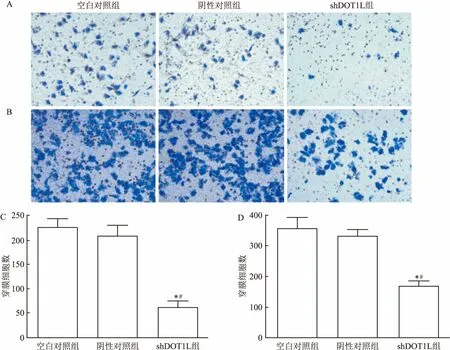
图7 Transwell小室实验检测细胞侵袭和迁移能力
A:Transwell侵袭实验不同组别穿透小室的结晶紫染色结果×200;B:Transwell迁移实验不同组别穿透小室的结晶紫染色结果×200;C:Transwell侵袭实验不同组别穿透小室细胞数量;D:Transwell迁移实验不同组别穿透小室细胞数量;与空白对照组比较:*P<0.05;与阴性对照组比较:#P<0.05
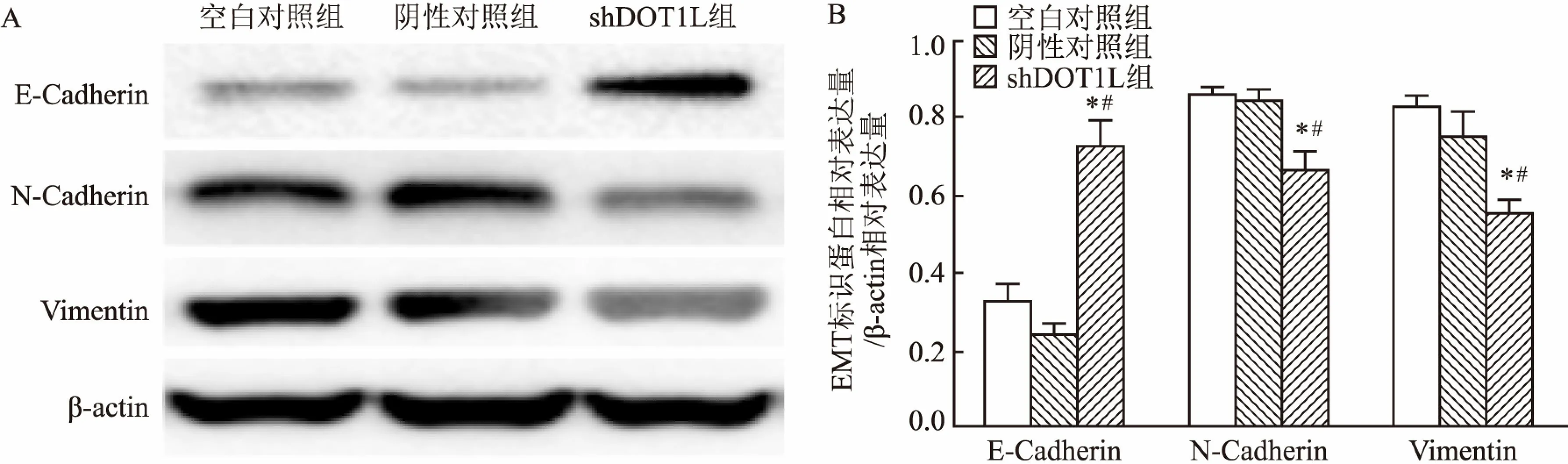
图8 干扰DOT1L表达对EMT标识基因蛋白表达的影响
A:Western blot法检测干扰DOT1L表达对EMT标识蛋白相对表达水平的影响;B:干扰DOT1L表达对EMT标识蛋白相对表达量的影响;与空白对照组比较:*P<0.05;与阴性对照组比较:#P<0.05
EMT不仅是一种复杂的多步骤过程, 它还是一种复杂的形态学变化过程, 并与上皮和间充质基因的转录或表达水平改变有关[14]。例如上皮细胞标记物E-Cadherin表达减少, 会导致上皮细胞的极性降低,细胞与细胞之间的连接减弱,而N-Cadherin与Vimentin表达增加则使肿瘤细胞迁移和侵袭潜力增强[15]。本研究发现, 干扰DOT1L基因正常表达后, 胃癌MGC-803细胞的EMT过程也会受到影响,表现为E-Cadherin的表达上调而N-Cadherin及Vimentin的表达下调。这或许表明干扰DOT1L基因表达导致EMT过程受到抑制,进而导致胃癌MGC-803细胞的侵袭和迁移能力发生改变。
该研究通过成功干扰DOT1L基因表达,研究实验组与对照组MGC-803细胞增殖、迁移及侵袭能力的改变。结果表明,干扰DOT1L基因表达后可显著减弱MGC-803细胞的体外增殖能力。体外侵袭和迁移能力同样减弱明显,其机制可能与调控EMT相关蛋白的表达有关。因此,考虑靶向阻断或者干扰人体内DOT1L基因生物学作用,或许能给胃癌的治疗提供新的思路。由于胃癌MGC-803细胞并不能完全代表其他类型的胃癌细胞系,体外细胞实验亦不能够完全模拟体内生理生化环境,因此该实验也存在一定的局限性。为明确DOT1L基因作用于胃癌细胞的具体机制,需要进一步的探索研究。

