糖化血红蛋白、超敏C-反应蛋白、胱抑素C、25-羟基维生素D与2型糖尿病并发视网膜病变的相关性研究
田 瑶,任建国,王耀勇
(山西省汾阳医院,山西 吕梁032200)
随着经济的发展,人们生活方式及饮食习惯的改变,糖尿病(diabetes mellitus,DM)的患病率逐渐升高。根据2013年调查显示,全国男性DM患病率为12.1%,女性为11.0%[1]。糖尿病视网膜病变(diabetic retinopathy,DR)为DM患者常见的微血管并发症之一,2型糖尿病(type 2 diabetes mellitus,T2DM)住院患者DR的患病率高达32.7%[2],已成为全球首位致成人失明的原因[3]。目前,DR诊断主要依靠专业眼科医师运用相关设备确诊,故在临床上难以普及。早期发现DR并采取相应治疗措施是延缓DR进展的关键。在以往研究中,血清中的糖化血红蛋白(Hb A1c)、超敏C-反应蛋白(hs-CPR)、胱抑素-C(Cys-C)、25-羟基维生素D[25-(OH)D]水平与T2DM患者并发DR是否具有相关性结果不一致,也没有系统性分析四者与DR之间的关系[4-7]。本研究对160例T2DM并发DR患者的Hb A1c、Cys-C、hs-CPR、25-(OH)D水平进行系统性分析,现报道如下。
1 临床资料
1.1 一般资料 选取2017年7月至2019年1月在汾阳医院住院治疗的T2DM并发DR患者80例为观察组(DR组),观察组又分为增殖期DR组(PDR组)27例,非增殖期DR组(NPDR组)53例,同时选取单纯T2DM患者80例为对照组(NDR组)。DR组男45例,女35例;年龄(56.21±10.31)岁;体质量指数(BMI)(24.29±3.07)kg/m2;收缩压(137.96±22.06)mm Hg(1 kPa=7.5 mm Hg),舒张压(82.40±10.71)mm Hg。NDR组男42例,女38例;年龄(53.42±11.81)岁;BMI(25.32±3.53)kg/m2;收缩压(139.50±19.48)mm Hg,舒张压(83.79±15.14)mm Hg。两组患者一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准,患者均签署知情同意书。
1.2 纳入标准 符合《中国2型糖尿病防治指南》中2型糖尿病诊断标准[8]:有糖尿病症状和静脉血浆葡萄糖浓度≥11.1 mmol/L,或空腹血浆葡萄糖浓度≥7.0 mmol/L,或口服葡萄糖耐量试验2 h的血糖浓度≥11.1 mmol/L;DR的诊断标准参照《我国糖尿病视网膜病变临床诊疗指南》[9]。
1.3 排除标准 1型糖尿病及其他眼底疾病者;合并有严重心、肺、脑、肾、肝疾病者;长期服用影响骨代谢药物者;有甲状旁腺疾病、恶性肿瘤、消化道疾病者。
2 研究方法
2.1 观察指标及检测方法 采集患者清晨空腹静脉血,检测空腹血糖(FPG)、Hb A1c、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、载脂蛋白A1(apo A1)、载脂蛋白B(apoB)、Cys-C、hs-CPR、25-(OH)D水平。采用奥林巴斯2700全自动生化分析仪检测FPG、TC、TG、HDL-C、LDL-C、apo A1、apoB、Cys-C、hs-CPR水平;采用D10糖化血红蛋白分析仪测定Hb A1c水平;采用罗氏e601电化学发光分析仪测定25-(OH)D水平。
2.2 统计学方法 采用SPSS 25.0统计学软件分析数据。计量资料以均数±标准差s)表示,采用t检验;使用Logistic回归模型分析相关指标与T2DM并发DR发展过程的相关性。P<0.05为差异有统计学意义。
3 结果
(1)血糖及血脂指标比较 两组患者FPG、TC、TG、HDL-C、LDL-C、apo A1、apoB水平比较,差异均无统计学意义(P>0.05)。见表1。
表1 两组2型糖尿病患者血糖及血脂指标比较s)
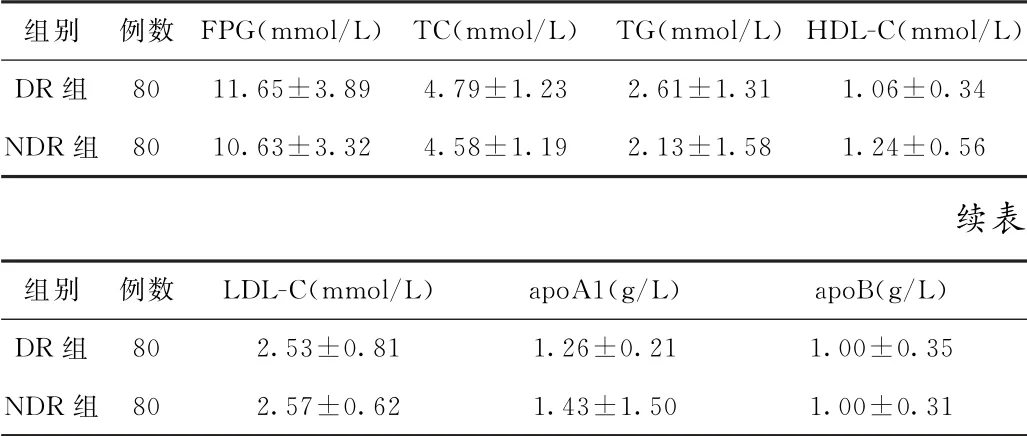
表1 两组2型糖尿病患者血糖及血脂指标比较s)
组别 例数FPG(mmol/L)TC(mmol/L)TG(mmol/L)HDL-C(mmol/L)DR组80 11.65±3.89 4.79±1.23 2.61±1.31 1.06±0.34 NDR组80 10.63±3.32 4.58±1.19 2.13±1.58 1.24±0.56续表组别 例数 LDL-C(mmol/L) apo A1(g/L) apoB(g/L)DR组80 2.53±0.81 1.26±0.21 1.00±0.35 NDR组80 2.57±0.62 1.43±1.50 1.00±0.31
(2)Hb Alc、Cys-C、hs-CPR、25-(OH)D水平比较 DR组HbAlc、Cys-C、hs-CPR水平均高于NDR组(P<0.05),25-(OH)D水平低于NDR组(P<0.05)。见表2。
表2 两组2型糖尿病患者糖化血红蛋白、超敏C-反应蛋白、胱抑素C、25-羟基维生素D水平比较s)

表2 两组2型糖尿病患者糖化血红蛋白、超敏C-反应蛋白、胱抑素C、25-羟基维生素D水平比较s)
注:与NDR组比较,△P<0.05
组别 例数 Hb Alc(%)Cys-C(mg/L)hs-CPR(mg/L)25-(OH)D(ng/m L)DR组80 8.77±1.98△0.95±0.28△1.06±0.57△18.03±4.10△NDR组80 8.05±1.99 0.80±0.25 0.82±0.52 16.35±3.51
(3)不同分期2型糖尿病并发视网膜病变患者相关指标比较 PDR组Hb Alc、Cys-C及hs-CPR水平均高于NPDR组(P<0.05),25-(OH)D水平低于NPDR组(P<0.05)。见表3。
表3 不同分期2型糖尿病并发视网膜病变患者相关指标比较s)
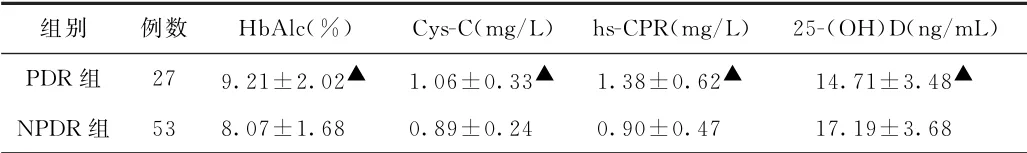
表3 不同分期2型糖尿病并发视网膜病变患者相关指标比较s)
注:与NPDR组比较,▲P<0.05
组别 例数 Hb Alc(%) Cys-C(mg/L)hs-CPR(mg/L)25-(OH)D(ng/m L)PDR组 27 9.21±2.02▲ 1.06±0.33▲ 1.38±0.62▲ 14.71±3.48▲NPDR组 53 8.07±1.68 0.89±0.24 0.90±0.47 17.19±3.68
(4)DR不同严重程度Logistic回归分析 Hb Alc、hs-CPR为DR严重程度的独立危险因素(P<0.05),25-(OH)D为DR严重程度的保护性因素(P<0.05)。见表4。

表4 2型糖尿病并发视网膜病变严重程度相关因素的Logistic回归分析
4 讨论
DR是由多种因素所致的视网膜血管系统损害,为T2DM患者常见的微血管并发症之一。NPDR为DR的早期阶段,表现为出血点、微血管瘤、硬性渗出、棉絮斑及视网膜水肿等。随着NPDR的加重,发展为PDR即晚期阶段,表现为新生血管形成、玻璃体积血、玻璃体机化等,该期患者视力严重下降。新生血管形成和慢性水肿不仅与糖代谢紊乱有关,还与血液流变学异常及脂质代谢密切相关,是早期DR发生的主要原因[10]。
DM患者常通过监测FPG来反映血糖水平,但易受多种因素影响,如测定时间、饮食、情绪等,且只能反映短时间内的血糖水平。而Hb A1c可反映患者近8~12周的血糖控制情况,故Hb A1c是评价血糖水平的最佳指标。在高血糖状态下,Hb A1c可减慢氧合血红蛋白的解离速度及红细胞的变形能力,增加红细胞黏稠度,从而导致视网膜缺氧、缺血[4]。
炎症反应在DR的发生、发展中起着重要作用[11]。在早期DM动物模型中证实,DR时视网膜内确实存在炎症反应[12]。炎症反应可能造成DM患者脂肪代谢紊乱,引起血清CRP水平升高,促进血管周围脂肪组织巨噬细胞浸润,使血管内皮细胞损伤及发生功能障碍[5,13]。hs-CRP是全身炎症反应的非特异性标志物,Cys-C及其降解产物能激活中性粒细胞,介导炎性反应。研究表明,大鼠眼球玻璃体和各层视网膜均表达Cys-C,而高Cys-C水平可增加视网膜血管的通透性,刺激眼内新生血管生长[14]。血清中25-(OH)D水平是评价人体维生素D营养状态的最佳指标。补充外源性维生素D(V-D)可减轻慢性炎症反应,减轻胰岛素抵抗,增加胰岛素敏感性[7,15-16]。有研究显示,V-D水平与DR严重程度呈负相关,当25-(OH)D水平小于15.57 g/L时,发生严重且危及视力的DR风险是其他T2DM患者的两倍,可作为预测DR严重程度的重要指标之一[17-18]。而V-D与hs-CPR水平呈负相关,提示慢性炎症反应在DR发生过程中的重要性[19]。
本研究结果显示,DR组Hb Alc、Cys-C、hs-CPR水平均高于NDR组,25-(OH)D水平低于对照组NDR组。Hb Alc、hs-CPR为DR严重程度的独立危险因素,25-(OH)D为DR严重程度的保护性因素。
综上所述,随着T2DM患者病程的进展,各种并发症可能随之出现。由于DR早期症状不明显,很容易被患者忽略。定期检测Hb Alc、Cys-C、hs-CPR、25-(OH)D可能是早期发现DR的重要方法。严格控制血糖、Cys-C、hs-CPR水平,补充25-(OH)D可能对延缓T2DM并发DR的发生发展具有重要意义。

