多模式小动物活体成像系统在本科生创新实践中的使用与开发
姜丽艳,闫国栋,王德利
(吉林大学 生命科学学院,吉林 长春 130012)
为了合理配置大型仪器的优质资源,提高学科发展水平,吉林大学生命科学公共技术平台购置了多模式小动物活体成像系统. 型号为FX PRO,厂家为美国柯达公司(以下简称FX PRO活体成像系统). 该系统可实现多波长荧光成像、生物学发光成像、X光成像和同位素成像,为癌症的发生及发展、基因治疗、免疫学、siRNA、干细胞和蛋白质相互作用及分子生物学等研究领域提供了直观的活体侦测手段[1]. 同时,FX PRO活体成像系统也可监测体内肿瘤的原位变化、药物分布和蓄积、血管和脏器的动态变化、免疫荧光标记物示踪和分子相互作用及共定位等[2]. 此外,FX PRO活体成像系统还具有监测毫秒级别的钙离子浓度的瞬间变化、化合物和底物在体内的分布和扩散、免疫反应以及动物麻醉和清醒状态下的药代动力学研究等[3-4].
虽然该台仪器在国内外生物制药业、科研机构和高等院校已经被广泛应用,但由于其操作繁琐,而且学生对活体成像的相关知识和实验技术还很陌生,所以本科教学实验中还未涉及活体成像系统,如此直接影响了学生整体科研素质的提高[5]. 本文旨在结合该台仪器的特点和学生的具体实验需求情况,系统的介绍FX PRO活体成像系统的使用操作和注意事项,使学生能够熟悉活体成像的相关实验流程和操作,并通过多种渠道拓宽活体成像的实验资源,开拓学生视野,增强活体成像知识,丰富研究性实验类型.
1 实验动物模型的制作
动物体内很多物质如皮毛和血液在受到激发光激发后,会发出自发荧光,影响检测的灵敏度. 所以,活体成像实验时,要尽量使用实验裸鼠制作动物模型. 而且,动物的尿液或其他杂质也应尽量及时清除,否则成像中也会出现非特异性信号,影响检测结果的灵敏度. 相关动物模型的建立可以通过尾静脉注射、皮下移植或原位移植等方法在实验裸鼠体内接种已标记的细胞或组织. 但在建模时应认真考虑实验目的,并选择正确的荧光标记,尤其是做多个荧光标记时,一定要尽量防止荧光串色现象的发生. 而且要注意当标记荧光波长短时,则穿透效率不高. 如果建模时不宜接种深部脏器和观察体内转移,可以观察皮下瘤和解剖后脏器直接成像. 深部脏器和体内转移的观察大多选用荧光素酶标记.
2 FX PRO活体成像系统的图像拍摄和处理
开启MI测试软件后,等待大约15 s,系统电荷耦合器件(CCD)的实时温度降至-29 ℃,仪器才能正常使用. 系统工作界面分为菜单栏、Capture按钮、拍摄界面、导航面板、快捷键、主窗口和仪器状态显示栏7个区. 点击“Capture”按钮,弹出拍摄界面. 先进行光场校正后再完成图像拍摄[6].
2.1 光场校正
活体成像系统可完成X-Ray、生物发光、荧光和白光的单模式拍摄,除生物发光不需要光源,无需进行光场校正之外,其他3种单模式拍摄方式都需要进行光场校正. X-Ray光场校正时使用的是X光磷屏,确保X光磷屏与滑轨正确连接. 荧光校正时使用EPI屏,放置于动物箱的左侧位置,选择软件界面的“Preview”进行预览,确保动物箱的滑轨已滑至右侧. 光场校正时在软件界面的Illumination source选取Illuination reference,在系统默认的参数基础上,进行光场较正,点击“expose”,光场较正后,会出现光场较正文件,选择“No”. 所有参数设定完成后,点击“new”,设定文件名,保存完成所有参数的设定. 白光的光场校正方法与荧光相同. 拍摄时再将illumination Reference重新选为“Auto select”再进行单图像拍摄.
2.2 图像的拍摄
图像的拍摄分为单模式拍摄、多模式拍摄和特定模式的拍摄. 单模式拍摄是所有拍摄的基础,也是本科生实验常用的拍摄方法,每个模式的图像拍摄都要进行正确的参数设定,才能获得高质量的实验图像. 因涉及的设定参数较多,结合多年活体成像系统的使用经验,对单模式拍摄的常规拍摄参数进行了总结,仅供参考,要根据具体的实验进行实际调节(如表1所列). 多模式拍摄是在单模式拍摄参数设定完成后进行的拍摄,确保单模式的视野设定一致,而且一般X光拍摄放到最后. 特定模式的拍摄包括常用于荧光拍摄的延时曝光拍摄,常用于生物发光的累进曝光拍摄和常用于X光的局部高清拍摄.
2.3 图像的处理
图像的处理包括图像编辑,图像叠加和图像输出. 活体成像系统采集的是光的强弱,而不是光的颜色,所以需要对图像可以进行伪彩添加编辑. 伪彩是将灰阶显示的图像转变为彩色显示. 常用的伪彩显示颜色为RGB-Spectrum、fire、grayscale等,根据实验的对象,用户可自行选择伪彩. 也可以用“invert”进行背景颜色的反转. 常用的图像叠加一般为荧光成像或生物发光成像和X-光成像进行叠加,叠加的要求是两张图像拍摄的是同一张图像,并已分别完成编辑,且达到最佳显示效果,而且必须视野设定相同;选中X-光图像的上方,然后在“image display”下拉菜单中,选择“overlay”,点击“transparency”,叠加完成. 拍摄完成的图像,选择“annotation”填加注释,选择“add annotation bar”填加标尺,选择 “file-export data-image”进行图像的输出,如输出的图像带有标尺格式,必须选择*.emf的格式.
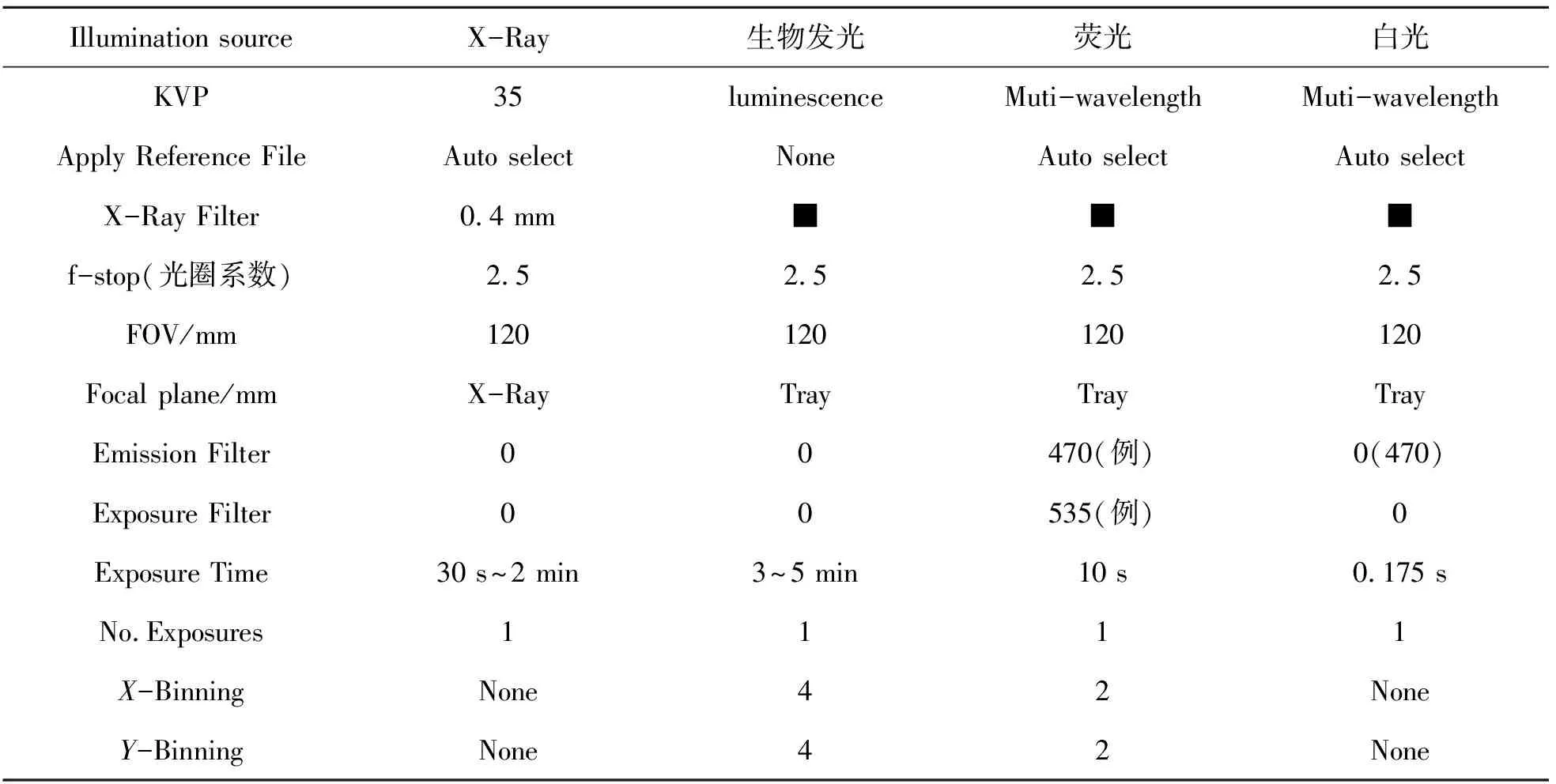
表1 单模式拍摄的常规参数设定Table 1 General parameter settings of single mode shooting
注:Binning为像素合并,可以有效的提高像素的灵敏度,分为X-Binning和Y-Binning,设定时先设定Y-Binning,再设定X-Binning. FOV 视野,一般2~3只老鼠视野为120或150. Excitation:激发滤光片 可进行单个或多个选择. Emission:发射滤光片,如未找到所需要的滤光片时,用户可进行自行安装. 激发光和发射光滤光片的放置可以根据需要进行更换,但“0”位置必须空着,不能放置滤光片. 而且,滤光片长时间不用时必须拿下来进行妥善保存. 其余参数的设定仅供参考,需要根据具体实验进行调节.
3 FX PRO活体成像系统在本科生创新实践中的开发
3.1 深化基础本科教学实验内容
国内高校开设的生理学基础实验中,一般都是经典的成型实验,对理论课的教学起到了很好的辅助作用. 但经典实验方法简单,不容易调动学生的实验积极性,不能有效的锻炼学生的思考和逻辑思维能力[7-8]. 为了有效的调动学生的学习兴趣,实现生理学实验的开设意义,创新性的将活体成像系统引入本科生的生理实验教学,通过尝试开展观察小鼠的骨骼形态,实时监测小鼠体内肿瘤的原位变化和药物在体内的代谢过程等功能性实验,逐渐延深生理基础实验内容,进而提升基础生理实验的质量[9]. 在接触和使用活体成像的过程中,学生能够更加了解活体成像技术及其在科学研究中的应用(如图1、2所示).
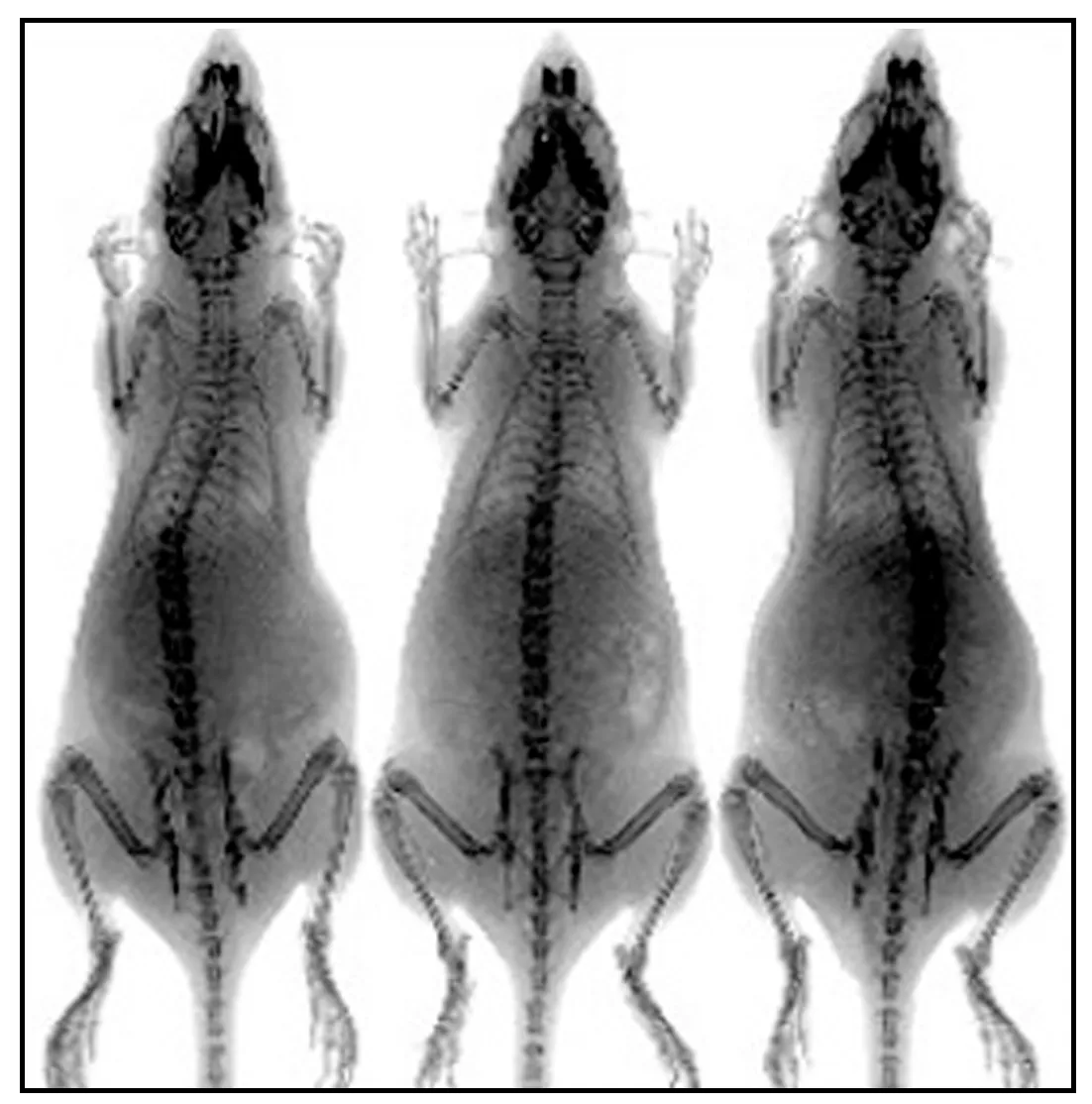
图1 X-ray拍摄Fig. 1 X-ray shooting

图2 荧光成像和X-ray图像叠加Fig. 2 Fluorescence imaging and X-ray image superposition
3.2 开发研究性创新实验项目
充分利用活体成像系统,为本科学生开设大学生创新实验项目,开放创新项目和本科生毕业设计实验等创新研究性实验项目. 实验内容的设置要兼顾基础性和延展性,力求将基础实践教学与科学研究进行完美结合[10-11]. 如开设了疾病生物标志物研究项目,培养学生掌握活体成像系统的使用. 进而设置了酶与细胞增殖调控及肿瘤生物治疗研究性项目,使学生掌握小鼠模型建立等技术[12-13]. 在实验的过程中学生可以参与小鼠饲养、麻醉和模型建立,掌握活体成像系统的样品准备,熟悉活体成像系统的基础操作和图像处理等实验的全过程. 基于活体成像系统开设的研究型创新实验项目进一步增强了学生对生理学实验的深刻理解,推动研究型学习和创新性教学方式的改革,同时,也能够促进大型仪器设备的资源共享,加强本科教学的开放和服务,提高大型仪器设备利用率[14-16].
4 结论
多模式小动物活体成像系统可以对活体状态下的生物进行细胞和分子水平的定性和定量研究,具有特异性,强大的标记技术和非侵害性等优点[6]. 通过对活体成像系统使用方法的介绍和使用资源的拓展,为活体成像系统的规范使用和高效运转提供了强有力的支持和保障,为培养大学生的创新性实验思维奠定了坚实的基础.

