纯钛表面不同管径微纳米改性对大鼠骨髓间充质干细胞生物学行为的影响*
张 琰 石梦琪 吴 群 刘慜妮 张玉梅
钛作为一种牙科种植材料广泛应用于临床,已经获得了较高的成功率。由于钛是一种惰性金属,缺乏生物活性,所以在临床应用过程中仍然存在愈合时间长,种植体骨结合不良等问题[1]。种植体与骨组织之间良好的骨结合是种植体行使功能的基础,也是种植成功的关键,为了获得更快更好的骨结合,学者们对钛表面进行各种表面改性以提高钛的生物学活性[2]。微米坑复合TiO2纳米管形貌(micropit/nanotube topography,MNT)高度模拟了天然骨组织结构,表现出较强的诱导成骨能力[3]。大量研究发现,不同尺寸纳米管管径的微纳米形貌其诱导成骨能力存在一定差异[4],但目前还缺乏纳米管管径对接种在经过微纳米处理的纯钛种植体表面细胞生物学行为的影响的系统评价及相关报道。本研究采用酸蚀后在不同电压下阳极氧化的方法制备了具有不同纳米管管径的MNT 钛试样,以原代培养的大鼠骨髓间充质干细胞(rat bone marrow mesenchymal stem cells,rBMMSCs)为研究对象,采用扫描电镜,体式显微镜,CCK-8,qRT-PCR,ALP、胶原、矿化结节染色及半定量等方法系统地研究了不同管径的微纳米形貌对rBMMSCs 生物学行为的影响,以便为种植体表面优化设计及提高骨结合提供依据。
1.材料和方法
1.1 主要材料、试剂和仪器 大鼠骨髓间充质干细胞,取自1 周龄SD 大鼠(空军军医大学实验动物中心)。纯钛试样(99.8%,10mm×10mm×1mm,西北有色金属研究院);400-7000 目碳化硅水砂纸(MATADOR,德国);改良型α-MEM 培养基(Hyclone,美国);胎牛血清(四季青,浙江天杭生物科技有限公司);4%多聚甲醛、维生素C、β-甘油磷酸钠、地塞米松、1%茜素红试剂(Sigma,美国);细胞计数测试盒(Cell counting kit-8,CCK-8,碧云天,中国);TRIzol RNA 提取试剂(Invitrogen,美国);cDNA 反转录试剂盒、qRT-PCR 试剂盒(Takara,日本);引物合成(奥科生物技术公司,北京);5-溴-4-氯-3-吲哚磷酸/氯化硝基四氮唑蓝(5-bromo-4-chloro-3-indolyl posphate/tetranitroblue tetrazolium chloride,BCIP/NBT)碱性磷酸酶(ALP)显色试剂盒、天狼星红-苦味酸溶液(雷根生物技术有限公司,北京);碱性磷酸酶测试盒(上海碧云天生物技术有限公司);Micro BCA 蛋白检测试剂盒(Thermo Scientific Pierce,美国)。阳极氧化电源(DH1720A-6,北京大华无线电仪器);场发射扫描电镜(S-4800,Hitachi,日本);CFX96 实时荧光定量PCR 仪(Bio-Rad,美国);体视显微镜(Lecia M125,德国);紫外线分光光度仪(Eppendorf,德国);酶联免疫检测仪(Thermo,美国)。
1.2 试样制备与表面形貌观察 纯钛试样用400-7000 目SiC 水砂纸顺次抛光,制备光滑对照组(Polished Ti,PT)。将抛光后的钛试样浸于0.5wt%HF 酸蚀20min 后,在0.5wt%HF 电解液中阳极氧化1h,其中以钛试样为阳极,以石墨棒为阴极,阳极氧化电压分别设为5V、10V 和20V,制备不同纳米管管径的微纳米形貌组:MNT5、MNT10和MNT20。所有钛试样顺次在丙酮、无水乙醇和去离子水中超声清洗15min 后,酒精浸泡,紫外线照射消毒以备用。
PT、MNT5、MNT10 和MNT20 试样经超声清洗、室温干燥后,随机各抽取6 个,在场发射扫瞄电镜下观察试样表面形貌,并比较纳米管管径的差异。
1.3 rBMMSCs 分离培养 无菌条件下解剖分离SD 大鼠的股骨与胫骨,切断骨骺端,用含青/链霉素及10%胎牛血清的α-MEM 培养液将骨髓冲出,收集于15ml 离心管,800rpm 离心5min,细胞重悬后接种于细胞培养瓶,在含5%CO2的37℃细胞培养箱内孵育。当细胞生长至培养瓶底面积的75%-85%时,用含有EDTA 的胰蛋白酶消化细胞,培养液终止消化,离心弃上清,培养液重悬细胞,放入75cm2的培养瓶中,完成传代。第2-4代细胞用于实验。
1.4 不同管径的MNT 对rBMMSCs 形态的影响 将PT、MNT5、MNT10 和MNT20 钛试样置于24 孔培养板,细胞接种密度为2×104个/ml、1ml/孔(每组设置6 个试样)。细胞接种12h 后,PBS 漂洗3 次,2.5%戊二醛固定,4℃过夜。依次用30%、50%、70%、80%、90%、95%、100%、100%乙醇梯度脱水8~10min。临界点干燥后即刻喷金,扫描电镜下观察不同钛试样表面的细胞形态变化。
1.5 不同管径的MNT 对rBMMSCs 细胞活力的影响 试样放置与细胞接种同1.4。每组设置12个试样(分别用于检测细胞在试样表面接种3d 和7d 后的细胞活力)。分别在细胞接种3d 和7d,将钛试样转移至新的24 孔培养板,PBS 漂洗3 次,采用CCK-8 测试盒检测rBMMSCs 细胞活力,加入CCK-8 检测液,37℃细胞培养箱内孵育2h,使用酶标仪在450nm 处测定吸光度值。
1.6 不同管径的MNT 对rBMMSCs 成骨功能的影响
1.6.1 钛试样表面成骨相关基因表达 试样放置和细胞接种同1.4(每组设置6 个试样)。细胞接种12h 后,将试样转移至新的24 孔培养板,PBS漂洗3 次,采用TRIzol 法提取细胞内总RNA,测定各RNA 样品浓度和纯度。使用cDNA 反转录试剂盒合成cDNA 第一链。采用qRT-PCR 试剂盒检测成骨相关基因Runx-2、ALP、OCN 和BMP2 的表达水平。相关PCR 引物序列见表1。
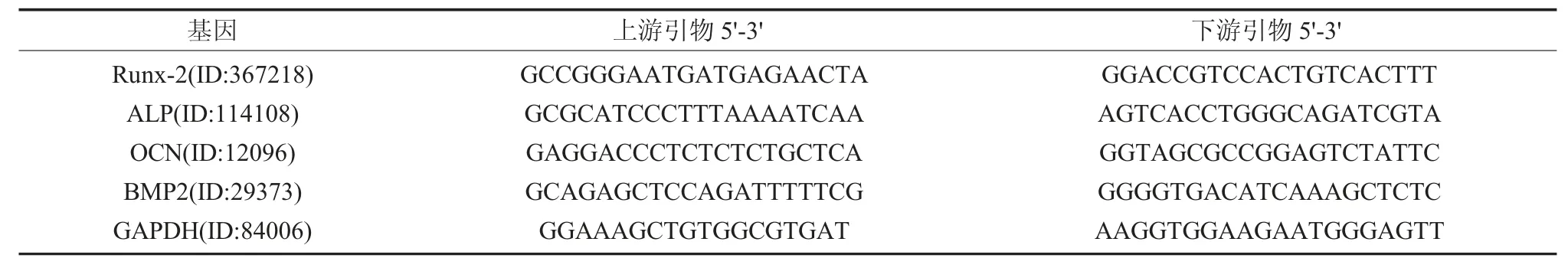
表1 成骨分化相关基因的引物序列
1.6.2 钛试样表面ALP 合成水平检测 试样放置和细胞接种同1.4(每组设置6 个试样)。细胞成骨诱导培养(成骨诱导液为含有10%胎牛血清、10%青/链霉素、10mM β-甘油磷酸钠、0.2mM维生素C、0.1μM 地塞米松的α-MEM)7d 后,PBS漂洗3 次,4%多聚甲醛固定20min。使用BCIP/NBT 碱性磷酸酶活性试剂盒进行染色,体式显微镜观察并拍照。同时,胰蛋白酶消化液消化并收集试样表面的细胞于1ml EP 管,弃上清,加入RIPA 裂解液后冰上裂解30min。4℃、12000rpm离心20min,吸取上清液,用BCA 蛋白定量测试盒检测蛋白浓度,用碱性磷酸酶测试盒检测AKP活力。
1.6.3 钛试样表面胶原分泌检测 试样放置和细胞接种同1.4(每组设置6 个试样)。细胞成骨诱导培养14d 后,PBS 漂洗3 次,4%多聚甲醛固定20min,天狼星红-苦味酸溶液室温孵育18h,体式显微镜下观察胶原分泌情况并拍照。将钛试样移至新的24 孔培养板,加入0.2mol/L NaOH/甲醇溶液处理3min。使用酶标仪在540nm 处测定吸光度值。
1.6.4 钛试样表面ECM 矿化检测 试样放置和细胞接种同1.4(每组设置6 个试样)。细胞成骨诱导培养21d 后,PBS 漂洗3 次,4%多聚甲醛固定20min,1%茜素红染色液室温孵育3min,体式显微镜下观察形成的矿化结节并拍照。将钛试样移至新的24 孔培养板,加入10%氯化十六烷基吡啶洗脱3min,使用酶标仪在620nm 处测定吸光度值。
1.7 统计学分析 所有实验至少独立重复3 次。检验数据符合正态分布,方差齐,计量数据以平均值±SD 表示。采用单因素方差分析(ANOVA)和Tukey’s 检验,进行组间两两比较,以双侧P<0.05、0.01、0.001、0.0001 为差异有统计学意义。
2.结果
2.1 试样表面形貌比较 扫描电镜观察钛试样表面形貌如图1 所示。1000 倍下,PT 表面相对光滑,隐约可见少量相对平行的细小抛光划痕,MNT5、MNT10 和MNT20 表面均可见酸蚀微米坑结构;100000 倍下,PT 表面未观察到明显的纳米级结构;MNT5、MNT10 和MNT20 表面可见分布均匀的纳米管,且随着阳极氧化电压的升高,纳米管管径逐渐增大,依次在30、50 和100nm 左右。

图1 扫描电镜观察钛试样表面形貌
2.2 不同管径的MNT 对rBMMSCs 细胞活力的影响 rBMMSCs 在钛试样表面接种3d 和7d 后,细胞活力检测结果如图2 所示。细胞接种3d 后,各组间的细胞活力无显著性差异;细胞接种7d 后,各组的细胞活力相对于接种3d 均有所升高,且MNT5、MNT10 和MNT20 组的细胞活力显著高于PT 组。
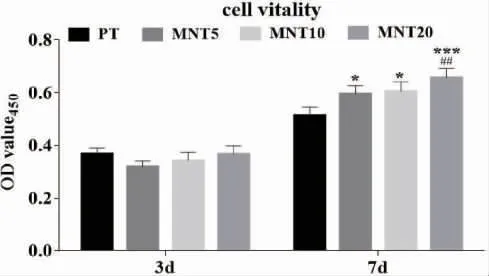
图2 CCK-8 法检测rBMMSCs 在PT、MNT5、MNT10、MNT20 钛试样表面培养3d 和7d 后的细胞活力
2.3 不同管径的MNT 对rBMMSCs 形态的影响 rBMMSCs 在PT、MNT5、MNT10 和MNT20表面接种12 h 后,扫描电镜下观察细胞形态变化,结果如图3 所示。细胞在PT 表面伸展良好,呈略微伸长的不规则多边形,细胞边缘仅见少量短小的伪足。相对于PT 表面,MNT5、MNT10 和MNT20 表面的细胞明显伸长,呈不规则梭形,在伸长的两极可见大量丝状伪足,且随着纳米管管径的增大丝状伪足更明显。
2.4 不同管径的MNT 对rBMMSCs 成骨相关基因表达水平的影响 rBMMSCs 在钛试样表面接种7d 后,采用qRT-PCR 检测成骨相关基因表达,结果如图4 所示。总体而言,微纳米形貌显著上调了成骨相关基因的表达,并且随着纳米管管径的增大,这种促进作用更加明显。3d 时,MNT5、MNT10 和MNT20 表面Runx2 的表达水平明显高于PT 表面,且随着纳米管管径的增大而增高,但各MNT 组之间并无显著性差异。ALP 和BMP2的表达水平随时间的延长而增高,3d 时MNT10、MNT20 组明显上调了ALP 和BMP2 的活性,d时MNT5、MNT10 和MNT20 表面都上调了ALP活性,MNT15、MNT20 组上调了BMP2 的表达。细胞培养7d 时,OCN 在4 组试样表面的表达水平没有明显的差别。

图3 扫描电镜观察不同钛试样表面rBMMSCs 细胞形态,rBMMSCs 接种于分别PT、MNT5、MNT10、MNT20表面12h 后,扫描电镜下观察细胞形态变化
2.5 不同管径的MNT 对rBMMSCs 内ALP合成水平的影响 rBMMSCs 在钛试样表面成骨诱导7d 后,ALP 染色和半定量结果如图5 所示。体式显微镜下可见各组钛试样表面均出现不同程度着色的蓝紫色ALP 颗粒,MNT5、MNT10 和MNT20组相对于PT 组着色均加深,且MNT20 组着色最明显。ALP 半定量分析显示:MNT5、MNT10 和MNT20 组ALP 合成水平均显著高于PT 组,且随着纳米管管径的增大而逐渐升高。
2.6 不同管径的MNT 对rBMMSCs 胶原分泌水平的影响 rBMMSCs 在钛试样表面成骨诱导14 d 后,胶原染色及半定量结果如图6 所示。体式显微镜下可见各组钛试样表面均出现不同程度着色的紫红色丝絮状分泌物,其中PT 组着色最浅,MNT5、MNT10 和MNT20 组相对于PT 组明显加深,MNT20 组着色最明显。半定量分析显示:MNT5、MNT10 和MNT20 组胶原分泌水平均显著高于PT 组,且MNT20 组明显高于MNT5 组与MNT20 组。
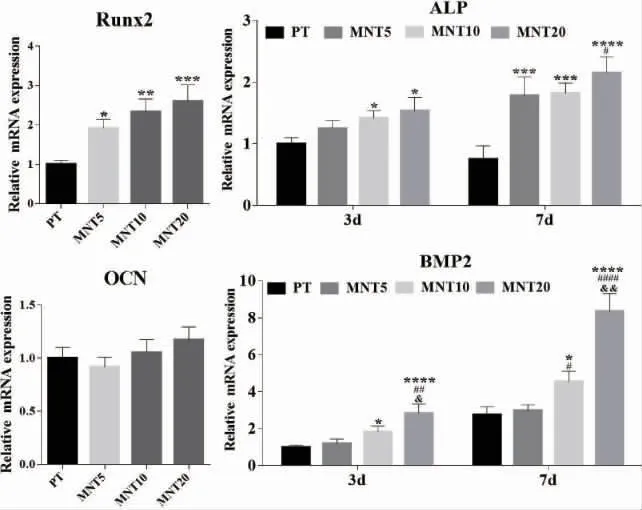
图4 qRT-PCR 技术检测rBMMSCs 在不同形貌钛试样表面成骨相关基因表达
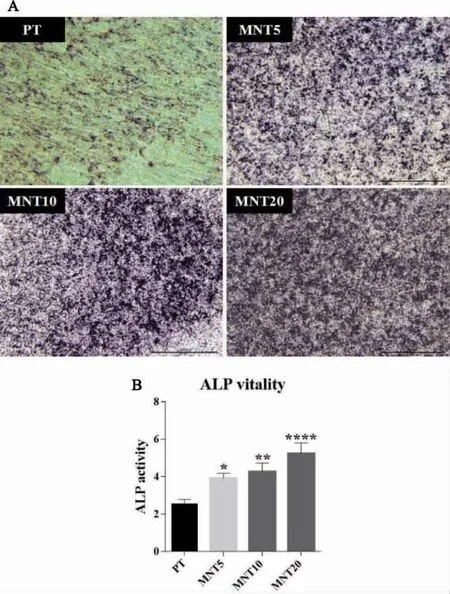
图5 钛试样表面rBMMSCs 细胞ALP 染色及半定量分析
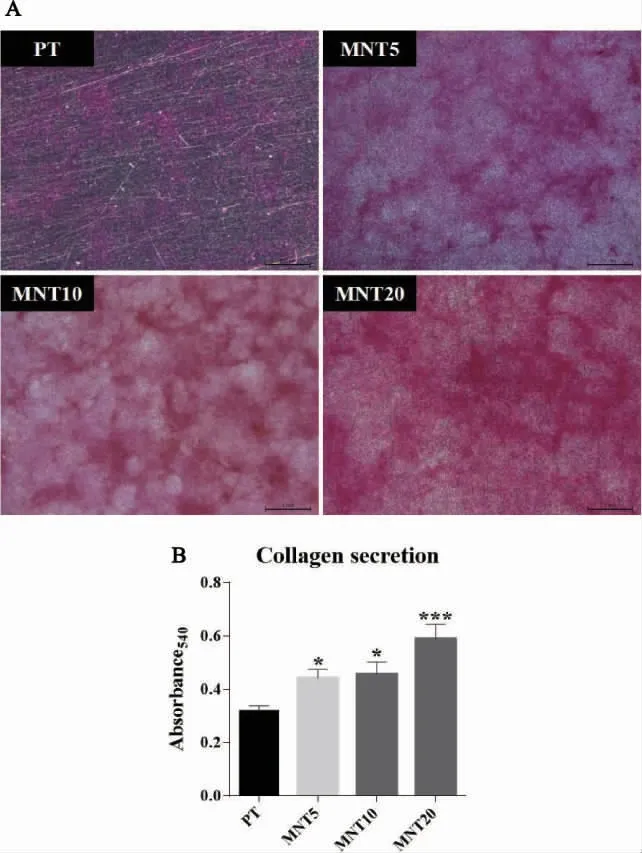
图6 钛试样表面rBMMSCs 成骨诱导14d 后胶原染色及半定量分析
2.7 不同管径的MNT 对rBMMSCs 细胞外基质矿化水平的影响 rBMMSCs 在钛试样表面成骨诱导21d 后,矿化结节染色及半定量结果如图7 所示。体式显微镜下可见各组钛试样表面均出现不同程度红染的矿化结节,其中PT 组着色最浅,形成的矿化结节最少;MNT5 组和MNT10 组比PT 组稍有加深,MNT20 组着色最明显。半定量分析显示:随着纳米管管径的增大ECM 矿化水平逐渐升高,MNT10、MNT20 组显著高于PT 组,MNT20组显著高于MNT5 组。
3.讨论
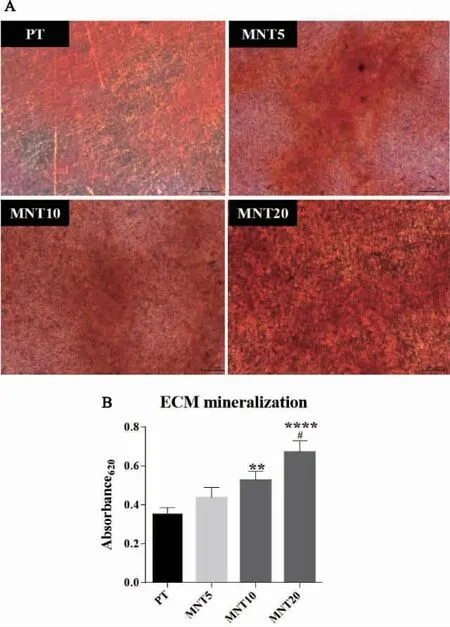
图7 钛试样表面rBMMSCs 成骨诱导21d 后矿化结节染色及半定量分析
钛凭借优良的生物相容性、抗腐蚀性和突出的机械性能广泛用于种植领域。但是钛属于惰性材料,直接植入体内往往存在骨结合强度低、愈合时间长等问题[5]。为了提高材料表面活性、增强骨结合,通常需要对钛种植体表面形貌进行优化处理[6]。大量研究表明,生物材料表面的物理形貌可优化材料的润湿性、粗糙度、表面能等特性,调控组织或细胞的生物学反应[7]。而且相对于生物学改性及化学改性而言,表面形貌设计具有更突出的稳定性、持久性和可控性[8]。
鉴于天然骨组织是由骨陷窝等微米结构和羟基磷灰石晶体、胶原纤维、骨小管等纳米结构有序组装而成,细胞所处的体内微环境也富含微、纳米成分,因此从仿生学角度出发,种植体表面微米及纳米化处理成为种植体表面形貌设计的方向[9,10]。大量研究发现,一定尺寸的微米形貌可以增加骨植入材料与骨组织之间的机械嵌合,提高骨接触比,进而促进骨生成,实现种植体的初期稳定性[11]。种植体纳米形貌除了可进行细胞水平的调控,还可进行蛋白水平的调节,直接影响细胞的生物学行为或通过改变细胞外基质的组成与结构间接调控细胞行为[12]。然而,单纯的纳米形貌尚不足以诱导出理想的骨结合,微米形貌对种植体初期稳定性的影响至关重要[13]。因此材料表面微米-纳米复合形貌设计一度成为生物医学领域研究的热点。本研究中我们采用酸蚀结合阳极氧化的方法制备了微米坑复合TiO2纳米管的微米-纳米复合形貌MNT,课题组前期的研究已证实MNT 兼具微米形貌的促细胞粘附、成骨相关基因表达与纳米形貌的促细胞增殖、细胞外总蛋白合成、ALP 分泌、细胞外基质沉积与矿化等功能[3,13-15]。而MNT 设计的关键是达到微米形貌的促细胞成骨分化与纳米形貌的促细胞增殖、胶原分泌、基质矿化间的平衡,使分化与增殖同时得到较大程度的增强[16]。其中改变TiO2纳米管管径大小是调节该平衡的较为简单、有效的方法之一,不同管径的纳米管可对细胞的粘附、增殖、分化等生物学行为会产生不同的影响[4]。为了揭示纳米管管径对细胞生物学行为的影响,该实验中我们通过调节阳极氧化电压制备出不同纳米管管径的MNT 钛试样,系统地检测了MNT 中的纳米管管径对rBMMSCs 生物学行为的影响。
扫描电镜结果显示,与PT 组相比,MNT 表面的细胞明显伸长,在伸长的两极可见大量丝状伪足,而且随着纳米管管径的增大,细胞形态伸长更明显,丝状伪足也更明显。其原因可能是由于随着纳米管管径的增大,纳米管表面所提供的细胞粘附位点发生变化,进而影响了细胞的形态。同时,在MNT 表面,rBMMSCs 成骨相关基因如Runx2、ALP 和BMP 的表达水平、ALP 合成、胶原分泌和细胞外基质矿化水平都有很大程度的提高,且随着纳米管管径的增大,这种升高更明显。基因OCN的表达水平在不同管径的MNT 表面没有明显的差异,这可能是由于OCN 是成骨细胞分化晚期表达的基因,而本实验只选取了7 天这个时间点对其进行检测,在7 天的时候OCN 可能还没有开始表达[17]。
鉴于细胞膜是细胞与材料表面最早发生直接接触的细胞结构,因此我们推测钛试样表面微纳米形貌可能通过膜应激反应(Membrane stress response,MSR)引起一系列细胞生物学行为的变化。不同的形貌会直接导致不同的质膜分布模式,形成不同的生物信号[18]。已有研究证实纳米结构具有诱导细胞膜分布和细胞骨架动力学改变的特性[19,20]。细胞与材料接触后,应力牵引也可直接诱发MSR[19]。另外,细胞膜由大量的脂类构成,当脂质失衡时,MSR 就会被激活,启动一系列细胞反应[20]。但是要明确物理形貌是否真的通过MSR 引起细胞内一系列生物学行为的变化还需进行更多、更深入的研究。因此,在后续的研究中,还将继续探索钛表面不同管径的MNT 调控rBMMSCs 生物学行为尤其是成骨分化的机制,以期深入理解MNT 中的纳米管管径对细胞生物学行为的影响,为骨植入材料表面优化设计提供有指导意义的生物学依据。

