酶制剂在饲料添加剂维生素A 含量测定中的应用
赵小阳,虞哲高,刘志英,汪忠艳,杨金枢,刘文欣,何剑洋
(1.中国农业科学院农业质量标准与检测技术研究所,北京 100081;2.帝斯曼营养产品部中国研发中心,上海 201203;3.中牧实业股份有限公司,北京 101102;4.广州爱保农饲料有限公司,广东广州 510080;5.浙江新和成股份有限公司,浙江杭州 312500;6.巴斯夫维生素有限公司,辽宁沈阳 110141;7.厦门金达威维生素有限公司,福建厦门 361028)
维生素A 可保护上皮组织,维持正常视觉功能,促进机体和骨骼的生长,防治角膜软化、干眼病等[1]。因此,维生素A 多以乙酸酯形式添加到饲料中,用于促进动物的健康生长发育。
维生素A 用作饲料添加剂通常有明胶包埋和淀粉包埋2 种剂型,国标分析方法(GB/T7292-1999)[2]主要针对微型胶囊技术、明胶包埋的产品,测定时需加入碱性蛋白酶,其作用是酶解包埋维生素A 的微囊外膜,使维生素A 释放出来溶于乙醇溶液。事实上,除碱性蛋白酶外,其他商品化蛋白酶制剂如菠萝蛋白酶、木瓜蛋白酶等也可用于明胶包埋产品中维生素A 含量的测定。对于淀粉包埋产品,尤其是为避免使用动物源性原料带来的安全隐患及出口地区限制,市场上出现的采用双重乳化工艺用淀粉包埋的饲料添加剂维生素A 产品,如何选择更好的方法检测其含量也是企业迫切需要了解的问题。
本文旨在探讨商品化淀粉酶制剂在饲料添加剂维生素A 产品检测中的应用问题。为此,选用菠萝蛋白酶检测了明胶包埋的维生素A 产品含量,结果与用碱性蛋白酶测试的结果吻合,帮助企业扩大了酶的选择空间;通过用淀粉酶检测淀粉包埋的维生素A 产品含量发现,检测结果稳定、准确。
1 材料与方法
1.1 试剂 无水乙醇,国产优级纯试剂;乙腈、异丙醇为色谱纯,购于Fisher Scientific 公司;菠萝蛋白酶:20 万U/g,淀粉酶:1 万U/g,为国产试剂;全反式维生素A 乙酸酯对照品,购于Dr.Ehrenstorfer 公司,含量≥96.0% ;全反式维生素A 乙酸酯标准贮备溶液,自配;全反式维生素A 乙酸酯标准工作溶液,自配。
1.2 仪器设备 分析天平(感量为0.000 1g、0.000 01g),德国Sartorius 公司(SQP QUINTIX224,BP211D);超声波振荡提取器,美国SmithKline 公司(BRANSON B-32);高效液相色谱仪,配有紫外吸收检测器(或二极管矩阵检测器),Agilent 1100;0.22 μm 微孔滤膜。
1.3 试验步骤
1.3.1 标准溶液制备 全反式维生素A 乙酸酯标准贮备溶液:精确称取80~90 mg(精确至0.000 01 g)全反式维生素A 乙酸酯对照品,置于50 mL 棕色容量瓶中,加入30~40 mL 无水乙醇,置于超声水浴中处理2 min 使之完全溶解,用无水乙醇稀释到刻度,摇匀。全反式维生素A 乙酸酯标准贮备溶液的浓度约为1 600~1 800 μg/mL(可密闭冷冻保存12 个月)。
全反式维生素A 乙酸酯标准工作溶液:准确吸取全反式维生素A 乙酸酯标准贮备溶液10 mL 于100 mL棕色容量瓶中,用无水乙醇稀释到刻度,摇匀,配成160~180 μg/mL 的全反式维生素A 乙酸酯标准工作溶液(可密闭冷冻保存2 个月)。
1.3.2 超声提取时间的确定 GB/T7292-1999 方法中,试样超声提取10 min,但对于不同生产企业的产品,由于包埋工艺不同,提取效果有差异,因此首先分别对试样超声提取10、30、40 min,以确定最适时间(表1)。由表1 可知,超声提取30 min,提取完全,结果稳定,40 min 时测定值呈下降趋势。
1.3.3 酶解提取 根据酶的最佳酶活条件,选择适合的提取温度及提取溶液,见表2。碱性蛋白酶组依据GB/T7292-1999 方法:称取200 mg 试样,加入200 mg 碱性蛋白酶、10 mL 0.1%氨水溶液,45℃超声波水浴中处理30 min,再用乙醇提取稀释,用外标法定量。菠萝蛋白酶和淀粉酶组方法为:称取100 mg(精确至0.000 1g)试样,置于100 mL 棕色容量瓶中,加入100 mg 菠萝蛋白酶、10 mL 水,于55℃超声水浴中超声提取30 min(或者加入100 mg 淀粉酶、10 mL 水,于70℃超声水浴中超声提取30 min),冷却至室温,加入无水乙醇振摇提取,然后用无水乙醇稀释至刻度,摇匀,用0.22 μm滤膜过滤,高效液相色谱检测。
1.3.4 直接提取 准确称取100 mg(精确至0.000 1g)试样,置于100 mL 棕色容量瓶中,加入10 mL 水,45℃超声水浴中超声提取30 min,加入无水乙醇振摇提取,然后用无水乙醇稀释至刻度,摇匀,用0.22 μm滤膜过滤,高效液相色谱检测。
1.4 色谱条件
1.4.1 色谱条件的选择 同GB/T7292-1999 方法[2]。色谱柱:LiChrospher 100RP-18,内径4.6 mm,长250 mm,粒度5 µm,或性能相当者。流动相:乙腈+异丙醇+水=1 500+250+250。流速:1.0 mL/min。检测波长:326 nm。进样量:5 µL。全反式维生素A 乙酸酯色谱峰见图1,维生素A 乙酸酯色谱图见图2。

图1 全反式维生素A 乙酸酯色谱图

图2 维生素A 乙酸酯色谱图
1.4.2 色谱柱的选择 在色谱分离中,不同品牌的C18色谱柱对于顺、反式维生素A 乙酸酯的分离情况是存在差异的,有些C18柱无法将顺、反式维生素A 乙酸酯分开,由于维生素A 乙酸酯的含量是以顺、反式维生素A 乙酸酯之和计算,因此是否将顺、反式维生素A乙酸酯分开对检验结果没有影响。本研究使用的一种色谱柱能够分离顺、反式维生素A 乙酸酯,根据表3 测试结果,顺式维生素A 乙酸酯占总维生素A 乙酸酯的量不超过9%。
1.5 主要技术内容分析论证
1.5.1 线性范围 准确称取103.2 mg维生素A乙酸酯对照品,用乙醇溶解定容至100.0 mL,制备成3 000 IU/mL 的维生素A 乙酸酯标准贮备液,稀释成浓度为150~2 400 IU/mL标准工作溶液,进样5 μL 至高效液相色谱仪。如图3 所示,当维生素A 乙酸酯的浓度在150~2 400 IU/mL 时,回归系数为0.999 42,浓度和峰面积之间存在很好的线性。

表1 不同提取时间的检验结果

表2 酶的提取条件
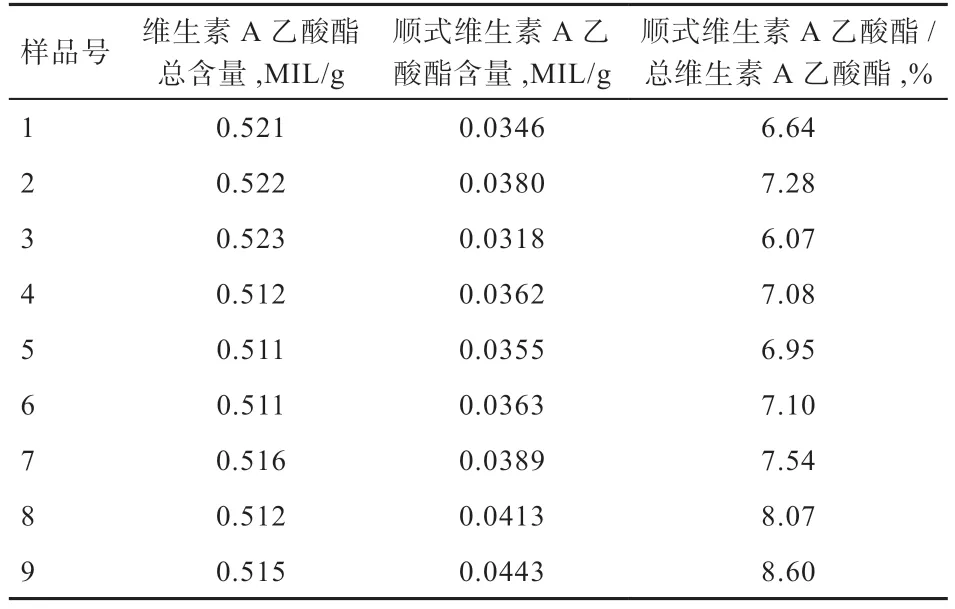
表3 顺、反维生素A 乙酸酯含量比值
1.5.2 顺式和反式维生素A 乙酸酯的定性试验 由于饲料级维生素A 乙酸酯都是化学合成的,在合成过程中,会生成少量维生素A 乙酸酯顺式异构体,同样具有维生素A 的效价,因此在计算时应将维生素A 乙酸酯的顺-反异构体峰面积合并计算。
称取约85~90 mg 全反式维生素A 乙酸酯对照品,溶于100 mL 乙醇中。吸取5.0 mL 标准贮备液于50 mL容量瓶中,用0.000 1 mol/L 的碘甲醇溶液稀释至刻度,摇匀,放置10 min 后,滴加数滴1%硫代硫酸钠溶液,使容量瓶中的黄色溶液褪色,将该溶液注入高效液相色谱仪,即得含全反式维生素A 乙酸酯和顺式维生素A乙酸酯的标准溶液,色谱图见图4。
2 结果

图3 维生素A 乙酸酯不同浓度标准溶液与峰面积响应值线性关系

图4 全反式维生素A 乙酸酯和顺式维生素A 乙酸酯色谱图
由表4 可知,用碱性蛋白酶和菠萝蛋白酶酶解处理7 批次不同生产厂商生产的明胶包埋饲料添加剂维生素A 的微囊产品,得到的结果与标示值非常吻合。实验数据为商品化蛋白酶制剂在饲料添加剂维生素A 含量测试中的酶的选择提供了空间。表4 还比较了用碱性蛋白酶、菠萝蛋白酶及淀粉酶酶解处理4 批次用淀粉包埋的饲料添加剂维生素A 的微囊产品。从结果上看,用这3种酶酶解处理试样获得的结果无明显差异。
由表5 可知,对于用明胶包埋的维生素A 乙酸酯微囊,测试结果均低于产品标示量,用淀粉包埋的测试结果与产品的标示量相吻合。
通过检测7 家生产企业生产的饲料级维生素A 乙酸酯含量,检测结果均不低于标示值,用不同酶酶解提取检测结果相对偏差不大于3%,表明检测准确度高。
3 讨 论
在生产过程中将适量的维生素A 油、抗氧化剂及明胶通过喷雾干燥,即制成明胶包埋的维生素A 的微囊产品。由于交联作用,部分维生素A 油油滴包裹在明胶基质内,而明胶不溶于水,这些包裹在明胶内的维生素A 油油滴不能释放出来,导致用直接提取法测定维生素A 的提取率低,测定结果均低于产品的标示量。而对于淀粉包埋的维生素A 的微囊产品,由于产品的基质为可溶于水的淀粉,用水超声处理后,淀粉扩散到水中,破坏了产品的微囊结构,微囊内的维生素A 易被有机溶剂所提取,测试结果与产品的标示量相吻合。
对于明胶包埋的维生素A 微囊产品,在样品前处理过程中,通常采用皂化的方法(如饲料中维生素A的测定)或酶解的方法(如饲料添加剂维生素A 的测定)破膜后,再用有机溶剂提取。但对于明胶包埋的维生素A 微囊产品分析来说,关注点在于将明胶交联的结构打破,用有机溶剂将基质内的维生素A 提取出来。本研究用菠萝蛋白酶酶解饲料添加剂维生素A 的微囊产品得到了满意结果。

表4 酶解提取检测结果
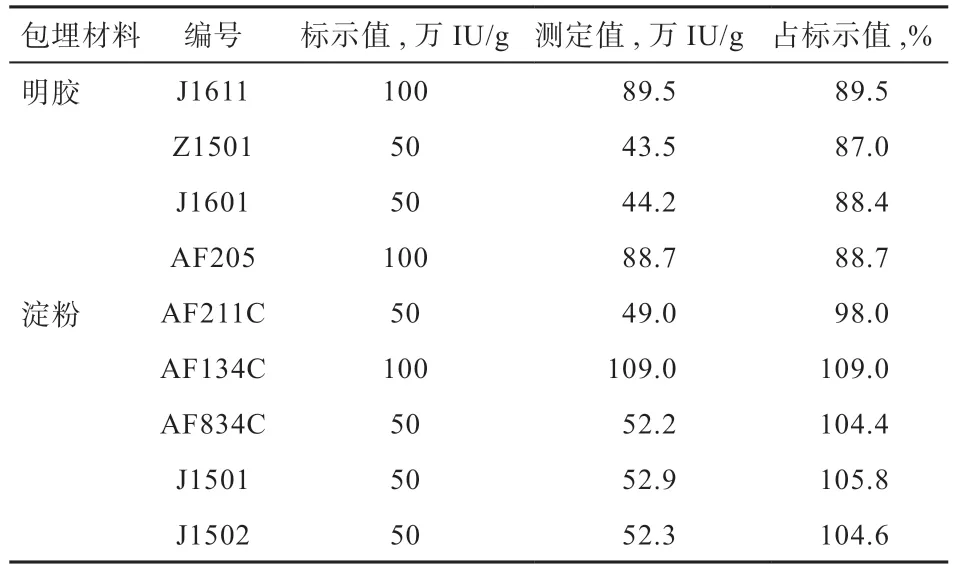
表5 直接提取测试结果
淀粉酶酶解处理与其他2 种处理方法有所差异。这是因为试样的基质是淀粉,用碱性蛋白酶或菠萝蛋白酶处理试样起作用的是水,在试样超声过程中,包埋微囊的淀粉溶于水而分散于水中,维生素A 易被下一步加入的乙醇所提取。用淀粉酶酶解处理,除包埋微囊的淀粉溶于水而分散于水中之外,淀粉酶还能够使大分子的淀粉结构酶解成小分子的单糖结构。在某些特定条件下,用商品化淀粉酶制剂测定淀粉包埋的饲料添加剂维生素A 的微囊产品还是有意义的。因为对于用淀粉包埋的维生素A 微囊,储存条件不当或放置时间过长,会使淀粉老化,试样用水处理时,会有部分淀粉不溶,导致部分维生素A 的油滴包裹在不溶淀粉基质内部,低估了实际的含量,而用淀粉酶酶解处理能解决淀粉老化导致含量偏低的问题。
此外,顺式维生素A 乙酸酯含量反映维生素A 乙酸酯生产工艺质量,使用企业在送检产品时可提出检测顺式维生素A 的含量。本研究中分离顺反式维生素A 乙酸酯时所用的色谱柱为LiChrospher®100RP-18 4.6×250 mm 5 μm,但该品牌的色谱柱并非是本方法唯一指定的色谱柱,凡能达到相同结果的其他品牌色谱柱也能使用。
4 小 结
本研究通过对碱性蛋白酶、菠萝蛋白酶及淀粉酶酶解提取方法的验证表明,对于明胶包埋的维生素A 乙酸酯,用碱性蛋白酶和菠萝蛋白酶酶解可以提取完全,测试结果稳定。对于淀粉包埋的维生素A 乙酸酯,根据淀粉易溶于水的性质,无论用哪种酶酶解,由于加水超声提取,都能提取完全;也可以选择不加酶,直接加水超声提取,可降低试验成本,提高试验效率;如果淀粉包埋的产品检测结果低于标示值,可先查看其保质期,之后最好用淀粉酶酶解处理再次检测。本研究介绍的分析方法适用性强,准确度高,分析成本低,可为饲料级维生素A 的检测提供有效的检测依据。

