荫蔽锻炼对大豆苗期光合特性的影响
高 阳 刘卫国 李淑贤 刘 婷 周 涛 杜勇利 张 熠 李碧琴 杨文钰
荫蔽锻炼对大豆苗期光合特性的影响
高 阳 刘卫国*李淑贤 刘 婷 周 涛 杜勇利 张 熠 李碧琴 杨文钰
四川农业大学生态农业研究所 / 农业部西南作物生理生态与耕作重点实验室 / 四川省作物带状复合种植工程技术研究中心, 四川成都 611130
荫蔽是影响间套作大豆产量进一步提高的限制因素。为探究荫蔽锻炼对大豆叶片光合、荧光特性的影响, 本研究采用盆栽试验, 分别用远红光LED灯(λ=730 nm)、30%透光率遮阳网模拟荫蔽信号和荫蔽胁迫, 分锻炼(S1)–恢复(S2)–胁迫(S3) 3个阶段, 以全过程自然光照为对照(LLLL), 设荫蔽信号锻炼(LFLS)、荫蔽胁迫锻炼(LSLS)、不锻炼(LLLS) 3个处理, 分析其S3阶段遭受荫蔽胁迫时叶片光合色素含量、光合参数以及叶绿素荧光参数的响应特征。结果表明, LFLS和LSLS较LLLS老叶和成熟叶叶绿素、叶绿素、类胡萝卜素含量以及叶绿素总含量显著增加, 老叶和新叶叶绿素/显著下降。除LSLS成熟叶外, 各叶位净光合速率、气孔导度均较未锻炼处理显著增加, 老叶和成熟叶锻炼与未锻炼处理胞间二氧化碳浓度差异不显著。与对照相比, 无论锻炼与否, 后期荫蔽使o、p、NPQ、PSII、ETR降低, 而v/m和v'/m'则升高, 其中, S1阶段的锻炼处理较未锻炼处理o下降的幅度更小; 老叶p较对照降低幅度依次为LFLS>LLLS>LSLS, 成熟叶为LSLS
荫蔽锻炼; 大豆; 光合; 叶绿素荧光
植物生长和发育进程中, 会受到高温、干旱、冷害、洪涝、弱光等各种各样的非生物逆境胁迫, 最终导致作物产量降低[1-2]。因此, 提高植物对非生物逆境胁迫的耐受能力是提高作物产量的关键所在。近年来, 有研究表明, 前期通过逆境锻炼(priming)可以使植物形成一个“逆境记忆”, 从而提高其后期对高温[3]、干旱[4-5]、渍水[6]、盐胁迫[7-8]等非生物逆境的耐受能力。
大豆[(Linn.) Merr.]是世界上种植面积最大的油粮饲兼用作物之一, 在我国的饮食结构中占有重要地位。近年来, 玉米(L.)大豆间套作种植模式在我国西南地区广泛推广, 因其在保证玉米产量的前提下, 有效地扩大了大豆种植面积, 增加了我国大豆供给, 提高了复种指数和耕地利用率, 降低了生产成本, 成为振兴我国大豆产业的新途径[9-11]。在该模式下, 玉米作为高秆作物且先于大豆播种, 使套作大豆苗期受到玉米遮光的荫蔽胁迫。目前, 关于荫蔽胁迫下植物光合生理变化特征的研究较多。Xu等[12]研究表明, 荫蔽程度较轻时, 冬小麦叶片中的叶绿素含量上升, 光合速率提高, 增强了自身对光能的利用, 籽粒产量能得到提高; 然而随着荫蔽程度加重, 植物冠层截获的太阳辐射能减少, 净光合速率下降, 植株的光合能力和叶绿素荧光参数光化学产量降低[13-15], 光合产物积累降低, 最终导致产量下降。因此, 提高大豆对荫蔽胁迫的耐受能力是提高其产量的关键因素之一, 但目前关于这方面的研究多局限于大豆耐阴性评价体系构建及选育耐阴性大豆品种[16-17], 工作量大、周期长、见效慢, 探索提高大豆荫蔽耐受能力的新途径迫在眉睫。
目前, 对非生物逆境锻炼的研究很多, 但大多集中于高温[3]、干旱[4-5]、渍水[6]、盐胁迫[7-8]等逆境, 而关于荫蔽锻炼的相关研究还鲜见报道。大豆经过荫蔽锻炼后再度遭受荫蔽胁迫是否能表现出更强的耐受能力, 本研究将借鉴前人关于逆境锻炼研究的相关理论, 拟通过荫蔽信号和荫蔽胁迫对大豆进行锻炼, 揭示荫蔽锻炼对大豆光合特性的影响,以期为深入研究间套作条件下大豆耐阴机制奠定理论基础。
1 材料与方法
1.1 试验设计
试验于2017年在四川农业大学成都校区第二教学楼日光大棚进行。供试大豆材料为南豆12 (西南地区套作大豆主推品种, 四川省南充市农业科学院选育), 由四川农业大学四川省作物带状复合种植工程技术研究中心提供。
采用单因素完全随机盆栽试验, 塑料花盆直径32 cm, 高27 cm, 营养土为越西腐殖土(购于成都市温江区万春花卉苗木交易中心, 一般花卉盆栽用土), 每盆2株。试验分锻炼(S1)–恢复(S2) –胁迫(S3) 3个阶段, 以全过程自然光照为对照(LLLL), 设不锻炼(LLLS)、荫蔽信号锻炼(LFLS)、荫蔽胁迫锻炼(LSLS) 3个处理, 每个处理20盆, 共80盆; 分别在大豆苗期3个阶段进行不同的荫蔽处理: L (light)为不遮阴, 即日光大棚内自然光(PPFD = 944.72 µmol m–2s–1); F (shade signal)为采用LED植物灯(λ=730 nm)补充远红光(far-red light), 即模拟荫蔽信号(PPFD = 912.13 µmol m–2s–1); S (shade)为覆盖透光率30%左右遮阳网, 即模拟荫蔽胁迫(PPFD = 288.30 µmol m–2s–1)。以上PPFD值均在第1阶段, 选择晴天上午9:00-11:00, 用Hipoint HR-350手持式光谱仪(台湾海博特股份有限公司)测得。具体如表1。
试验中, 对不同阶段长出的叶片进行标记, 并在第3阶段末取样测定时, 将第1、第2和第3阶段长出的三出复叶分别命名为老叶、成熟叶和新叶。
1.2 测定项目与方法
1.2.1 光合色素含量 参考Arnon[19]方法, 每个处理按标记叶位各选取3片复叶, 擦净表面污物, 避开叶脉剪碎, 混匀, 称取0.05 g大豆叶3份, 放入10 mL 80%丙酮混合液提取叶片色素, 分别在波长663 nm、645 nm和470 nm下测定吸光度, 然后计算叶绿素(chlorophyll)和类胡萝卜素(carotenoid)含量。

表1 试验设计
LLLL、LLLS、LFLS和LSLS分别表示全过程自然光、不锻炼、荫蔽信号锻炼和荫蔽胁迫锻炼; V: 大豆营养生长时期[18]; Light表示自然光; Shade signal表示模拟荫蔽信号, 即补充far-red light (F); Shade表示荫蔽胁迫。
LLLL, LLLS, LFLS, and LSLS are expressed as natural light during the whole process, no priming, shade-signal priming, and shade-stress priming, respectively; V: soybean vegetative stages[18]; Light: natural light; Shade signal: the simulated shade signal, supplementing far-red light (F); Shade: the shade stress.
1.2.2 光合特征参数 在晴天的上午9:00-11:30, 用便携式光合作用测定仪LI-6400XT (LI-COR, USA), 测定大豆复叶中间小叶净光合速率(n)、气孔导度(s)、胞间二氧化碳浓度(i)和蒸腾速率(r)等光合参数, 每重复测5株, 3次重复, 每片叶子记录3次, 取平均值。测定时选择红蓝光源, 设置光合有效辐射恒定为1000 µmol m–2s–1, 空气流速500 mol s–1。
1.2.3 叶绿素荧光参数 每个处理按标记叶位各选取3片复叶, 用大小适宜的铝箔纸轻轻包住暗适应20 min, 随后用CF Imager叶绿素荧光成像系统(chlorophyll fluorescence imager, CFI, 英国Technologica公司)测定大豆叶片初始荧光(o)、PSII最大光化学量子产量(v/m)、PSII有效光化学量子产量(v'/m')、非光化学淬灭系数(NPQ)、PSII实际光化学量子产量(PSII)、光化学淬灭系数(p)、表观电子传递速率(ETR)等叶绿素荧光参数。
1.3 数据分析
采用Microsoft Excel 2010软件整理数据和作图, SPSS 17.0软件统计分析。
2 结果与分析
2.1 荫蔽锻炼对大豆苗期光合色素的影响
由表2可知, 与LLLL处理相比, 后期荫蔽胁迫使大豆老叶和成熟叶中叶绿素含量不同程度降低(除LSLS处理成熟叶增加7.58%,>0.05), 而新叶中的含量均显著升高。
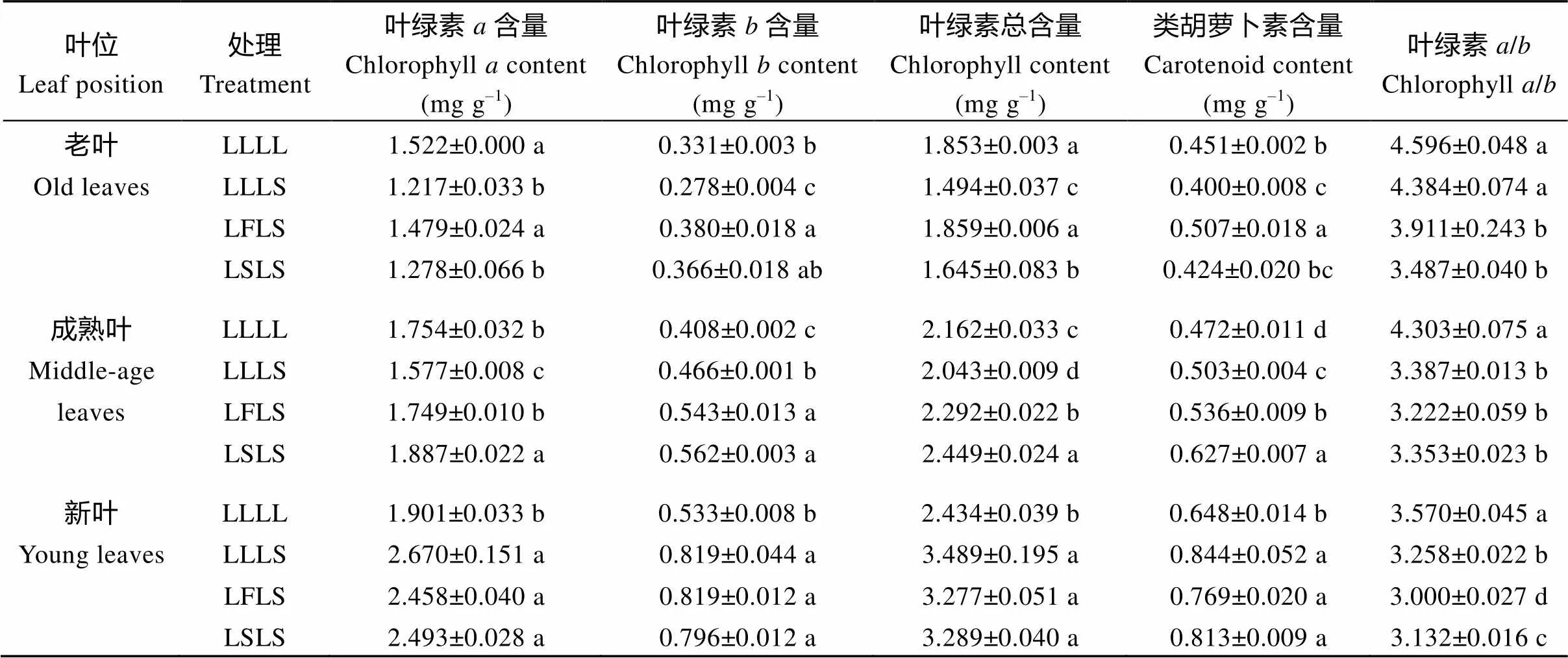
表2 不同荫蔽锻炼处理对大豆叶片光合色素的影响
同叶位同列标明不同小写字母的值在0.05水平上差异显著。缩写同表1。
Values within a column for a leaf position followed by different lowercase letters are significantly different at the 0.05 probability level. Abbreviations are the same as those described in Table 1.
LLLS处理老叶中叶绿素含量较LLLL处理降低16.01% (<0.05), 而经过锻炼的LFLS和LSLS处理则升高14.80%和10.57% (<0.05); 成熟叶中叶绿素含量均较对照显著增加, 但经过锻炼的较未锻炼的处理增幅更大; 新叶中LLLS、LFLS和LSLS处理叶绿素含量分别比LLLL处理增加53.66%、53.66%和49.34% (<0.05)(表2)。
各处理叶片中叶绿素总含量变化不一。新叶中LLLS、LFLS和LSLS处理叶绿素总含量分别比LLLL处理升高43.34%、34.63%和35.13% (<0.05); 而在老叶、成熟叶中则增减不一, 较LLLL处理而言, 未锻炼的LLLS处理分别下降19.37%和5.50% (<0.05), 荫蔽信号锻炼LFLS处理分别升高0.32% (>0.05)和6.01% (<0.05), 荫蔽胁迫锻炼LSLS处理分别降低11.23%和升高13.27% (<0.05)(表2)。
与LLLL处理相比, 除LLLS处理和LSLS处理老叶中类胡萝卜素含量降低外, 其余各处理各叶位类胡萝卜素含量均不同程度增加。同时, 叶绿素/值全部降低, 且经过锻炼的LFLS、LSLS处理较未锻炼的LLLS处理降低幅度更大(表2)。
2.2 荫蔽锻炼对大豆苗期叶片光合参数的影响
由表3可知, 各处理净光合速率差异显著, 特别是经过锻炼的大豆叶片后期遭受荫蔽胁迫时较未锻炼的处理能维持较高的净光合速率。其中, 经过锻炼的LFLS和LSLS处理老叶和新叶净光合速率显著高于未锻炼的LLLS处理, 而在成熟叶则表现为LFLS>LLLS>LSLS。
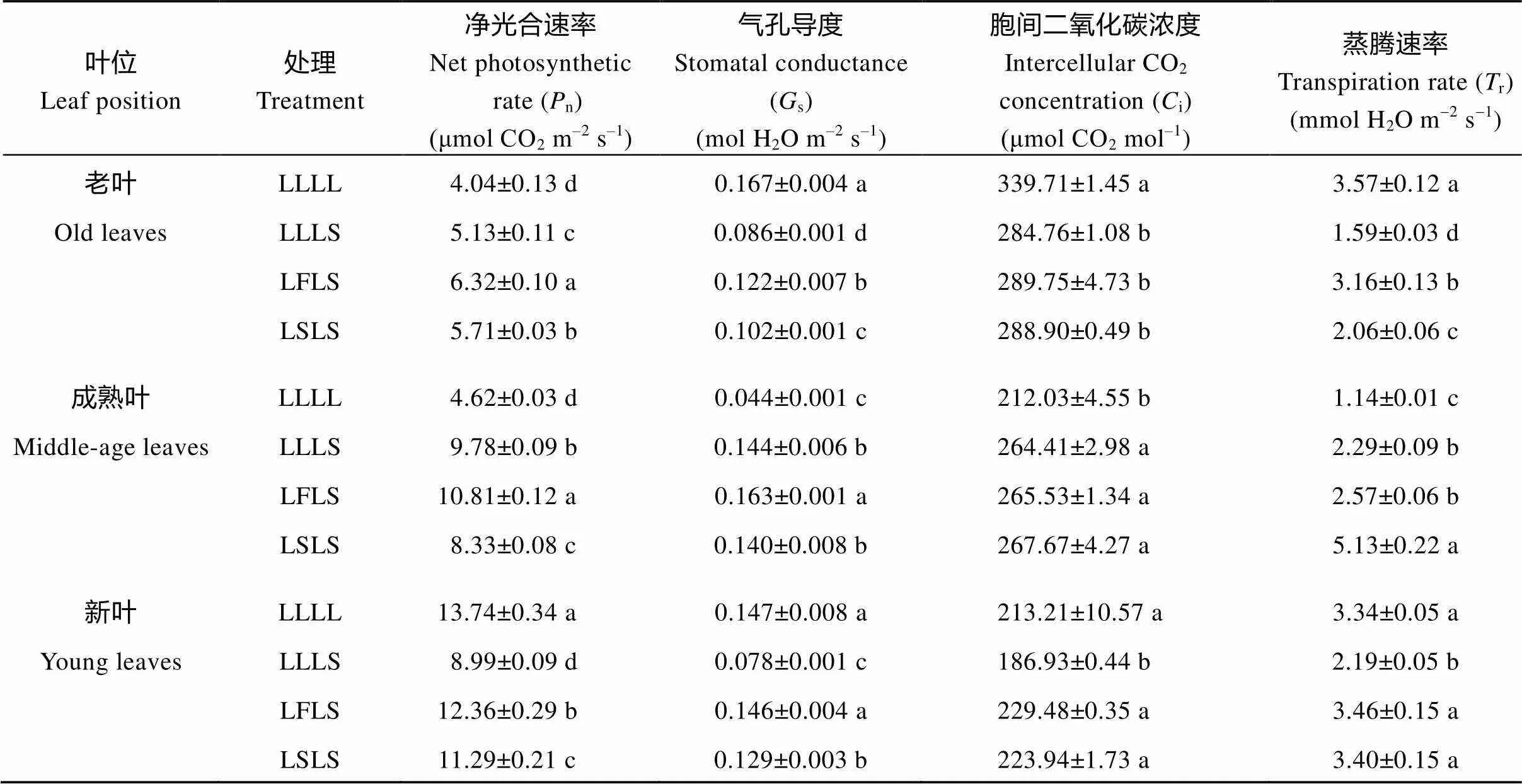
表3 不同荫蔽锻炼处理对大豆叶片光合参数的影响
同叶位同列标明不同小写字母的值在0.05水平上差异显著。缩写同表1。
Values within a column for a leaf position followed by different lowercase letters are significantly different at the 0.05 probability level. Abbreviations are the same as those described in Table 1.
各处理气孔导度变化有所差异。LLLS处理老叶和新叶显著低于LFLS和LSLS处理, 即一直生长在正常光照下的植株, 当受到荫蔽胁迫时, 大部分叶片(老叶和新叶)气孔导度会显著降低, 而经过锻炼的植株受到荫蔽胁迫时气孔导度显著增加; 成熟叶则表现出LFLS>LLLS>LSLS趋势, 与净光合速率变化趋势一致; 由此可见, 经过锻炼能显著提高大豆重度胁迫时老叶和新叶的气孔导度, 而就成熟叶而言, 仅荫蔽信号锻炼显著增加了叶片气孔导度(表3)。
就胞间二氧化碳浓度而言, 老叶中LLLL处理显著高于其余处理, 而成熟叶则与此相反。S3阶段遭受荫蔽胁迫, 老叶和成熟叶中锻炼处理与未锻炼处理差异不显著, 而在新叶中则表现为未锻炼LLLS处理显著低于对照和锻炼处理(表3)。
各处理间蒸腾速率存在差异。LLLS、LFLS、LSLS处理成熟叶显著高于LLLL处理, 但三者老叶显著低于LLLL处理, 即荫蔽胁迫使大豆成熟叶的蒸腾速率显著降低, 老叶的蒸腾速率显著升高且各处理间差异显著, 总体趋势表现为LLLL> LFLS>LSLS>LLLS, 而新叶中则表现为未锻炼处理显著低于对照和锻炼处理(表3)。
2.3 荫蔽锻炼对大豆苗期叶绿素荧光参数的影响
在自然环境中, 非重度胁迫条件下, 一般叶绿素荧光参数的值变化范围不大。由表4可知, 较LLLL处理而言, 第3阶段荫蔽胁迫使大豆叶片o、PSII、NPQ (LSLS处理老叶除外)、p、ETR等叶绿素荧光参数值降低, 而v/m和v'/m'则相对升高。

表4 不同荫蔽锻炼处理对大豆叶片叶绿素荧光参数的影响
同叶位同列标明不同小写字母的值在0.05水平上差异显著。缩写同表1。o: 初始荧光;v/m: PSII最大光化学量子产量;v'/m': PSII有效光化学量子产量;PSII: PSII实际光化学量子产量; NPQ: 非光化学淬灭系数;p: 光化学淬灭系数; ETR: 表观量子传递速率。
Values within a column for a leaf position followed by different lowercase letters are significantly different at the 0.05 probability level. Abbreviations are the same as those described in Table 1.o: minimal fluorescence;v/m: optimal/maximal photochemical efficiency of PSII in the dark;v'/m': photochemical efficiency of PSII in the light;PSII: actual photochemical efficiency of PSII in the light; NPQ: non-photochemical chlorophyll fluorescence quenching;p: photochemical quenching coefficient; ETR: photosynthetic electron transfer rate.
LLLS、LFLS、LSLS处理老叶中o分别比对照降低30.08%、14.62%和24.75% (<0.05), 成熟叶中o分别降低25.22%、17.41%、22.84% (<0.05), 新叶中o分别降低18.29%、11.34%、20.84% (<0.05), 除LSLS处理新叶o比LLLS处理较对照降低幅度大外, LLLS处理较对照降低幅度均大于LFLS、LSLS处理, 说明后两者对荫蔽胁迫更不敏感。p在不同叶位中差异不同, 老叶中LFLS处理较对照降低幅度大于LLLS处理, 而LSLS处理较对照降低幅度小于LLLS处理; 成熟叶中, LFLS、LSLS处理较对照降低幅度均小于LLLS处理, 而新叶中则与此相反, 前两者较对照降低幅度大于后者。PSII与ETR变化情况一致, 老叶和成熟叶各处理较对照降低幅度差异不明显, 新叶中LLLS、LFLS、LSLS处理较对照降低幅度分别为5.57%、10.13%和10.38% (<0.05), 后两者降低幅度更大。除LSLS处理老叶外, 第3阶段荫蔽胁迫的3个处理v/m较对照显著增加, 但值在0.75~0.82范围内, 变化差异不明显。除LSLS处理老叶外, LLLS、LFLS和LSLS三个处理v'/m'较对照也显著增加: 老叶中, 以上3个处理分别比对照增加15.01% (<0.05)、17.40% (<0.05)和4.14% (>0.05); 成熟叶中, 分别比对照增加13.40%、10.30%和5.06% (<0.05); 新叶中, 则分别比对照增加6.51%、8.79%和12.05% (<0.05), 体现出一定的锻炼效应(表4)。
3 讨论
3.1 植物对逆境的“记忆”机制
非生物逆境胁迫严重影响着植物的生长发育, 造成作物产量的逐年大幅下降。植物不能逃避不利的环境变化, 因而在长期的进化和适应过程中, 当植物再次面临逆境胁迫时, 会通过感受、传递及整合外界环境的多种信号, 采取不同的策略来响应周围环境资源的变化, 从而完成生命活动过程。这就类似于植物经历了“胁迫记忆—适应生长—恢复记忆、增强抗逆”的锻炼过程。基于此, 研究者们通过人为地施加逆境锻炼使植物形成“逆境记忆”, 确实提高了植物后期再次遭受逆境的耐受能力[3-8], 并对锻炼提高作物逆境耐受能力的可能机理进行了探讨[20-22], 大致通路总结如下: 1) 干旱、高温、渍水、低温、盐胁迫等逆境锻炼形成初级信号; 2) 植物在感知上游初级信号后分2条途径作出响应, 其一是形成次级信号分子(ABA、JA、Eth、ROS、NO、Ca2+等), 其二是表观遗传变化(DNA甲基化、组蛋白修饰等); 3) 在以上两条途径的调控下, 使相关调节蛋白或激酶(如MAPK)活化(磷酸化和去磷酸化等), 进而诱导相关基因的表达, 合成相应的逆境蛋白及植物激素, 最终调控植物作出反应、形成代内的短期逆境记忆或继代长期逆境记忆; 4) 已形成逆境记忆的植物再次遭遇逆境时, 抗性增强。其中, 锻炼提高作物逆境耐受能力的分子机制研究还相对匮乏, 特别是在染色质水平上还应当进一步深入研究。
基于研究者们对逆境的“记忆”机制的评述, 本研究对荫蔽记忆的可能机制作了如下推论。当遭受荫蔽胁迫(降低, 光强减弱)时, 植物首先感知外界光信号, 而这就依赖于其体内的光信号受体, 包括光敏色素(phytochromes, PHY)、隐花色素(cryptochromes, CRY)、向光素(phototropins, PHOT)和紫外光受体UVR8 (UV resistance locus 8)[23], 由于荫蔽环境下显著降低, 因此在感知荫蔽时, 光敏色素发挥最主要的作用[24-25], 我们可以将其看作是初级信号受体。另外, 光敏色素互作因子(phytochrome interacting factors, PIFs)是处于光敏色素下游的一类与光敏色素发生直接相互作用的转录因子, 并对光敏色素信号通路的转导进行调控[26], 参与初级信号转导。接下来, 由介导调控次级信号(激素水平), 包括调控生长素(auxin)[27]、赤霉素(gibberellin, GA)[28]、乙烯(ethylene, ETH)[29]和油菜素甾醇(brassinosteroid, BR)[30]参与到植物对荫蔽环境的响应, 同时由介导下游编码细胞壁修饰酶的(arabidopsis thaliana homeobox protein 4)调控细胞伸长[31-32], 最终使植物形态发生改变以适应不利的荫蔽环境并形成“记忆”。除此之外, 捕光色素复合体LHCII的组分是一类结构相似、进化相关、由核基因()编码的蛋白与色素所形成的色素蛋白复合体家族(LHCB)[33], 其含量和在类囊体膜中的分布情况与光强密切相关。它们除了在类囊体膜中进行光能的捕获和传递之外, 在维持类囊体膜的结构, 调节激发能在PSI和PSII之间的分配, 光保护以及对各种环境的适应等过程中都起着重要的作用。所以, 我们猜测, 植物感知荫蔽环境信号后, 也可能通过调控LHCII的功能来调控光合电子传递过程中光能的分配, 进而可以使植物在荫蔽环境下维持较高的净光合速率, 积累更多的光合产物并形成“记忆”。因此, 当具备荫蔽记忆的植物再次遭受荫蔽环境时, 能更好地适应不利环境。
3.2 荫蔽锻炼对大豆光合色素的影响
光合色素在光合作用中扮演着至关重要的角色, 大部分色素分子起捕获光能的作用, 并将光能以诱导共振方式传递到反应中心色素(少部分叶绿素), 因此这些色素被称为天线色素。叶绿体中全部叶绿素和大部分叶绿素都是天线色素。崔继林[34]、时向东等[35]研究表明, 弱光下叶绿素含量的增加有助于利用散射光中占优势的较短波长的蓝紫光, 有利于捕光色素复合体LHCP含量的提高。本试验中, 荫蔽胁迫下, LLLS、LFLS和LSLS处理叶绿素含量较LLLL处理显著增加, 叶绿素/值显著下降, 且经过锻炼的LFLS和LSLS处理较未锻炼LLLS处理叶绿素含量增加幅度更大; 除LLLS处理老叶和成熟叶叶绿素总含量较对照显著降低和LFLS处理老叶叶绿素总含量与对照差异不显著外, 其余各处理各叶位叶绿素总含量均较LLLL处理显著升高, 即经过锻炼, 大豆能在荫蔽胁迫下合成积累更多的叶绿素, 可见, 锻炼记忆可使植物通过大幅增加叶绿素含量, 尤其是叶绿素含量, 来提高捕光能力。另外, 类胡萝卜素作为光合系统中的辅助天线色素和非酶类的抗氧化合物, 它不仅可以捕获和转换光能, 将吸收的光能传递给叶绿素, 还能缓冲单线态氧对植物体的损害, 对捕光色素复合体LHCP的稳定具有重要的作用[36]。徐凯等[37]研究发现生长在低值下的草莓叶片中, 类胡萝卜素含量较高。杨芳等[36]发现类胡萝卜素含量与草坪草耐阴性呈正相关关系。本试验中, 再度遭受荫蔽胁迫时, 老叶中未锻炼处理类胡萝卜素含量较LLLL处理显著降低, 而在锻炼处理LFLS中则显著增加, 成熟叶中锻炼处理较未锻炼处理类胡萝卜素含量增加幅度更大, 类胡萝卜素含量的提高有利于叶绿素更好地接收光能, 保护叶绿素不受破坏, 维持较高的光合活性, 可见, 锻炼后大豆具有更强的防御保护能力和荫蔽耐受能力。
3.3 荫蔽锻炼对大豆光合特征的影响
在光合参数方面, 郭翠花等[38]研究表明遮阴会使叶片净光合速率、气孔导度和蒸腾速率显著降低, 胞间二氧化碳浓度增加。宋艳霞等[39]研究发现, 与单作相比, 套作遮阴条件下大豆叶片的净光合速率、气孔导度和气孔限制值均较单作极显著降低。本试验中, LLLL处理老叶和成熟叶净光合速率显著低于荫蔽胁迫下3个处理, 可能是由于正常光下植物相对生长速率较荫蔽下更快[40]、叶片衰老更快所致, 也与试验后期对照处理老叶变黄、脱落相一致。另外本试验中, 锻炼处理的叶片净光合速率、气孔导度显著高于未锻炼处理, 这可能是由于正常光下生长的植物突然遭遇荫蔽胁迫还不适应, 故而关闭气孔减少蒸腾, 从而使光合速率降低; 而经过锻炼的处理, 迅速启动应答机制, 合成、积累大量光合色素, 提高光能捕获能力, 同时气孔导度增加, 可以获得更多光合碳源, 进而在荫蔽胁迫条件下维持较高的光合效率, 更适应荫蔽环境。
在叶绿素荧光参数方面, 前人对遮阴处理后o、p、PSII、ETR的变化趋势研究结论比较一致[41-44],这与本试验结果基本一致, 即遮阴导致这些参数下降, PSII反应中心遭到破坏, 实际光合能力下降。而对v/m研究结论则不尽相同。吴亚男[41]研究认为玉米粒期短期遮阴能够提高v/m, 长期遮阴导致v/m下降。熊宇等[42]研究表明遮阴处理会导致黄瓜(L.)v/m下降。宋艳霞等[39]、焦念元等[45]和韦金河等[46]研究表明遮阴会导致大豆、花生(L.)和槭树(Thunb.)叶片v/m增加, 说明不同植物叶片、不同遮阴程度、不同遮阴时期和持续时间,v/m对遮阴的响应不同。本研究中, 遮阴后大豆叶片v/m均呈增加趋势, 可能与大豆叶片特性及经过荫蔽锻炼有关。总体来看, 荫蔽使大豆叶片o显著降低, 表明用于PSII天线色素热耗散增加, 植株显著增加PSII最大光化学量子产量v/m和PSII实际光化学量子产量v'/m' (遮阴程度不够)获得了更高的光能利用效率, 但真正用于光化学反应的能量却降低, 可能是PSII反应中心的表观电子传递速率降低造成的, 且经过锻炼的处理比未锻炼的处理表观电子传递速率较对照降低幅度更小, 表现出更好的适应性。
4 结论
荫蔽锻炼能让植物对荫蔽逆境作出反应, 形成一个适应性的应答机制(逆境记忆), 当再次遭受逆境时, 能通过光合色素的加速合成、积累来截获更多的光能, 并调控叶绿素荧光参数的变化来保护捕光色素复合体, 并减少光能的耗散, 从而提高光合效率, 更好地适应荫蔽逆境。玉米大豆带状复合种植系统中, 可以此为基础, 通过田间合理布局, 苗期给予大豆荫蔽锻炼, 从而提高其与玉米共生期内的光合效率, 增加光合产物积累, 提高产量。
[1] Deryng D, Conway D, Ramankutty N, Price J, Warren R. Global crop yield response to extreme heat stress under multiple climate change futures., 2014, 9: 2033–2053.
[2] Loreti E, Van V H, Perata P. Plant responses to flooding stress., 2016, 33: 64–71.
[3] Wang X, Cai J, Liu F L, Jin M, Yu H X, Jiang D, Wollenweber B, Dai T, Cao W. Pre-anthesis high temperature acclimation alleviates the negative effects of post-anthesis heat stress on stem stored carbohydrates remobilization and grain starch accumulation in wheat.2012, 55: 331–336.
[4] Liu S, Li X, Larsen D H, Zhu X, Song F, Liu F. Drought priming at vegetative growth stage enhances nitrogen-use efficiency under post-anthesis drought and heat stress in wheat., 2017, 203: 29–40.
[5] Wang X, Vignjevic M, Liu F L, Jacobsen S, Jiang D, Wollenweber B. Drought priming at vegetative growth stages improves tolerance to drought and heat stresses occurring during grain filling in spring wheat., 2015, 75: 677–687.
[6] Li C Y, Jiang D, Wollenweber B, Li Y, Dai T B, Cao W X. Waterlogging pretreatment during vegetative growth improves tolerance to waterlogging after anthesis in wheat., 2011, 180: 672–678.
[7] Cano E A, Bolarin M C, Perezalfocea F, Caro M. Effect of NaCl priming in increased salt tolerance in tomato., 1991, 66: 621–628.
[8] Ali Q, Daud M K, Haider M Z, Ali S, Rizwan M, Aslam N, Noman A, Iqbal N, Faisal S, Deeba F, Ali I, Zhu S. Seed priming by sodium nitroprusside improves salt tolerance in wheat (L.) by enhancing physiological and biochemical parameters., 2017, 119: 50–58.
[9] 杨文钰, 雍太文, 任万军, 樊高琼, 牟锦毅, 卢学兰. 发展套作大豆, 振兴大豆产业. 大豆科学, 2008, 27: 1–7.Yang W Y, Yong T W, Ren W J, Fan G Q, Mou J Y, Lu X L. Develop relay-planting soybean, revitalize soybean industry., 2008, 27: 1–7 (in Chinese with English abstract).
[10] 杨文钰. 套作大豆优势突出农民欢迎发展潜力巨大: 国家大豆产业体系专家考察四川套作大豆纪实. 大豆科技, 2009, (6): 14–15. Yang W Y. Intercropping soybean is welcomed by farmers for highlighted superiority and great potential for development: the national soybean industry experts inspect the Sichuan intercropping soybeans., 2009, (6): 14–15 (in Chinese).
[11] 杨文钰, 张含彬, 牟锦毅, 任万军, 雍太文, 李兴佐, 陈平, 陈文. 南方丘陵地区旱地新三熟麦/玉/豆高效栽培技术. 作物杂志, 2006, (5): 43–44. Yang W Y, Zhang H B, Mou J Y, Ren W J, Yong T W, Li X Z, Chen P, Chen W. High-efficient cultivation techniques of new third-cropping wheat/maize/soybean in dryland in South China hilly region., 2006, (5): 43–44 (in Chinese).
[12] Xu C L, Tao H B, Wang P, Wang Z L. Slight shading after anthesis increases photosynthetic productivity and grain yield of winter wheat (L.) due to the delaying of leaf senescence., 2016, 15: 63–75.
[13] 孙建磊, 王崇启, 肖守华, 高超, 李利斌, 曹齐卫, 王晓, 董玉梅, 焦自高. 弱光对黄瓜幼苗光合特性及Rubisco酶的影响. 核农学报, 2017, 31: 1200–1209. Sun J L, Wang C Q, Xiao S H, Gao C, Li L B, Cao Q W, Wang X, Dong Y M, Jiao Z G. Effect of low light on photosynthesis and Rubisco of cucumber seedlings., 2017, 31: 1200–1209 (in Chinese with English abstract).
[14] 李彩斌, 郭华春. 耐弱光基因型马铃薯在遮阴条件下的光合和荧光特性分析. 中国生态农业学报, 2017, 25: 1181–1189. Li C B, Guo H C. Analysis of photosynthetic and fluorescence characteristics of low-light tolerant genotype potato under shade condition., 2017, 25: 1181–1189 (in Chinese with English abstract).
[15] 陈德良, 陶月良, 吴友贵, 程瑶, 夏家天. 遮荫对百山祖冷杉光合特性和叶绿素荧光参数的影响. 核农学报, 2016, 30: 2056–2064.Chen D L, Tao Y L, Wu Y G, Cheng Y, Xia J T. Effect of shade on the photosynthetic characteristics and chlorophyll fluorescence parameters ofM. H. Wu., 2016, 30: 2056–2064 (in Chinese with English abstract).
[16] 武晓玲, 梁海媛, 杨峰, 刘卫国, 佘跃辉, 杨文钰. 大豆苗期耐荫性综合评价及其鉴定指标的筛选. 中国农业科学, 2015, 48: 2497–2507. Wu X L, Liang H Y, Yang F, Liu W G, She Y H, Yang W Y. Comprehensive evaluation and screening identification indexes of shade tolerance at seedling in soybean., 2015, 48: 2497–2507(in Chinese with English abstract).
[17] 孙祖东, 张志鹏, 蔡昭艳, 曾维英, 赖振光, 陈怀珠, 杨守臻, 唐向民, 苏燕竹, 盖钧镒. 大豆耐荫性评价体系的建立与中国南方大豆资源耐荫性变异. 中国农业科学, 2017, 50: 792–801. Sun Z D, Zhang Z P, Cai Z Y, Zeng W Y, Lai Z G, Chen H Z, Yang S Z, Tang X M, Su Y Z, Gai J Y. Establishment of an evaluation system of shade tolerance in soybean and its variation in Southern China germplasm population., 2017, 50: 792–801 (in Chinese with English abstract).
[18] Fehr W R, Caviness C E. Stages of Soybean Development. Special Report 80, Cooperative Extension Service, Agriculture and Home Economic Experiment Station. Ames, Iowa: Iowa State University, 1977. pp 1–11.
[19] Arnon D I. Copper enzymes in isolated chloroplasts. Poly- phenoloxidase in, 1949, 24: 1–15.
[20] Wang X, Liu F L, Jiang D. Priming: a promising strategy for crop production in response to future climate., 2017, 16: 2709–2716.
[21] Bruce T J A, Matthes M C, Napier J A, Pickett J A. Stressful “memories” of plants: evidence and possible mechanisms., 2007, 173: 603–608.
[22] Chinnusamy V, Zhu J K. Epigenetic regulation of stress responses in plants., 2009, 12: 133–139.
[23] Voityuk A A, Marcus R A, Michelbeyerle M E. On the mechanism of photoinduced dimer dissociation in the plant UVR8 photoreceptor., 2014, 111: 5219–5224.
[24] Lorrain S, Allen T, Duek P D, Lorrain S, Allen T, Duek P D, Whitelam G C, Fankhauser C. Phytochrome-mediated inhibition of shade avoidance involves degradation of growth-promoting bHLH transcription factors., 2008, 53: 312–323.
[25] Franklin K A. Shade avoidance.2008, 179: 930–944.
[26] Duek P D, Fankhauser C. bHLH class transcription factors take centre stage in phytochrome signaling., 2005, 10: 51–54.
[27] Procko C, Crenshaw C M, Ljung K, Noel J P, Chory J. Cotyledon-generated auxin is required for shade-induced hypocotyl growth in., 2014, 165: 1285–1301.
[28] Devlin P F, Yanovsky M J, Kay S A. A genomic analysis of the shade avoidance response in arabidopsis., 2003, 133: 1617–1629.
[29] Das D, St Onge K R, Voesenek L A, Pierik R, Sasidharan R. Ethylene- and shade-induced hypocotyl elongation share transcriptome patterns and functional regulators., 2016, 172: 718–733.
[30] Luo X M, Lin W H, Zhu S W, Zhu J Y, Sun Y, Fan X Y, Cheng M L, Hao Y Q, Ou E, Tian M M, Liu L J, Zhang M, Xie Q, Chong K, Wang Z Y. Integration of light and brassinosteroid signaling pathways by a GATA transcription factor in Arabidopsis., 2010, 19: 872–883.
[31] Gommers C M, Visser E J, St Onge K R, Voesenek L A, Pierik R. Shade tolerance: when growing tall is not an option., 2013, 18: 65–71.
[32] Zhang Y, Mayba O, Pfeiffer A, Shi H, Tepperman J M, Speed T P, Quail P H. A quartet of PIF bHLH factors provides a transcriptionally centered signaling hub that regulates seedling morphogenesis through differential expression-patterning of shared target genes in Arabidopsis., 2013, 9: e1003244.
[33] Bassi R, Dainese P. A supramolecular light-harvesting complex from chloroplast photosystem-II membranes., 1992, 204: 317–326.
[34] 崔继林. 光合作用与生产力. 南京: 江苏科学技术出版社, 2000. pp 198–207. Cui J L. Photosynthesis and Productivity. Nanjing: Jiangsu Scientific and Technical Publishers, 2000. pp 198–207 (in Chinese).
[35] 时向东, 文志强, 刘艳芳, 王卫武. 不同光强对作物生长影响的研究综述. 安徽农业科学, 2006, 34: 4216–4218. Shi X D, Wen Z Q, Liu Y F, Wang W W. Research on the effect of different light stresses on crop growth., 2006 , 34: 4216–4218 (in Chinese with English abstract).
[36] 杨芳, 许岳飞, 李丽群, 周禾. 类胡萝卜素与草坪草耐荫性的研究进展. 草业与畜牧, 2011, (1): 1–6. Yang F, Xu Y F, Li L Q, Zhou H. Carotenoids’s research progress in turfgrass shade.2011, (1): 1–6 (in Chinese with English abstract).
[37] 徐凯, 郭延平, 张上隆. 不同光质对草莓叶片光合作用和叶绿素荧光的影响. 中国农业科学, 2005, 38: 369–375. Xu K, Guo Y P, Zhang S L. Effect of light quality on photosynthesis and chlorophyll fluorescence in strawberry leaves., 2005, 38: 369–375 (in Chinese with English abstract).
[38] 郭翠花, 高志强, 苗果园. 花后遮阴对小麦旗叶光合特性及籽粒产量和品质的影响作物学报. 作物学报, 2010, 36: 673–679. Guo C H, Gao Z Q, Miao G Y. Effect of shading at post flowering on photosynthetic characteristics of flag leaf and response of grain yield and quality to shading in wheat., 2010, 36: 673–679 (in Chinese with English abstract).
[39] 宋艳霞, 杨文钰, 李卓玺, 于晓波, 郭凯, 向达兵. 不同大豆品种幼苗叶片光合及叶绿素荧光特性对套作遮荫的响应. 中国油料作物学报, 2009, 31: 474–479. Song Y X, Yang W Y, Li Z X, Yu X B, Guo K, Xiang D B. The effects of shading on photosynthetic and fluorescent characteristics of Soybean seedlings under maize-soybean relay cropping., 2009, 31: 474–479 (in Chinese with English abstract).
[40] Reich P B, Tjoelker M G, Walters M B, Vanderklein D W, Buschena C. Close association of RGR, leaf and root morphology, seed mass and shade tolerance in seedlings of nine boreal tree species grown in high and low light., 2010, 12: 327–338.
[41] 吴亚男. 不同玉米品种耐阴性评价及高产群体结构. 沈阳农业大学博士学位论文, 辽宁沈阳, 2014. Wu Y N. Shade-endurance among Different Maize Varieties and High-yielding Population Structure. PhD Dissertation of Shenyang Agricultural University, Shenyang, Liaoning, China, 2014 (in Chinese with English abstract).
[42] 熊宇, 杨再强, 薛晓萍, 李军. 遮光处理对温室黄瓜幼龄植株叶片光合参数的影响. 中国农业气象, 2016, 37: 222–230.Xiong Y, Yang Z Q, Xue X P, Li J. Effect of shading on photosynthetic parameters in greenhouse cucumber leaves., 2016, 37: 222–230 (in Chinese with English abstract).
[43] 周艳虹, 黄黎锋, 喻景权. 持续低温弱光对黄瓜叶片气体交换、叶绿素荧光猝灭和吸收光能分配的影响. 植物生理与分子生物学学报, 2004, 30: 153–160. Zhou Y H, Huang L F, Yu J Q. Effects of sustained chilling and low light on gas exchange, chlorophyll fluorescence quenching and absorbed light allocation in cucumber leaves.2004, 30: 153–160 (in Chinese with English abstract).
[44] 葛亚英, 田丹青, 俞信英, 郁永明, 潘刚敏, 刘晓静. 光合荧光参数等指标对室内悬挂植物12个品种的耐荫性评价. 浙江农业学报, 2013, 25: 483–487. Ge Y Y, Tian D Q, Yu X Y, Yu Y M, Pan G M, Liu X J. Evaluation on shade-tolerance of twelve indoor hanging plant species by using several indexes such as chlorophyll fluorescence parameters., 2013, 25: 483–487 (in Chinese with English abstract).
[45] 焦念元, 杨萌珂, 宁堂原, 尹飞, 徐国伟, 付国占, 李友军. 玉米花生间作和磷肥对间作花生光合特性及产量的影响. 植物生态学报, 2013, 37: 1010–1017. Jiao N Y, Yang M K, Ning Y T, Yin F, Xu G W, Fu G Z, Li Y J. Effects of maize-peanut intercropping and phosphate fertilizer on photosynthetic characteristics and yield of intercropped peanut plants., 2013, 37: 1010–1017 (in Chinese with English abstract).
[46] 韦金河, 闻婧, 张俊, 孟力力, 陈柳, 施宇恬. 夏季遮光对3种槭树PSII叶绿素荧光参数的影响. 江苏农业学报, 2015, 31: 172–179. Wei J H, Wen J, Zhang J, Meng L L, Chen L, Shi Y T. Effects of summer shading on PSII chlorophyll fluorescence parameters in three maple trees., 2015, 31: 172–179 (in Chinese with English abstract).
Effect of shade priming on photosynthetic characteristics of soybean seedlings
GAO Yang, LIU Wei-Guo*, LI Shu-Xian, LIU Ting, ZHOU Tao, DU Yong-Li, ZHANG Yi, LI Bi-Qin, and YANG Wen-Yu
Institute of Ecological Agriculture, Sichuan Agricultural University / Key Laboratory of Crop Ecophysiology and Farming System in Southwest China, Ministry of Agriculture / Sichuan Engineering Research Center for Crop Strip Intercropping System, Chengdu 611130, Sichuan, China
Shade stress limits the further increase of soybean yield in intercropping. In order to investigate the effect of shade priming on photosynthetic and chlorophyll fluorescence characteristics of soybean seedlings, the growth of plants were undergone three stages of shade priming (S1), light recovery (S2), and shade stress (S3). The shade priming included shade signal (increasing the ration of far red with LED lamp of 730 nm) and shade stress. The treatments of the experiment were natural light (LLLL), shade-signal priming (LFLS), shade-stress priming (LSLS), and no priming (LLLS). The results showed that compared with LLLS, shade priming enhanced chlorophyll, chlorophyll, carotenoid contents and total chlorophyll content in old and middle-age leaves significantly, while reduced chlorophyll/in old and young leaves. Except for the middle-age leaves of LSLS, both the net photosynthetic rate and stomatal conductance of each leaf position of LFLS and LSLS were significantly increased. And there was no significant difference in intercellular carbon dioxide concentration in old and middle-age leaves between the primed plants and the non-primed plants. Compared with the control (LLLL),o,p, NPQ,PSII, ETR decreased, whilev/mandv'/m' increased. Among them, the reduction ofoin the primed was smaller than that in the control. The trend of the reduction ofpwas LFLS > LLLS > LSLS in old leaves, while LSLS < LFLS < LLLS in middle-age leaves and LSLS > LFLS > LLLS in young leaves.PSII, ETR considerably decreased as compared with the control, but there was no significant difference between the primed plants and the non-primed plants. Compared with LLLL, the increase ofv'/m' in young leaves of the primed plants was greater than that of the non-primed plants, with the increase of 6.51%, 8.79%, and 12.05% (< 0.05) in LLLS, LFLS, and LSLS, respectively. Therefore, by shade priming at S1, soybeans adapted to the light environment through the plasticity of photosynthetic characteristics and exhibited a stronger tolerance to shade stress occurring during S3.
shade priming; soybean; photosynthetic characteristics; chlorophyll fluorescence
2018-04-27;
2018-08-20;
2018-09-20.
10.3724/SP.J.1006.2019.84061
通信作者(Corresponding author): 刘卫国, E-mail: lwgsy@126.com, Tel: 028-86290960
E-mail: 460242960@qq.com
本研究由国家自然科学基金项目(31671626)资助。
This study was supported by the National Natural Science Foundation of China (31671626).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20180918.1139.006.html

