木聚糖酶产生菌的筛选、发酵及酶学性质
何敏超,刘云云,陈小燕,许敬亮,闫志英,张金峰
(1.中国科学院 广州能源研究所 中国科学院可再生能源重点实验室 广东省新能源和可再生能源研究开发与应用重点实验室,广东广州 510640;2.中国科学院成都生物研究所 中国科学院环境与应用微生物重点实验室 环境微生物四川省重点实验室,四川 成都 610041;3.淮阴工学院江苏省生物质转化与过程集成工程实验室,江苏 淮安 223003)
木聚糖是被子植物细胞壁中半纤维素的主要成分,其含量仅次于纤维素,是一种丰富的可再生资源。作为一种杂多糖,其主链由D-木糖以β-1,4-糖苷键连接而成,其侧链由种类各异的糖基侧链组成[1]。木聚糖酶是指能够降解木聚糖的一组酶的总称。根据对木聚糖作用方式的不同,分为β-1,4-外切木聚糖酶、β-1,4-内切木聚糖酶、β-木糖苷酶和α-L-阿拉伯呋喃糖苷酶等。狭义上的木聚糖酶仅限于β-1,4-内切木聚糖酶。木聚糖酶的来源相当广泛,已报道产木聚糖酶的微生物主要有曲霉属、木霉属、青霉属、壳霉属、芽孢杆菌和链霉菌等[2-5]。
木聚糖酶在食品、制浆造纸、饲料、生物能源等领域中具有广阔的应用前景。在食品行业中,木聚糖酶可有效改善面团的持水性和稳定性,增大烘烤后面包的体积,改善面包心质地,降低面包的老化速率,延长货架寿命[6-7]。在制浆造纸领域中,它可用于纸浆漂白,提高纸浆白度并降低化学漂白剂的用量[8-10]。在饲料行业中,它可降低水溶性木聚糖导致的食糜黏性增高,同时木聚糖酶可作用于非淀粉多糖,破碎植物细胞壁,最终释放出营养物质[11-12]。在生物能源领域中,木聚糖酶可以提升木糖的得率,增大总还原糖的量[13-14]。
国内关于木聚糖酶的研究侧重于产木聚糖酶菌株的筛选及选育[15-16]、基因工程菌的构建[17-18]、培养条件的优化等方面[19-20]。尽管高活力木聚糖酶菌株的研究报道较多,仍有必要对不同酶学性质的高活力木聚糖酶菌株进行研究。本研究对实验室筛选出能发酵木聚糖酶的野生菌株进行分子鉴定及固态发酵单因素优化,并对木聚糖酶的酶学性质进行初步研究,为今后菌株大规模酶解预处理后农业废弃物原料提供前期实验基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
土壤样品:采自广西壮族自治区河池市环江县木论自然保护区富含腐殖质的土壤。
1.1.2 试剂
木聚糖(纯度≥90%):美国Sigma公司。D-木糖(纯度≥99%):上海源聚生物有限公司;3,5-二硝基水杨酸(纯度≥98%):上海国药集团化学试剂公司。引物由上海生工生物工程股份有限公司合成。其他试剂均为市售分析纯。
1.1.3 培养基
斜面培养基:土豆200 g/L,葡萄糖20 g/L,琼脂20 g/L。
初筛培养基:木聚糖10.0 g/L,KNO31.0 g/L,MgSO40.5 g/L,NaCl 0.5 g/L,K2HPO40.5 g/L,琼脂20 g/L,pH 6.0。
复筛培养基:玉米芯3.0 g/L,(NH)42SO41.4 g/L,KH2PO42.0 g/L,CaCl20.3 g/L,MgSO40.3 g/L,FeSO4·7H2O 5 mg/L,CoCl220 mg/L,MnSO41.6 mg/L,ZnSO41.4 mg/L,pH 5.6。
固态发酵培养基:玉米芯与麸皮3.6 g,固液比1∶2.5(g∶mL),液体为pH 5.6的Mandels营养液[21]。Mandels营养液为不加玉米芯的复筛培养基。
1.2 仪器与设备
BIOTECK-EON酶标仪:基因有限公司;HH-S8数显恒温水浴锅:江苏金怡仪器科技有限公司;LRH-250生化培养箱、HCQ-X300C恒温振荡器:上海一恒科技有限公司;JG16-WS台式高速离心机:湖南湘仪实验室仪器开发有限公司。
1.3 方法
1.3.1 产木聚糖酶菌株的筛选
(1)初筛:在50 mL无菌生理盐水中加入1.0 g土样,摇床振荡60 min,使得土样中的微生物充分混于液体中。取1 mL摇匀的液体置于15 mm×150 mm试管中,加入9 mL无菌生理盐水,摇匀后梯度稀释至10-6。分别吸取10-3、10-4、10-5和10-64个稀释度的菌悬液0.25 mL涂布于初筛培养基上,放入恒温培养箱30 ℃倒置培养,在48 h到96 h观察水解圈大小,选择水解圈与菌落圈直径比值较大的菌落进行纯化、保藏和后续研究。
(2)复筛:将初筛得到的菌株接种于种子培养基中,150 r/min、30 ℃培养72 h后以2.5%接种量接种至复筛培养基中,于相同条件下摇瓶培养4 d,5 d,6 d,吸取1 mL发酵液稀释到适当倍数测定木聚糖酶活力。筛选出木聚糖酶酶活力超过500 IU/mL的菌株。
1.3.2 菌种的分子生物学鉴定
采用改良十六烷基三甲基溴化铵(cetyl trimethyl ammonium bromide,CTAB)法提取菌株总脱氧核糖核酸(deoxyribonucleic acid,DNA),选择扩增真菌内转录间隔区(internal transcribed spacer,ITS)序列的通用引物ITS1:5'-TCC GTA GGT GAA CCT GCG CG-3'和ITS4:5'-TCC TCC GCT TAT TGA TAT GC-3'对曲霉SM24/a总DNA进行序列扩增。在20 μL的聚合酶链式反应(polymerase chain reaction,PCR)体系中含有10×缓冲体系(Buffer)2 μL(含MgCl2,2.5 mmol/L),脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(10 mmol/L)0.4 μL,上下游引物量为10 pmol,Taq酶(5 U/μL)0.2 μL,约50 ng的模板DNA,其余体积以无菌超纯水补足。
PCR扩增条件为:95 ℃预变性3 min;94 ℃变性1 min,52 ℃退火50 s,72 ℃延伸50 s,35个循环;72 ℃延伸10 min。PCR扩增产物采用DNA凝胶回收试剂盒进行割胶回收,并测序。将该序列与美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库中的已知序列进行基本局部比对搜索工具(basiclocalalignmentsearch tool,BLAST)比较分析,并从数据库获得相关种属的18S核糖体DNA(ribosome deoxyribonucleic acid,rDNA)序列,构建系统发育树。
1.3.3 培养基组分单因素优化实验
在初始固态发酵培养基(玉米芯与麸皮的总质量为3.6 g,固液比1∶2.5(g∶mL),液体为pH 5.6的Mandels营养液)的基础上,考察不同玉米芯与麸皮质量比(9∶1、7∶1、5∶1、3∶1、1∶1、1∶3、1∶5、1∶7、1∶9、全玉米芯和全麸皮)、不同氮源(硝酸铵、酵母粉、尿素、磷酸氢二铵、碳酸铵、硫酸铵、氯化铵和蛋白胨)、不同初始pH值(3.5、4.0、4.5、5.0、5.5、6.0和6.5)、不同料水比(1∶1.0、1∶1.5、1∶2.0、1∶2.5、1∶3.0、1∶3.5(g∶mL))、不同接种量(2.5%、5.0%、7.5%、10.0%)对菌株产木聚糖酶的影响。30 ℃发酵96 h。固态发酵pH用营养液的pH来调控,营养液的pH用10%硫酸或者10%氢氧化钠调节。
1.3.4 木聚糖酶酶学性质初步研究
酶的最适作用pH:在50 ℃条件下,分别于不同pH(3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5)条件下测定木聚糖酶活力,确定最适作用pH。
酶的最适作用温度:在pH 5.5条件下,分别于不同温度(37 ℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃)条件下测定木聚糖酶活力,确定最适作用温度。
1.3.5 木聚糖酶活力的测定
D-木糖标准曲线的绘制:配制1 g/LD-木糖标准溶液,取7支15 mL刻度试管,分别加入D-木糖标准溶液0、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL,分别加入蒸馏水补至2.0 mL,制成D-木糖含量为0、0.2 g/L、0.4 g/L、0.6 g/L、0.8 g/L、1.0 g/L和1.2 g/L的溶液。最后加入2.0 mL DNS摇匀,在沸水浴中煮沸10 min。冷却后用蒸馏水定容至15 mL并于波长540nm下测定吸光度值。以D-木糖含量(x)为横坐标,吸光度值(y)为纵坐标,绘制D-木糖标准曲线。标准曲线回归方程为y=0.7546x,相关系数R2=0.9948。
木聚糖酶活力的测定:于15 mL的具塞刻度试管里加入1 mL的1%木聚糖溶液(由0.2 mol/L,pH 4.8的醋酸缓冲液配制)、0.5 mL醋酸缓冲液和0.1 mL适当稀释酶液于50 ℃条件静置反应30 min,后加入2 mL的DNS溶液摇匀煮沸10 min后,定容至15 mL后于波长540 nm下测定吸光度值。空白中的酶液用灭活的酶液代替[22]。
酶活力单位定义:在上述测定条件下,1 mL粗酶液或1 g固体酶每分钟水解木聚糖底物产生1 μmol木糖所需的酶量(IU/g或者IU/mL)。
2 结果与分析
2.1 产木聚糖酶微生物的筛选与鉴定
2.1.1 产木聚糖酶微生物的筛选
以木聚糖为唯一碳源的筛选培养基,经观察水解圈与菌落圈比值的初筛和液体发酵复筛,从广西壮族自治区环江县木论自然保护区诸多土样中分离出一株水解圈直径与菌落圈直径比值较大(6.3)、酶活性较高的菌株(873.99IU/mL),将其编号为SM24/a。
2.1.2 菌株的分子生物学鉴定
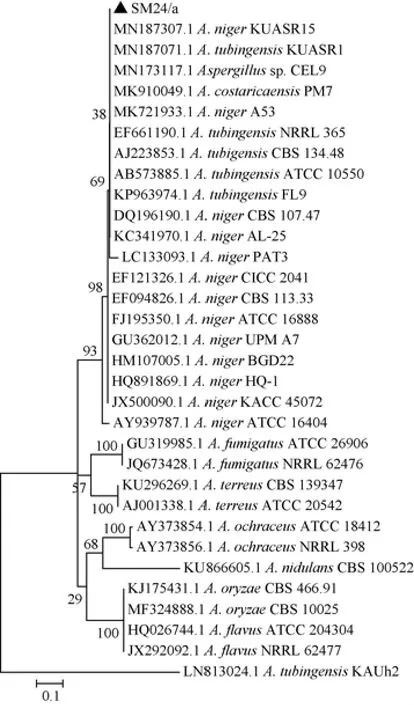
图1 菌株SM24/a基于ITS rDNA基因序列构建的系统发育树Fig.1 Phylogenetic tree of strain SM24/a based on ITS rDNA gene sequences
菌株SM24/a基于ITS rDNA基因序列构建的系统发育树见图1。由图1可知,菌株SM24/a与Aspergillus niger聚于一支,亲缘关系很近。结合菌落形态特征,鉴定菌株SM24/a为黑曲霉(Aspergillus niger)。
2.2 产酶条件优化
2.2.1 玉米芯、麸皮不同质量比对菌株SM24/a产酶的影响
考察玉米芯与麸皮不同比例对菌株SM24/a产酶的影响,结果见图2。由图2可知,以纯麸皮为碳源时,木聚糖酶酶活力达到最高(6 869.76 IU/g)。在玉米芯与麸皮比例为1∶7时,木聚糖酶的酶活为6 713.88 IU/g。玉米芯与麸皮比例为1∶1、1∶3、1∶5、1∶7和1∶9的木聚糖酶酶活远大于玉米芯与麸皮比例为9∶1、7∶1、5∶1和3∶1的木聚糖酶酶活,以纯玉米芯为碳源的木聚糖酶酶活最小(1 235.89 IU/g)。考虑到纯麸皮与1∶7混合比例的酶活相差不大且麸皮价格高于玉米芯,因此,选择玉米芯与麸皮质量比为1∶7。
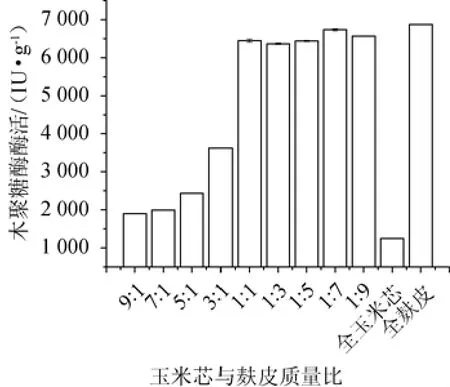
图2 玉米芯、麸皮不同比例对菌株SM24/a产酶的影响Fig.2 Effect of different corncob and wheat bran ratio on xylanase production by strain SM24/a
2.2.2 不同氮源对菌株SM24/a产酶的影响
分别用1.4 g/L的硝酸铵、酵母粉、尿素、磷酸氢二铵、碳酸铵、硫酸铵、氯化铵和蛋白胨为氮源制作培养基,考察不同氮源对菌株产酶的影响,结果见图3。
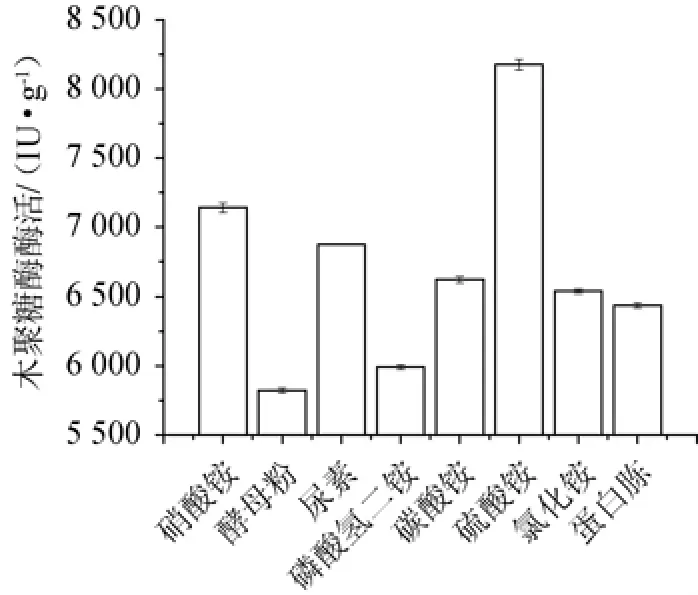
图3 不同氮源对菌株SM24/a产酶的影响Fig.3 Effect of different nitrogen sources on xylanase production by strain SM24/a
由图3可知,以硫酸铵作为氮源,其木聚糖酶酶活力最高为8150.18IU/g。酵母粉木聚糖酶酶活力最低(5834.28IU/g)。因此,选择添加量为1.4 g/L的硫酸铵为最佳氮源。
2.2.3 不同初始pH对菌株SM24/a产酶的影响
利用10%的硫酸或者10%的氢氧化钠调节Mandels营养液,控制固态发酵基质的pH,不同初始pH对菌株产酶的影响见图4。由图4可知,在初始pH值为5.0时,其木聚糖酶酶活为7 615.74 IU/g。在初始pH值为6时,其木聚糖酶酶活为7 660.28 IU/g。菌株SM24/a对于环境的要求比较苛刻,发酵条件稍微的变动,就可能会引起产酶活力的较大变化,在初始pH值为5.5时,该pH相较其他pH不适宜微生物生长和产酶,木聚糖酶酶活力最低,为5 845.42 IU/g。选择最佳初始pH值为5.0。
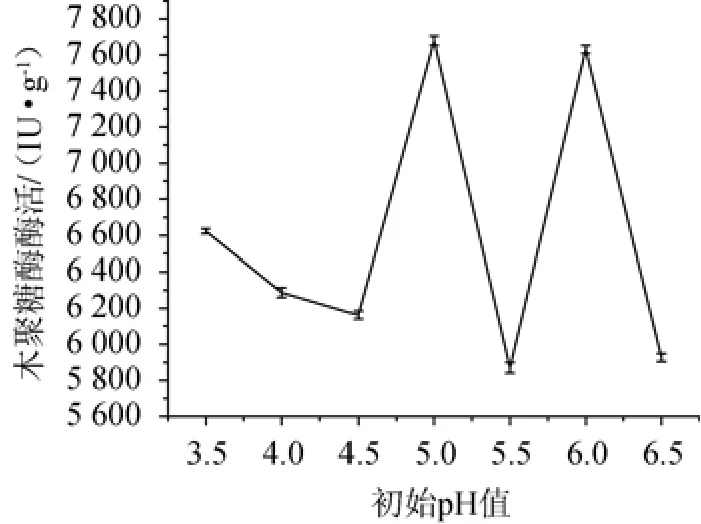
图4 不同初始pH值对菌株SM24/a产酶的影响Fig.4 Effect of different initial pH value on xylanase production by strain SM24/a
2.2.4 不同料水比对菌株SM24/a产酶的影响
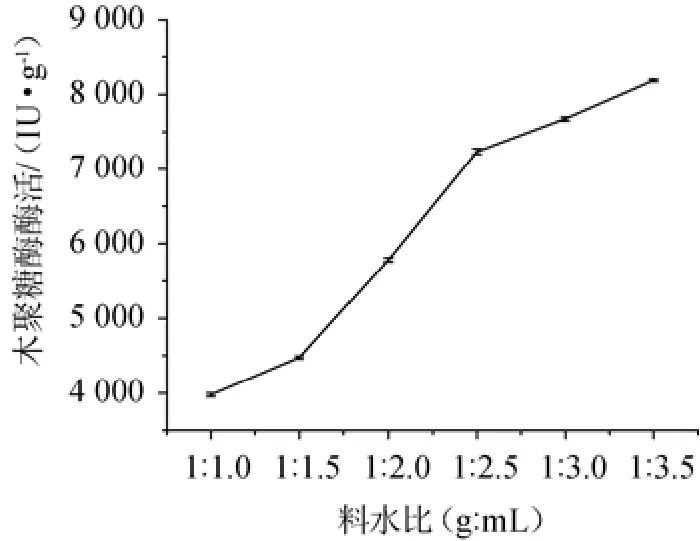
图5 不同料水比对菌株SM24/a产酶的影响Fig.5 Effect of different solid to liquid ratio on xylanase production by strain SM24/a
不同料水比对菌株产酶的影响见图5。由图5可知,在料水比为1∶1.5、1∶2.5、1∶3.5(g∶mL)时,木聚糖酶酶活力分别为4 459.80 IU/g,7 208.99 IU/g和8 174.26 IU/g。随着料水比中液体比例的增大,木聚糖酶酶活力增大,料水比的继续增大时,物料会出现塌陷情况,而且,随着水分比例的增大,物料的透气性将会降低,影响微生物氧气的吸收,不利于好氧微生物的生长和产酶。因此,选择最佳料水比为1∶3.5(g∶mL)。
2.2.5 不同接种量对菌株SM24/a产酶的影响
不同接种量对菌株产酶的影响见图6。由图6可知,在接种量为7.5%时,木聚糖酶的酶活力达到最高,为9176.18IU/g。在接种量为10%时,酶活力最低,为7722.17IU/g。接种量2.5%和接种量5%的木聚糖酶酶活力相差不大,为196 IU/g。因此,选择最佳接种量为7.5%。
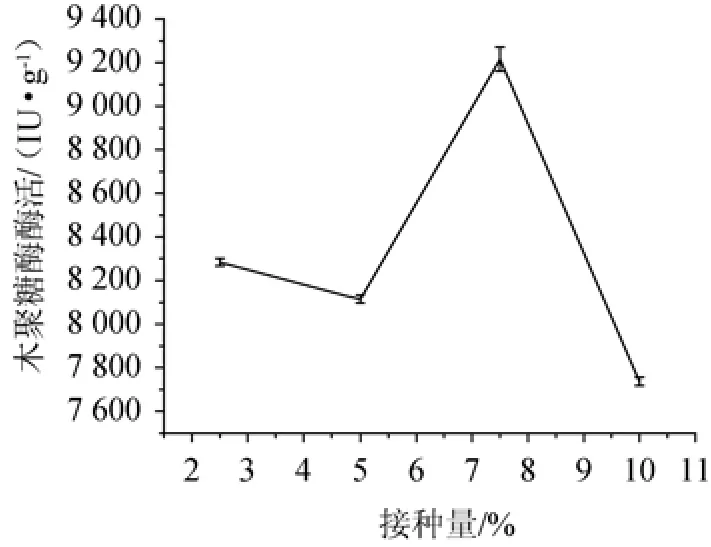
图6 不同接种量对菌株SM24/a产酶的影响Fig.6 Effect of different inoculum on xylanase production by strain SM24/a
2.2.6 验证试验
为了验证单因素优化实验结果,在单因素试验的最优条件下进行产酶菌株固态发酵实验。结果表明,在玉米芯与麸皮比例为1∶7、硫酸铵添加量为1.4 g/L、初始pH值为5.0、料水比为1∶3.5(g∶mL)、接种量为7.5%的条件下进行固态发酵,96 h后木聚糖酶酶活力为10 801.3 IU/g。
2.3 菌株SM24/a木聚糖酶的酶学特性
2.3.1 不同pH对菌株SM24/a木聚糖酶酶活的影响
在温度50 ℃条件下,分别于pH3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0和7.5条件下测定木聚糖酶酶活力,结果见图7。由图7可知,木聚糖酶酶活在pH 5.5时最大。该木聚糖酶为偏酸性木聚糖酶,耐受pH值的范围较宽,木聚糖酶的最佳pH值为5.5。
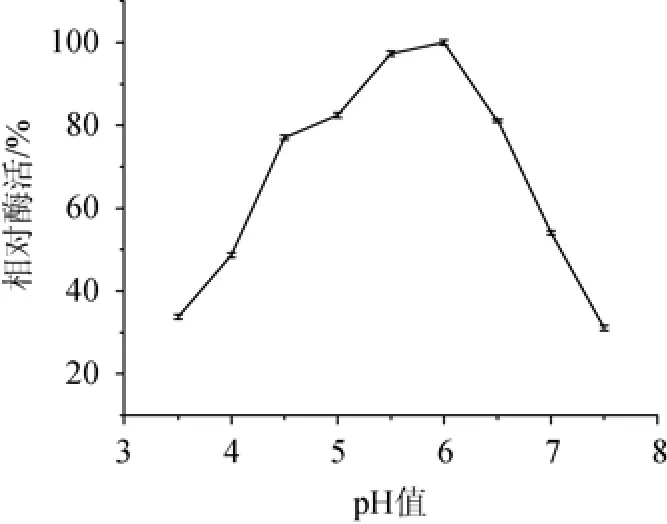
图7 不同pH值对菌株SM24/a木聚糖酶酶活的影响Fig.7 Effect of different pH value on xylanase production by strain SM24/a
2.3.2 不同温度对菌株SM24/a木聚糖酶酶活的影响
在pH5.5条件下,分别于25 ℃、30 ℃、37 ℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃条件下测定木聚糖酶酶活。以最高酶活力为100%计算各温度下的相对酶活力,结果见图8。由图8可知,木聚糖酶酶活在37 ℃时酶活力最高。
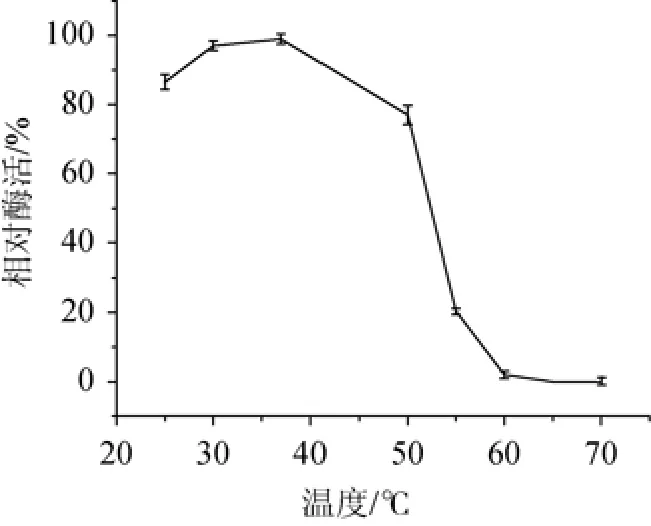
图8 不同温度对菌株SM24/a木聚糖酶酶活的影响Fig.8 Effect of different temperature on xylanase production by strain SM24/a
3 结论
从木论自然保护区土壤中筛选到1株高产木聚糖酶曲霉菌株,经鉴定该菌为黑曲霉(Aspergillus niger)。固态产酶条件优化结果表明其最佳玉米芯与麸皮质量比为1∶7,1.4 g/L硫酸铵为氮源,初始pH值为5.0,料水比为1∶3.5(g∶mL),接种量为7.5%,发酵96 h,木聚糖酶酶活力可达到10 801.3 IU/g。酶学性质表明,在pH为5.5,37 ℃条件下木聚糖酶的酶学性质最优。这表明该酶在饲料领域具有优良的应用潜力。后续将进一步研究该酶克隆表达、发酵优化等试验,以期实现该黑曲霉菌株的生产应用。

