高产α-半乳糖苷酶菌株的筛选鉴定及发酵培养基的优化
刘德海,权淑静,2,杨文玲,3,王佰涛,2,马 焕,2,王一雯,3,巩 涛,3,丁 芳,陈国参*
(1.河南省科学院 生物研究所有限责任公司,河南 郑州 450008;2.河南省工业酶工程技术研究中心,河南 郑州 450008;3.河南省微生物工程重点实验室,河南 郑州 450008)
α-半乳糖苷酶(EC3.2.1.22)又称蜜二糖酶,属于外切糖苷酶类,水解酶的一种,能够特异性的水解具有α-半乳糖苷结构的半乳糖类寡糖,能够专一性催化α-半乳寡糖、半乳甘露聚糖(galactomannan,GM)侧链、半乳糖脂和糖蛋白的非还原性末端α-1,6-半乳糖苷键的水解[1-3]。该酶在食品工业、轻化工领域有较高的应用价值,被认为是最有应用潜力的酶制剂之一:α-半乳糖苷酶是解决大豆制品棉子糖家族寡糖造成的食物不耐受的关键酶[4-6];在制糖工业中通过添加α-半乳糖苷酶消除棉籽糖增加蔗糖的产量,促进甜菜糖的结晶[7];另外,α-半乳糖苷酶还用于生产能够促进肠道益生菌增值的益生元α-低聚半乳糖(galactooligosaccharides,GOS)。
α-半乳糖苷酶广泛存在于动物、植物、微生物,其中微生物法生产α-半乳糖苷酶产量高、来源广泛、反应条件温和、性能优良,是目前α-半乳糖苷酶的主要来源[8]。据报道产α-半乳糖苷酶微生物包括细菌、真菌、放线菌、酵母等,其中真菌α-半乳糖苷酶具有合适的pH、良好的稳定性、细胞外分泌和表达量较高等特点[9]。黑曲霉(Aspergillus niger)是食药生产领域公认的安全菌株,应用高生物安全性的真菌黑曲霉生产α-半乳糖苷酶并研究其在相关领域的应用是当前的热点[10-11]。科研工作者采集不同蛋白含量丰富的样品分离筛选出α-半乳糖苷酶产生菌,李荷等[12-14]分别从发霉的豆粕、传统乳制品、豆制品作坊土样中分离出产α-半乳糖苷酶菌株。紫花苜蓿为豆科多年生草本植物,具有蛋白含量高、营养价值好的特点[15],但是国内目前尚未见从紫花苜蓿草种植土壤资源中筛选产α-半乳糖苷酶菌株的报道。
本研究采集河南郑州花园口紫花苜蓿草种植基地土壤样品,从中分离筛选得到一株产α-半乳糖苷酶真菌菌株,对其进行形态学观察和分子生物学鉴定,并采用单因素和正交试验对该菌株发酵产α-半乳糖苷酶发酵培养基进行了优化,旨在为筛选获得高产α-半乳糖苷酶提供新思路,并为工业化发酵生产更佳性能的α-半乳糖苷酶提供新选择。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
土壤样品:采集自河南郑州花园口紫花苜蓿草种植基地距离地表深1 cm左右土壤和紫花苜蓿草根部土壤,烘干过筛备用。
1.1.2 化学试剂
不含核糖核苷酸(ribonucleic acid,RNA)水:北京全式金生物技术有限公司;ESTaq酶Master Mix:天根生化科技(北京)有限公司;菌株18S rDNA基因的聚合酶链反应(polymerase chain reaction,PCR)扩增通用真菌引物:北京六合华大基因科技股份有限公司;对硝基酚(ρ-nitrophenol,ρNP)标准品(纯度99%)、5-溴-4-氯-3-吲哚-α-D-半乳糖苷(5-bromo-4-chloro-3-indolyl-alpha-D-galactoside,X-α-Gal)(纯度95%)、真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒(D2300):北京索莱宝科技有限公司;对硝基酚-α-D-吡喃半乳糖苷(ρ-nitrophenyl-alpha-Dgalactopyranoside,ρNPG)(纯度98%):上海阿拉丁生化科技股份有限公司;琼脂糖(纯度99%):法国Biowest公司;DL2000 DNA Marker:上海莱枫生物科技有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:土豆200.0 g/L,葡萄糖20.0 g/L,琼脂20.0 g/L,水1 000 mL。121 ℃灭菌20 min。
富集培养基:PDA培养基中加入链霉素(含链霉素30 U/mL)。121 ℃灭菌20 min。
菌种平板筛选培养基(Ⅰ):棉籽糖30.0 g,蛋白胨10.0 g,KCl0.5g/L,K2HPO41.0 g/L,MgSO4·7H2O 0.5 g/L,FeSO4·7H2O 0.5 g/L,琼脂20.0 g/L,水1 000 mL,pH 6.5。121℃灭菌20min。
菌种平板筛选培养基(Ⅱ):棉籽糖30.0 g/L,蛋白胨10.0 g/L,KCl 0.5 g/L,K2HPO41.0 g/L,MgSO4·7H2O 0.5 g/L,FeSO4·7H2O 0.5 g/L,琼脂20.0 g/L,水1 000 mL,X-α-Gal 0.06 g/L,pH 6.5。121 ℃灭菌20 min。
菌种复筛(基础)培养基:棉籽糖30.0g/L,蛋白胨10.0g/L,KCl0.5g/L,K2HPO41.0 g/L,MgSO·47H2O 0.5 g/L,FeSO·47H2O 0.5 g/L,水1 000 mL,pH 6.5。121 ℃灭菌20 min。
发酵产酶培养基:乳糖15.0 g,牛肉膏10.0 g/L,Na2HPO40.5 g/L,MgSO·47H2O 1.0 g/L,MnCl21.0 g/L,水苏糖0.8 g/L,水1 000 mL,pH 7.5。121 ℃灭菌20 min。
1.2 仪器与设备
Varioskan Flash全波长扫描式多功能读数仪、7146超纯水机:美国Thermo公司;QYC-2012C恒温摇床:上海福玛实验设备有限公司;C01006小型高速离心机:美国世界精密仪器商贸有限公司;504315磁力搅拌器:美国WPI公司;ME204E电子天平、FE20实验室pH计:瑞士Mettler Toledo公司;DNP-9052电热恒温培养箱:上海精宏实验设备有限公司;T-Gradient Thermoblock PCR扩增仪:德国Biometra公司;DYY-6C电泳仪:北京六一仪器厂;Axio Image M2全电动正置荧光显微镜:德国zeiss公司。
1.3 实验方法
1.3.1 菌种初筛[16]
无菌条件下称取1.0g土壤样品加入装液量为100mL/250mL富集培养基中,于30 ℃、180 r/min摇床振荡培养18 h。取富集后的培养液分别用无菌水稀释至10-5、10-6、10-7,分别取10-5、10-6、10-7三个稀释度溶液200 μL涂布于菌种平板筛选培养基(Ⅰ)表面,30 ℃恒温培养箱中培养36 h,用无菌牙签从平板生长的菌落中挑取各种形态不一样的单菌落点种于含有X-α-Gal菌种平板筛选培养基(Ⅱ)平板上,30 ℃恒温培养箱中培养36 h,接种环挑取蓝色单菌落进一步划线纯化(在菌株产生的α-半乳糖苷酶催化下无色的X-α-Gal水解后呈蓝色),将纯化后的单菌落转接于菌种保藏培养基斜面试管上,30 ℃培养72 h,观察菌落的生长情况,进行记录编号,置于甘油管中,放4 ℃冰箱中保存,备用。
1.3.2 菌种复筛
将初筛纯菌种接种(接种量0.3 g斜面种子)于装液量为100 mL/250 mL菌种液体复筛(基础)培养基中,30 ℃、180 r/min摇床振荡培养72 h,发酵培养酶液离心机于4 ℃、8 000 r/min离心15 min,收集上清液用于α-半乳糖苷酶酶活性分析,选取α-半乳糖苷酶酶活力高的菌株为出发菌株进行发酵培养基优化试验。
1.3.3α-半乳糖苷酶酶活力分析[17-18]
对硝基酚标准曲线绘制:以对硝基酚浓度(x)为横坐标,吸光度值OD405nm值(y)为纵坐标,绘制标准曲线。按照标准曲线回归方程计算α-半乳糖苷酶酶活力,其计算公式如下:
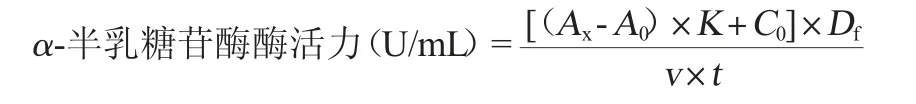
式中:Ax为样品酶液OD405nm值;A0为空白OD405nm值;K为对硝基酚标准曲线的斜率;C0为对硝基酚标准曲线的截距;Df为稀释倍数;v为吸取样品酶液体积,mL;t为反应时间,min。
α-半乳糖苷酶活力单位定义:在37 ℃,pH 5.0条件下,1 min分解底物ρNPG生成1 μmol对硝基苯酚所需的酶量为1个酶活力单位(U)。
1.3.4 菌株A1-19菌落形态观察和分子生物学鉴定
形态学观察:参照魏景超《真菌鉴定手册》[19]。
分子生物学鉴定:用真菌基因组DNA提取试剂盒(D2300),按试剂盒说明书操作流程提取菌株A1-19的基因组DNA。以其为模板,采用真菌通用引物(ITS1:5'-TCCG-TAGGTGAACCTGCGG-3';ITS4:5'-TCCTCCGCTTATTG-ATATGC-3'),进行菌株A1-19 18S rDNA基因的PCR扩增。PCR扩增体系:不含核糖核苷酸水9.5 μL,ESTaqMasterMix 12.5 μL,模板DNA 1 μL,ITS1上游引物1 μL,ITS4下游引物1 μL;PCR扩增条件:95 ℃预变性4 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,30个循环,最后72 ℃延伸10 min。
PCR扩增产物经1%琼脂糖凝胶电泳分析检测验证后,送华大基因完成测序。将菌株测序序列在美国国立生物技术信息中心(national center for biotechnology information,NCBI)上提交Genbank数据库采用基本检索工具(basic local alignment search tool,BLAST)进行同源性序列比对相似性分析,并用分子进化遗传分析(molecular evolutionary genetics analysis,MEGA)6.0软件构建18S rDNA基因的系统发育树,采用邻接(neighbor-joining,NJ)法进行菌株18S rDNA基因分析。
1.3.5 菌种A1-19产α-半乳糖苷酶培养基优化的单因素试验
以发酵酶液产α-半乳糖苷酶酶活力为评价指标,以菌种复筛(基础)培养基为基础,选择添加量为30.0 g/L不同碳源(β-环糊精、葡萄糖、蔗糖、棉籽糖、乳糖、果糖、可溶性淀粉)、添加量为10.0 g/L不同氮源(蛋白胨、酵母膏、牛肉膏、硝酸钠、硫酸铵、柠檬酸三铵、豆粕粉)、1.0 g/L不同无机盐(氯化钾、磷酸氢二钾、硫酸亚铁、硫酸镁、硫酸铜、磷酸氢二钠、氯化锰)和添加量0.5 g/L不同诱导物(蔗糖、棉籽糖、蜜二糖、水苏糖)为单因素,研究其对发酵液中α-半乳糖苷酶酶活力大小的影响,装液量为100mL/250mL,在30℃、180r/min摇床振荡培养72 h,单因素培养基优化各作3组平行试验。
1.3.6 菌种A1-19产α-半乳糖苷酶培养基优化的正交试验
根据菌种A1-19单因素培养基优化试验结果,设计发酵产α-半乳糖苷酶培养基优化正交优化试验。选择乳糖(A)、牛肉膏(B)、硫酸镁(C)、磷酸氢二钠(D)、氯化锰(E)、水苏糖(F)添加量为6种影响因素,每个因素设计3个水平,装液量为100mL/250 mL,30℃、180 r/min摇床振荡培养72 h,以α-半乳糖苷酶酶活为评价指标,分析优化出菌种A1-19较佳的培养基配方。
2 结果与分析
2.1 菌株的分离筛选
通过富集培养、菌种平板筛选培养基(Ⅰ)、含有X-α-Gal菌种平板筛选培养基(Ⅱ),初筛得到13株产α-半乳糖苷酶的菌株,分别编号为A1-6、A1-11、A1-19、A1-22、A 2-2、A 2-3、A2-10、B1-3、B1-4、B1-6、B2-7、B2-9、B2-10。将该13株菌株分别接种于菌种复筛(基础)培养基,30 ℃、180 r/min摇床振荡培养72 h,测定发酵液酶活,结果见表1。由表1可知,菌株A1-19发酵液的α-半乳糖苷酶酶活力最高,为1.16 U/mL。将其选定为实验菌株并进行后续实验。
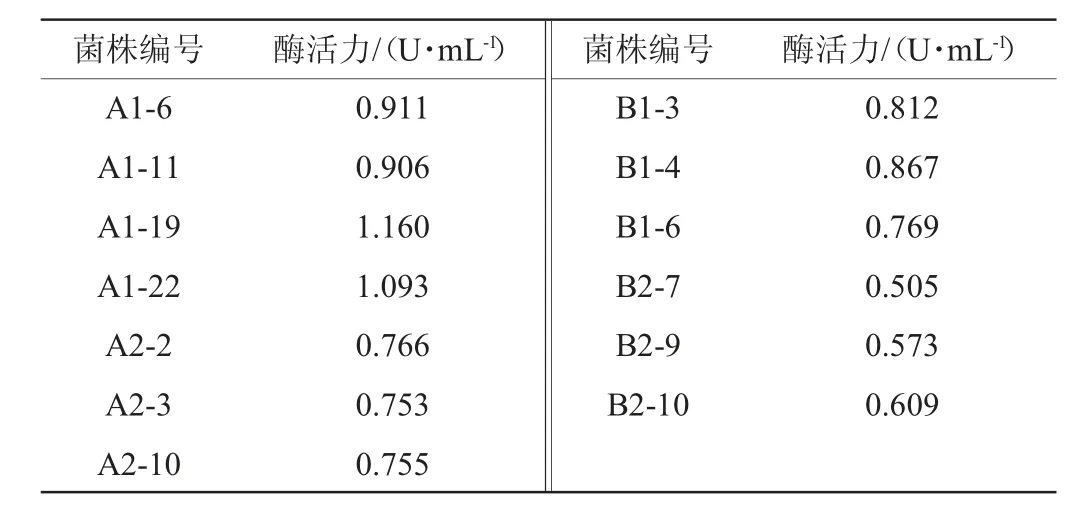
表1 筛选菌株α-半乳糖苷酶酶活测定结果Table 1 Determination results of α-galactosidase activity of selected strains
2.2 菌株A1-19的鉴定
2.2.1 菌株A1-19的形态特征
将菌株A1-19接种到PDA培养基平板上,30 ℃恒温培养24 h、48 h、72 h,其菌落形态变化结果见图1。由图1可知,菌株A1-19菌落菌丝由24 h的白色绒毛状,逐渐上外漫延发展为48 h的浅黄色且带有少量褐黑色孢子,直至培养72 h时大量褐黑色孢子布满整个平板。菌株A1-19孢子显微特征见图2,由图2可知,孢子梗,球形顶囊及球形孢子。

图1 菌株A1-19在PDA培养基上的菌落形态特征Fig.1 Colonial morphology characteristics of strain A1-19 on PDA medium
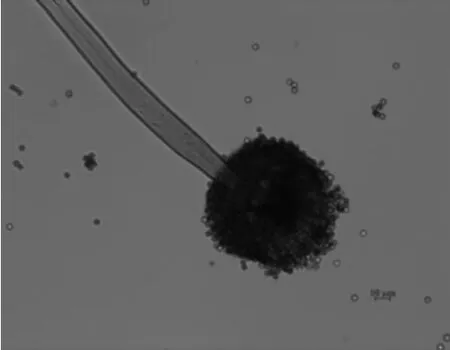
图2 菌株A1-19孢子显微特征Fig.2 Microscopic characteristics of spores of strain A1-19
2.2.2 菌株A1-19的分子生物学鉴定
菌株A1-19的18S rDNA PCR扩增结果见图3。由图3可知,PCR扩增产物序列片段长度为593 bp,与预期结果相符。将PCR扩增产物测序结果提交NCBI的Genbank数据库,进行BLAST同源性序列比对相似性分析,并在18S rDNA基因序列同源性基础上构建系统发育树,菌株A1-19的系统发育树见图4。由图4可知,菌株A1-19与Aspergillus nigerATCC 16888T(NR 111348.1)在同一分支,且相似性为99.65%。结合菌株A1-19的菌落形态特征、18S rDNA的基因序列测序及系统发育树分析,菌株A1-19被鉴定为黑曲霉(Aspergillus niger)。
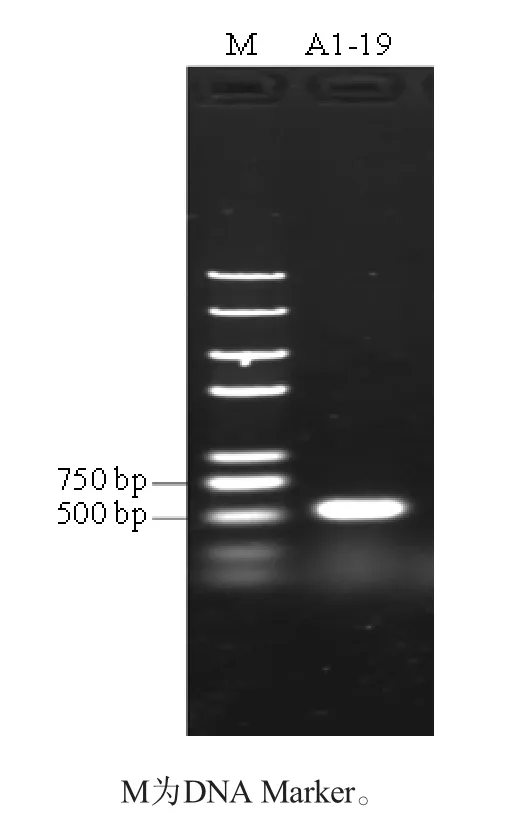
图3 18S rDNA PCR扩增产物琼脂糖凝胶电泳结果Fig.3 Agarose gel electrophoresis result of 18S rDNA PCR product

图4 基于18S rDNA序列菌株A1-19的系统发育树Fig.4 Phylogenetic tree of strain A1-19 based on 18S rDNA sequence
2.3 黑曲霉A1-19产α-半乳糖苷酶酶培养基优化的单因素试验
2.3.1 碳源对菌株A1-19产α-半乳糖苷酶的影响
不同碳源及最适碳源添加量对黑曲霉A1-19产α-半乳糖苷酶酶活力的影响,结果见图5。由图5A可知,在7种碳源中以乳糖为唯一碳源时,黑曲霉A1-19产α-半乳糖苷酶的酶活力最高,为1.86 U/mL;而以棉籽糖为唯一碳源时最低,为0.91 U/mL;其他碳源(β-环糊精、葡萄糖、蔗糖、果糖、可溶性淀粉)发酵液α-半乳糖苷酶的酶活力差别不大,葡萄糖、蔗糖易被黑曲霉吸收利用更好的促进了菌丝生长而产酶不足,β-环糊精、可溶性淀粉不易被黑曲霉吸收利用菌丝生长不良而酶活力不高。故选择乳糖作为碳源进行试验。由图5B可知,乳糖添加量为5~15 g/L时,α-半乳糖苷酶的酶活力随之增加;乳糖添加量为15 g/L时,α-半乳糖苷酶的酶活力最大;乳糖添加量>15 g/L之后,α-半乳糖苷酶的酶活力随之下降。因此,乳糖最佳添加量为15 g/L。
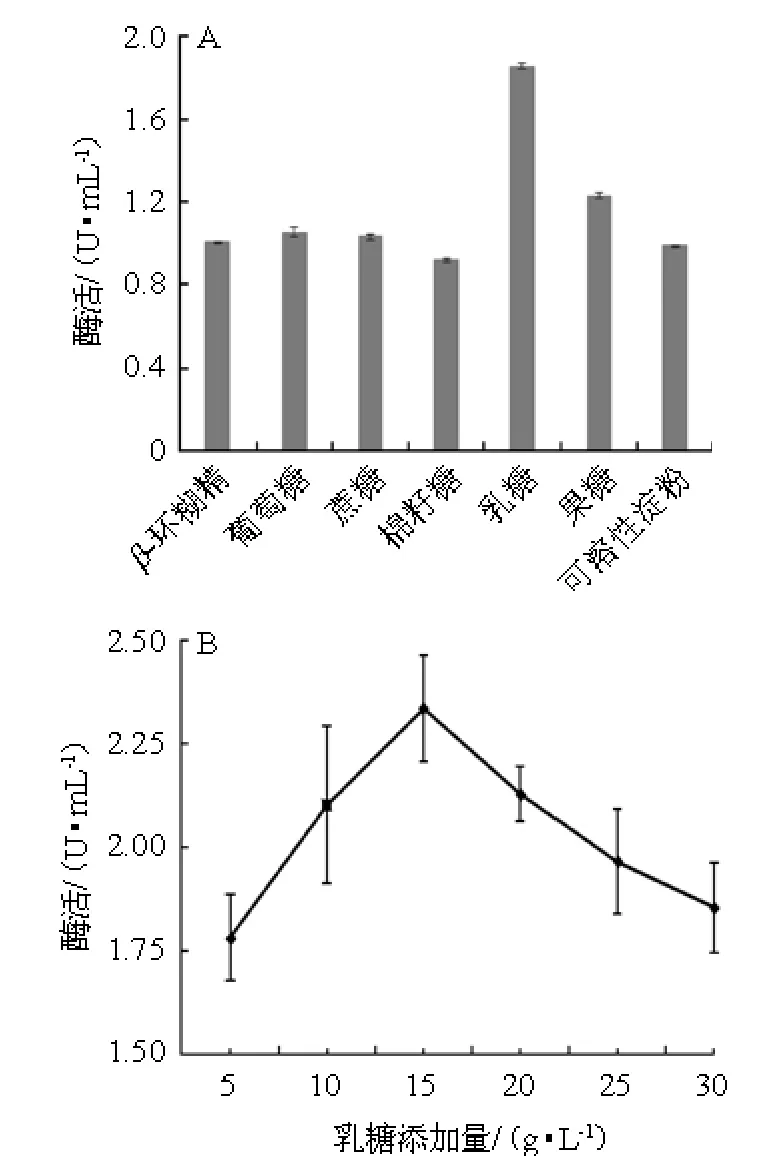
图5 不同碳源(A)及乳糖添加量(B)对α-半乳糖苷酶酶活的影响Fig.5 Effect of different carbon sources (A) and lactose addition (B)on α-galactosidase activity
2.3.2 氮源对菌株A1-19产α-半乳糖苷酶的影响
不同氮源及最佳氮源添加量对黑曲霉A1-19产α-半乳糖苷酶酶活力的影响,结果见图6。由图6A可知,有机氮源(蛋白胨、酵母膏、牛肉膏、豆粕粉)比无机氮源(硝酸钠、硫酸铵、柠檬酸三铵)产生的α-半乳糖苷酶酶活力高,尤其以牛肉膏为氮源时,黑曲霉A1-19产α-半乳糖苷酶酶活力最高,为3.92 U/mL,以硫酸铵为氮源酶活力最低为0.81 U/mL,有机氮源能够更好的促进黑曲霉蛋白质及遗传物质的合成提高酶活力,故选择牛肉膏为氮源进行后续试验。由图6B可知,牛肉膏添加量为5~10 g/L时,α-半乳糖苷酶的酶活力随之增加;牛肉膏添加量为10 g/L时,α-半乳糖苷酶的酶活力最大;牛肉膏添加量>10 g/L之后,α-半乳糖苷酶的酶活力随之下降。因此,牛肉膏最佳添加量为10 g/L。
2.3.3 无机盐对菌株A1-19产α-半乳糖苷酶的影响
不同无机盐对黑曲霉A1-19产α-半乳糖苷酶酶活力的影响,结果见图7。由图7A可知,添加硫酸镁、磷酸氢二钠、氯化锰试验组α-半乳糖苷酶酶活力高于对照组,尤其氯化锰提高明显,LEE J等[20]研究发现,芽孢杆菌发酵培养基中添加硫酸锰可以大幅度提高α-半乳糖苷酶产量;而其他无机盐氯化钾、磷酸氢二钾、硫酸亚铁、硫酸铜试验组α-半乳糖苷酶酶活力低于对照组。表明无机盐硫酸镁、磷酸氢二钠、氯化锰促进了黑曲霉A1-19产α-半乳糖苷酶,氯化锰产α-半乳糖苷酶酶活力最高,促进作用较强,这可能是Mg2+、Na+、Mn2+参与并促进了α-半乳糖苷酶的活性基团合成;氯化钾、磷酸氢二钾、硫酸亚铁、硫酸铜抑制了α-半乳糖苷酶的生产,硫酸亚铁产α-半乳糖苷酶酶活力最低,抑制作用最强。故选择硫酸镁、磷酸氢二钠、氯化锰复合无机盐为发酵培养基无机盐进行后续试验。由图7B可知,硫酸镁添加量为0.2~0.8 g/L时,α-半乳糖苷酶的酶活力随之增加;硫酸镁添加量为0.8 g/L时,α-半乳糖苷酶的酶活力最大;硫酸镁添加量>0.8 g/L之后,α-半乳糖苷酶的酶活力随之下降。因此,硫酸镁最佳添加量为0.8 g/L。由图7C可知,磷酸氢二钠添加量为0.5~1.0 g/L时,α-半乳糖苷酶的酶活力随之增加;磷酸氢二钠添加量为1.0 g/L时,α-半乳糖苷酶的酶活力最大;磷酸氢二钠添加量>1.0 g/L之后,α-半乳糖苷酶的酶活力随之下降。因此,磷酸氢二钠最佳添加量为1.0 g/L。
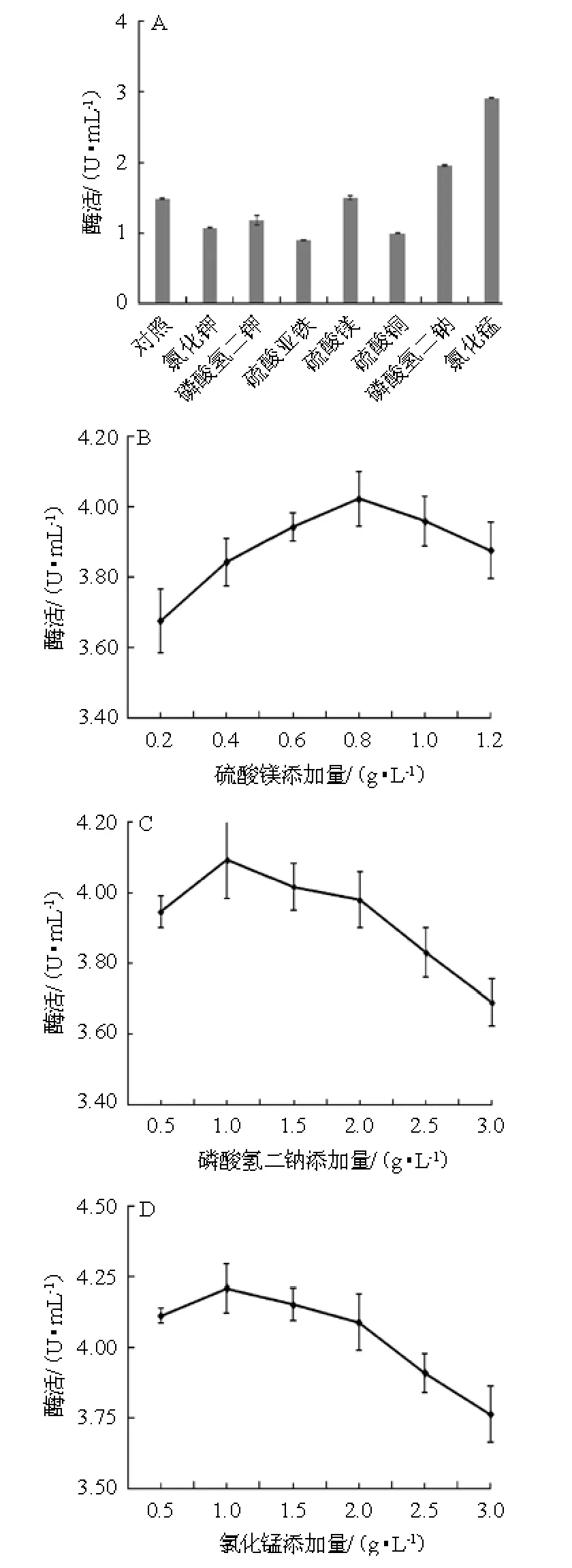
图7 不同无机盐(A)及硫酸镁(B)、磷酸氢二钠(C)、氯化锰(D)添加量对α-半乳糖苷酶酶活的影响Fig.7 Effect of different inorganic salts (A),MgSO4·7H2O (B),Na2HPO4(C) and MnCl2(D) addition on α-galactosidase activity
由图7D可知,氯化锰添加量为0.5~1.0 g/L时,α-半乳糖苷酶的酶活力随之增加;氯化锰添加量为1.0g/L时,α-半乳糖苷酶的酶活力最大;氯化锰添加量>1.0 g/L之后,α-半乳糖苷酶的酶活力随之下降。因此,氯化锰最佳添加量为1.0 g/L。
2.3.4 诱导物对菌株A1-19产α-半乳糖苷酶的影响
α-半乳糖苷酶为诱导酶[21],其基因表达调控遵循一定机制,诱导物大部分为底物、底物类似物,发酵过程中添加诱导物对产酶有较大影响。蔡国林等[10]从黄酒麦曲中筛选出的黑曲霉wx-07产α-半乳糖苷酶中蔗糖是很好的诱导因子。不同诱导物及最佳诱导物添加量对黑曲霉A1-19产α-半乳糖苷酶酶活力的影响,结果见图8。
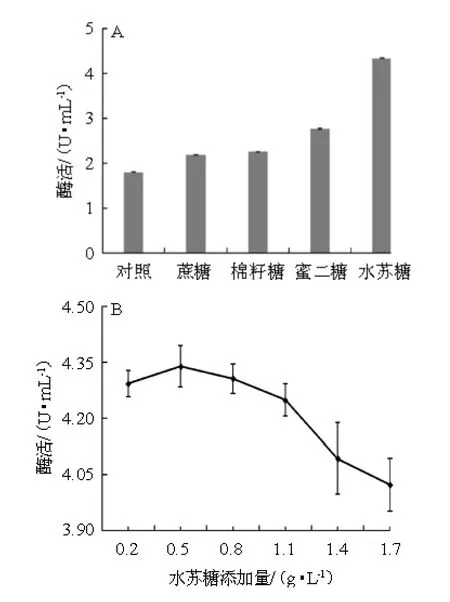
图8 不同诱导物(A)及水苏糖添加量(B)对α-半乳糖苷酶酶活的影响Fig.8 Effect of different inducer (A) and stachyose addition (B) on α-galactosidase activity
由图8A可知,添加蔗糖、棉籽糖、蜜二糖、水苏糖试验组α-半乳糖苷酶酶活力高于对照组,说明蔗糖、棉籽糖、蜜二糖、水苏糖对黑曲霉A1-19产α-半乳糖苷酶均有一定正向诱导作用,其中添加水苏糖试验组黑曲霉A1-19产α-半乳糖苷酶酶活力最高,为4.33 U/mL,这与杜新永[22]的报道一致,蔗糖、棉籽糖、蜜二糖、水苏糖也是糖类可作为碳源,在碳源优化单因素试验中棉籽糖、蔗糖不是黑曲霉A1-19产α-半乳糖苷酶最佳碳源,但是它们与乳糖组成复合碳源同时又为酶的诱导物时,能够促进α-半乳糖苷酶的生产,试验结果证明它们作为酶的诱导物时作用更大。故选择水苏糖为诱导物进行后续试验。由图8B可知,水苏糖添加量为0.2~0.5 g/L时,α-半乳糖苷酶的酶活力随之增加;水苏糖添加量为0.5 g/L时,α-半乳糖苷酶的酶活力最大;水苏糖添加量>0.5 g/L之后,α-半乳糖苷酶的酶活力随之下降。因此,水苏糖最佳添加量为0.5 g/L。
2.4 菌株A1-19产α-半乳糖苷酶培养基优化的正交试验
在单因素试验的基础上,以α-半乳糖苷酶酶活为评价指标,选择碳源乳糖(A)、氮源牛肉膏(B)、硫酸镁(C)、磷酸氢二钠(D)、氯化锰(E)、水苏糖(F)为六种因素,每个因素设计3个水平,设计L18(36)正交试验,正交试验结果与分析见表2。由表2可知,发酵培养基中对菌株A1-19产α-半乳糖苷酶的影响因素强弱依次为F>A>E>B>D>C,因素F酶的诱导物水苏糖影响产酶的主要因素,其他依次为乳糖、氯化锰、牛肉膏、磷酸氢二钠以及硫酸镁,其适宜的培养基配方组合为A2B2C3D1E2F3。即乳糖15.0 g/L、牛肉膏10.0 g/L、硫酸镁1.0 g/L、磷酸氢二钠0.5 g/L、氯化锰1.0 g/L、水苏糖0.8 g/L。在此优化的培养基条件下,进行3次平行验证试验,菌株A1-19产α-半乳糖苷酶酶活力达到7.85 U/mL,是优化前酶活力(1.16 U/mL)的6.77倍。
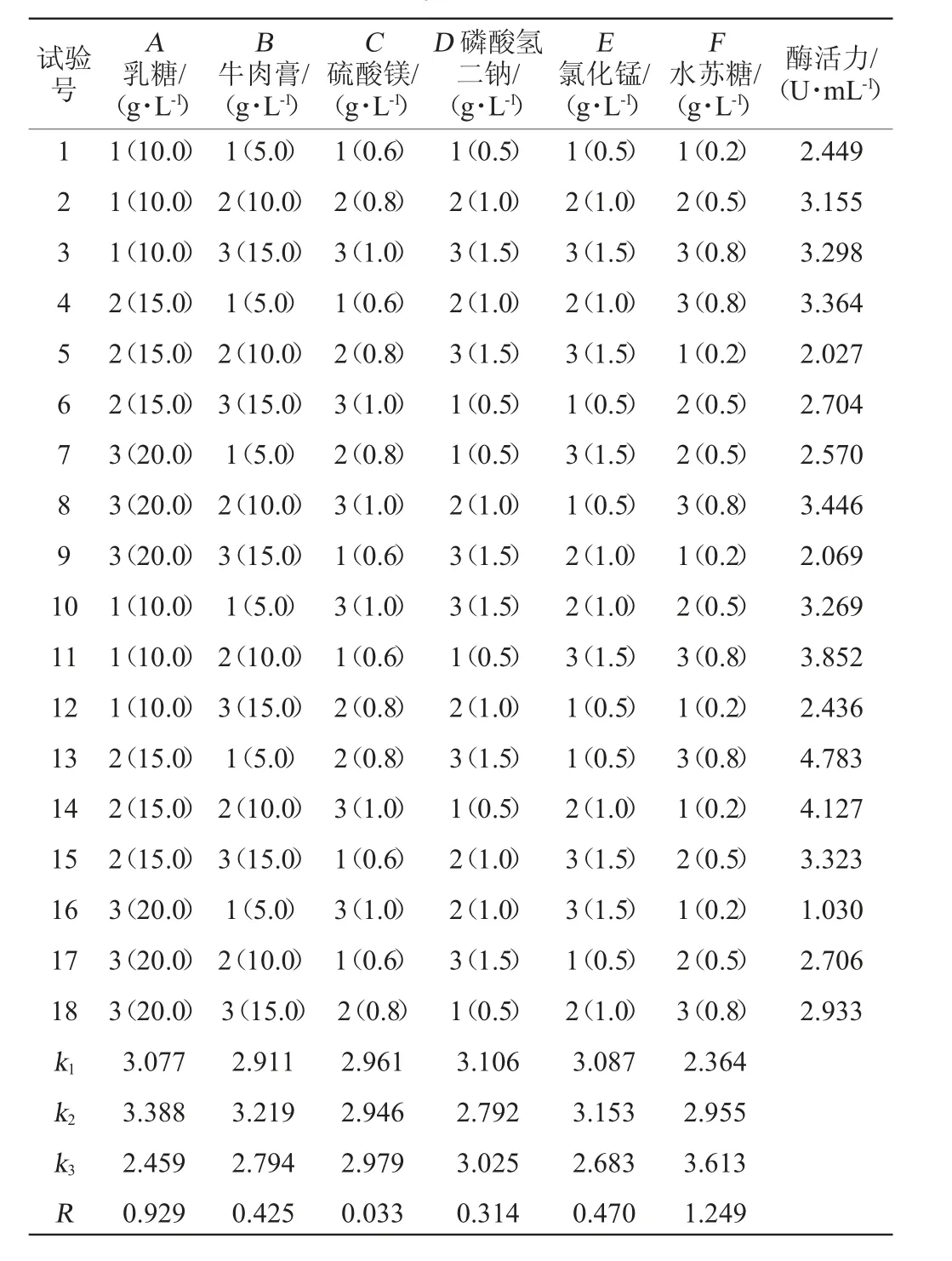
表2 培养基配方优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for medium formula optimization
3 结论
本研究从河南郑州花园口紫花苜蓿草种植土壤中,分离筛选得到一株产α-半乳糖苷酶真菌菌株,经过形态学观察和分子生物学鉴定,将其鉴定为黑曲霉菌(Aspergillus niger),编号为A1-19,采用单因素和正交试验得到最佳培养基配方为乳糖15.0 g/L、牛肉膏10.0 g/L、硫酸镁1.0 g/L、磷酸氢二钠0.5 g/L、氯化锰1.0 g/L、水苏糖0.8 g/L,通过优化菌株A1-19产α-半乳糖苷酶发酵培养基成分及组成,发酵液α-半乳糖苷酶酶活力达到7.85 U/mL,是优化前发酵酶活力(1.16 U/mL)的6.77倍,为其α-半乳糖苷酶生产菌株的工业生产利用开辟了更多可能的途径。

