贝莱斯芽孢杆菌抑菌物质的分析及提取优化
刘 安,赵 华,张朝正
(天津科技大学 生物工程学院工业发酵微生物教育部重点实验室 天津市工业微生物重点实验室天津市微生物代谢与发酵过程控制技术工程中心,天津 300457)
尖孢镰刀菌(Fusarium oxysporum)是一种既可侵染植物又可在土壤内生存的兼性寄生真菌,是一种可引起植物枯萎病的世界性土传真菌病害[1]。该菌侵染寄主维管束系统,并在生长代谢过程中产生毒素危害作物,造成作物萎蔫死亡,最终在死亡组织表面产生大量孢子,进一步扩散到其他部位或其他植株[2]。尖孢镰刀菌可引起100多种植物发生枯萎病,给作物生产带来严重的损失,国内外已报道的受害作物有棉花、甘蔗、香蕉、番茄、黄瓜、西瓜、大豆等[3-4]。因此,寻找合适的防治措施成为治理枯萎病的重中之重。
目前防治植物枯萎病的主要方法是化学防治、物理防治、生物防治和利用农业措施(如作物嫁接[5-6]、合理轮作[7]和培育抗病品种等)。利用化学方法会产生大量农药残留并造成环境严重污染;培育抗病品种周期长,员工培训困难,资源耗费高[8]。因此以生物防治为主导的综合防治措施的研究,对植物枯萎病防治具有非常重要的意义。
用于植物枯萎病的生防菌株主要分为三大类:生防细菌、生防真菌和生防放线菌。生防细菌主要有假单胞菌(Pseudomonas)[9]和芽孢杆菌(Bacillus)[10]等;生防真菌主要有木霉(Trichodermaspp.)[11]等;生防放线菌主要有链霉菌(Streptomycetaceae)[12]等。其中贝莱斯芽孢杆菌(Bacillus velezensis)作为一种新型菌种,在2008年被确定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)的后期异型体[13]。LIM S M等[14]筛选出一株对多种病原菌有较强的抑制作用的B.velezensisG341。孙平平等[15]筛选出一株对梨灰霉和青霉病菌具有很好拮抗作用的B.velezensis,其具有分布广、易培养、生长速度快、稳定性好、易分离、难失活、无毒无害、无污染等优点。其代谢产物种类多、抗菌活性强、不易受外界环境影响。因此对菌株和其代谢产物的性质及应用的研究也越来越多。
B.velezensis可通过分泌多种酶(如角蛋白酶、β-葡聚糖酶[16]、纤维素酶、蛋白酶[17]等)进行抑菌。对提高农作物产量、保护生态环境和维持农业生态系统的平衡具有重要意义。与普通生防芽孢杆菌相似,B.velezensis的生防机制主要是竞争作用、拮抗作用、溶菌作用和诱导植物抗性机制等[18]。作为生物防治菌株,B.velezensis具有分泌某些胶原蛋白类物质的能力,这为生防菌株在植物根际定殖能力提供极其重要的基础;在植物促进生长方面,B.velezensis除能分泌大量的细胞分裂素促进植物生长外,也能分泌一些挥发性化合物调节植物生长素的稳定性,进一步实现对植株生长的促进作用[19]。
前期工作中筛选到1株对尖孢镰刀菌有较强拮抗作用的菌株,鉴定为贝莱斯芽孢杆菌(B.velezensis)[20]。本研究以贝莱斯芽孢杆菌P9为研究对象,利用有机溶剂萃取、酸沉淀法及薄层层析(thin layer chromatography,TLC)法对其抗菌物质提取及化学成分分析,并考察其稳定性,为菌株P9防治植物枯萎病的开发应用提供重要的实验数据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
贝莱斯芽孢杆菌(B.velezensis)P9:天津科技大学工业发酵微生物重点实验室;尖孢镰刀菌(F.oxysporum):天津科技大学菌种保藏中心。
1.1.2 化学试剂
(NH4)2SO4(分析纯):天津子涵生物科技有限公司;冰乙酸、KH2PO4、MgSO4·7H2O(均为分析纯):天津市化学试剂一厂;K2HPO4、水合茚三酮(均为分析纯):天津市风船化学试剂科技有限公司;CaCl2(分析纯)、刚果红(生物染料):天津鼎国生物技术有限责任公司;羧甲基纤维素钠(分析纯):天津市大茂化学试剂厂;β-葡聚糖(分析纯):北京华夏远洋科技有限公司;氯仿(分析纯):天津索罗门生物科技有限公司;乙酸乙酯(分析纯):天津一方科技有限公司;二氯甲烷(分析纯):北京华威锐科化工有限公司;几丁质(分析纯):天津泰进科技有限公司;甲醇(分析纯):天津艾利安电子科技有限公司。
1.1.3 培养基
LB培养基:酵母浸粉5.0 g/L、蛋白胨10.0 g/L、氯化钠10.0g/L,pH=7.0,固体时添加琼脂20.0g/L,121℃灭菌20min。
淀粉培养基:可溶性淀粉10.0 g/L、牛肉膏3.0 g/L、蛋白胨10.0 g/L、NaCl 5.0 g/L、琼脂20.0 g/L,pH=7.2,115 ℃灭菌20min。
β-葡聚糖酶选择培养基:β-葡聚糖1.0g/L,刚果红0.4g/L,蛋白胨10.0 g/L,KH2PO41.0 g/L,MgSO4·7H2O 1.0 g/L,CaCl20.4 g/L,琼脂20.0 g/L,pH=7.0,121 ℃灭菌20 min。
羧甲基纤维素钠(carboxymethylcellulose-Na,CMC-Na)培养基:CMC-Na10.0g/L、(NH4)2SO44.0g/L、酵母浸粉5.0g/L、K2HPO42.0 g/L、刚果红0.4 g/L、MgSO4·7H2O 0.5 g/L,pH=7.6,121 ℃灭菌20 min。
脱脂奶粉培养基:牛肉膏1.0 g/L、蛋白胨2.0 g/L、氯化钠1.0 g/L、脱脂奶粉20.0 g/L、琼脂20.0 g/L,pH=7.0,其中脱脂奶粉单独溶解并在100 ℃水浴30 min灭菌,其余成分121 ℃灭菌20 min,混匀后倒平板。
几丁质培养基:胶状几丁质15.0 g/L、酵母浸粉3.0 g/L、(NH4)2SO41.0 g/L、MgSO4·7H2O 0.3 g/L、KH2PO41.4 g/L,121 ℃灭菌20 min。
1.2 仪器与设备
H1815高速离心机:湘仪离心仪器有限公司;HPX-9162 MBE电热恒温恒湿培养箱:上海博讯实业有限公司医疗设备厂;Lab-1D-50真空冷冻干燥机:北京博医康实验仪器有限公司;SY.45-NJB牛津杯(Φ6 mm×8 mm×10 mm):北京先驱威锋技术开发公司。
1.3 方法
1.3.1 菌株产酶分析
将LB培养基上培养24 h的菌株P9接种于淀粉培养基、β-葡聚糖酶选择培养基、CMC-Na培养基、脱脂奶粉培养基和几丁质培养基上,每种培养基重复接种3次,30 ℃倒置培养4~5 d后观察菌落周围是否有透明圈出现。
1.3.2 抑菌物质提取预处理
将菌株P9接种于LB培养基,30 ℃、160 r/min摇瓶培养72 h,收集发酵液于4 ℃、10 000 r/min离心15 min除去菌体,收集上清液备用。
1.3.3 有机溶剂萃取
采用有机溶剂萃取法提取抑菌物质[21],萃取剂分别选用氯仿、乙酸乙酯、二氯甲烷。取50 mL氯仿缓慢加入50 mL发酵上清液中,充分混匀后静置,分别收集有机相和水相,用旋转蒸发仪分别浓缩至5 mL,经微生物滤膜(Φ=0.22 μm)过滤除菌体,分别选用对应有机溶剂和水作为对照,采用牛津杯法[22]测定各组分对尖孢镰刀菌的拮抗作用,使用卡尺选择十字交叉法[23]测定抑菌圈直径。采用相同的方法测定乙酸乙酯、二氯甲烷作为有机溶剂进行萃取时收集的各组分对尖孢镰刀菌的拮抗作用。
1.3.4 酸沉淀法提取
采用酸沉淀法[24-25]提取抑菌物质,取50 mL发酵上清液,使用6 mol/L的HCl调节pH=2.0,于4 ℃冰箱静置过夜,4 ℃、12 000 r/min离心10 min收集沉淀。使用甲醇(pH=7)进行抽提,4 ℃、12 000 r/min 条件下离心10 min,收集上清甲醇抽提液及沉淀,然后沉淀再次用甲醇进行抽提、离心,重复上述步骤3次,合并所有甲醇提取液,用2 mol/L的NaOH溶液调节pH=7.0,旋转蒸发仪浓缩后真空冷冻干燥抽提物,然后加入甲醇溶解并再次冷冻干燥,获得抑菌物质粗提物。最后用磷酸盐缓冲液(phosphate buffer solution,PBS)(pH=7.0)溶解,经微生物滤膜(Φ=0.22 μm)过滤除菌体后,采用牛津杯法测定粗提物对尖孢镰刀菌的拮抗作用。
1.3.5 酸沉淀实验条件的优化
(1)酸沉淀法提取时pH值的优化
取发酵上清液,用6 mol/L的盐酸调节pH值分别为1.5、2.0、3.0、4.0、5.0,按照上述步骤进行提取。将所得的抽提物用甲醇溶解并再次冷冻干燥,最后加入PBS溶液(pH=7.0)溶解,经微生物滤膜(Φ=0.22 μm)过滤除菌体,采用牛津杯法测定粗提物对尖孢镰刀菌的拮抗作用。
(2)溶解液配比的优化
按照上述酸沉淀方法,分别取固体抽提物,按照表1中甲醇与PBS(pH=7.0)的配比,将所得的固体溶解并经微生物滤膜(Φ=0.22 μm)过滤除菌体,采用牛津杯法测定粗提物对尖孢镰刀菌的拮抗作用。

表1 甲醇与磷酸盐溶液的体积比Table 1 Volume ratio of methanol to phosphate buffer
1.3.6 抑菌物质分析
采用薄层层析(thin-layer chromatography,TLC)法分析抑菌物质。
(1)取用a、b、c 三个薄层层析硅胶板,将具有拮抗活性的发酵液粗提物用甲醇溶解,在距离薄层层析硅胶板底部1 cm处进行点样。
(2)展开剂的配制,展开剂各成分配比为氯仿∶甲醇∶冰乙酸∶水=65∶30∶4∶4(V/V)。
(3)将展开剂置入层析缸中,取b、c板放入层析缸中进行展开。
(4)待层析板c干燥后,放置于存有浓盐酸的密封水解瓶中进行原位酸水解(110 ℃,90 min)。
(5)均匀喷洒0.5%茚三酮溶液于a、b、c各板,于110 ℃烘箱加热20 min,观察显色情况。
1.3.7 抑菌物质稳定性分析
(1)温度稳定性分析
将抑菌物质粗提液经4 ℃、25 ℃、50 ℃、75 ℃、100 ℃、120 ℃处理30 min后,采用牛津杯法进行抑菌活性的测定,观察温度对抑菌物质粗提液稳定性的影响。
(2)金属离子稳定性分析
分别向抑菌物质粗提液中添加1 mol/L的Mg2+、Mn2+、Fe3+、Cu2+、Zn2+、Ca2+,每1 mL抑菌物质粗提液添加100 μL金属离子溶液,选用不添加金属离子的粗提液为对照。采用牛津杯法进行抑菌活性的测定,观察金属离子对抑菌物质粗提液稳定性的影响。
2 结果与分析
2.1 菌株产酶分析
菌株P9在各培养基中产生透明圈的结果如图1所示。
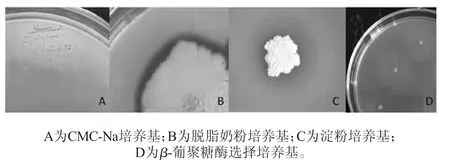
图1 贝莱斯芽孢杆菌P9在不同培养基上的产酶分析Fig.1 Analysis of enzyme production of Bacillus velezensis P9 on different medium
由图1可知,菌株P9在CMC-Na培养基、淀粉培养基、脱脂牛奶培养基及β-葡聚糖酶选择培养基上均能生长且均有透明圈产生,但在几丁质培养基上未生长。结果表明,该菌株能分泌纤维素酶、淀粉酶、蛋白酶及β-葡聚糖酶等酶,但不能分泌几丁质酶。并且从图1可以看出,菌株在脱脂奶粉培养基上生长最旺盛,在淀粉培养基上次之,在β-葡聚糖酶选择培养基及CMC-Na培养基上生长缓慢,表明菌株P9不适宜在后两者培养基上生长。
2.2 抑菌物质提取条件分析
2.2.1 有机溶剂萃取
分别选用氯仿、乙酸乙酯、二氯甲烷作为有机相提取抑菌物质。取50 mL氯仿缓慢加入50 mL发酵上清液中,充分混匀后静置,分别收集有机相和水相,旋转蒸发仪分别浓缩至5 mL,经微生物滤膜(Φ=0.22 μm)过滤除菌体,分别选用对应有机溶剂和水作为对照,采用牛津杯法测定各组分对尖孢镰刀菌的拮抗作用,然后用相同的方法测定乙酸乙酯、二氯甲烷作为有机溶剂进行萃取时收集的各组分对尖孢镰刀菌的拮抗作用,结果见图2。
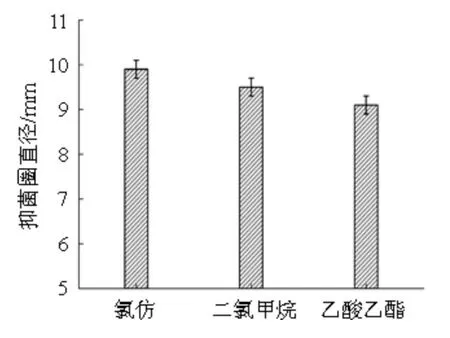
图2 不同有机相萃取物质的抑菌效果Fig.2 Antibacterial effect of extract extracted by different organic phases
由图2可知,抑菌物质可以通过萃取的方式从发酵上清液中提取出来,但是有抑菌效果的部分为有机相萃取液,对照组均无抑菌圈产生,其中使用氯仿作为萃取剂时所提取出的抑菌物质最多,其抑菌圈直径可达9.9 mm。
2.2.2 酸沉淀法提取
取50 mL发酵上清液,用6 mol/L的HCl调节pH值至2.0,于4 ℃冰箱静置过夜,4 ℃、12 000 r/min离心10 min收集沉淀,使用甲醇(pH=7)进行抽提,重复上述步骤3次,合并所有甲醇提取液,用2 mol/L的NaOH溶液调节pH=7.0,旋转蒸发仪浓缩后真空冷冻干燥抽提物,然后加入甲醇溶解再次冷冻干燥,获得抑菌物质粗提物。最后用PBS(pH=7.0)溶解,经微生物滤膜(Φ=0.22 μm)过滤除菌体后,采用牛津杯法测定粗提物对尖孢镰刀菌的拮抗作用,结果见图3。
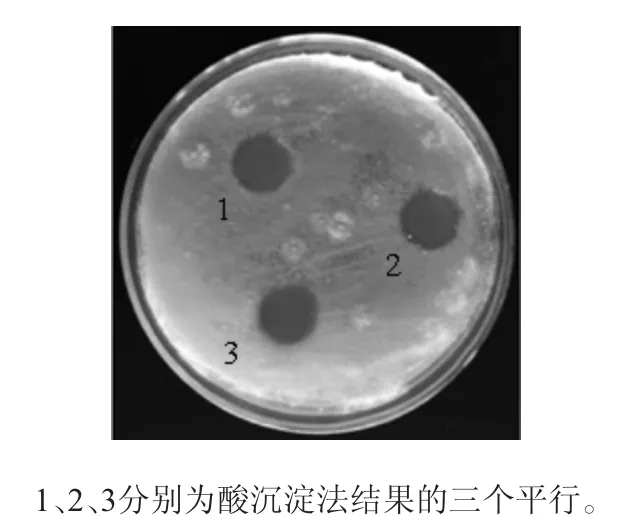
图3 酸沉淀法提取的抑菌物质的抑菌效果Fig.3 Antibacterial effect of bacteriostatic substances extracted by acid precipitation
由图3可知,使用酸沉淀的方法可以提取出发酵上清液中的抑菌物质,通过测量,其抑菌圈直径约为13.8 mm。同时对比上述提取方法可知,通过酸沉淀方法提取出的抑菌物质最多,表现为抑菌试验中抑菌圈直径最大,因此选择酸沉淀法对贝莱斯芽孢杆菌P9发酵液中的抑菌物质进行提取。
2.3 酸沉淀法提取条件的优化
2.3.1 pH值的优化

图4 不同pH值提取的抑菌物质的抑菌效果Fig.4 Antibacterial effect of bacteriostatic substances extracted under different pH conditions
取发酵上清液,用6 mol/L的盐酸调节pH值分别为1.5、2.0、3.0、4.0、5.0,按照1.3.4步骤进行提取。将所得的真空冷冻干燥抽提物用PBS溶解,经微生物滤膜(Φ=0.22 μm)过滤除菌体,采用牛津杯法测定各组分对尖孢镰刀菌的拮抗作用。各pH值下提取的抑菌物质的抑菌效果见图4。
由图4可知,当pH值<2.0时,酸沉淀提取的抑菌物质产生的抑菌圈直径大小几乎相同,当pH值>2.0时,抑菌圈直径迅速缩小,由此可知,当pH值>2.0时,酸沉淀提取的抑菌物质迅速减少,因此实验中采用酸沉淀法提取抑菌物质时用6 mol/L的盐酸调整pH值为2.0左右。
2.3.2 溶解液配比优化
按照1.3.4的酸沉淀方法,提取固体抽提物两份,按照表1中甲醇与PBS的配比,将所得的固体溶解并经微生物滤膜(Φ=0.22 μm)过滤除菌体,采用牛津杯法测定各组分对尖孢镰刀菌的拮抗作用。不同配比的溶解液得到的抑菌物质的抑菌效果见图5。

图5 溶剂比对抑菌物质的抑菌效果的影响Fig.5 Effect of solvent ratio on antibacterial effect of bacteriostatic substances
由于经过浓缩成固体的抑菌物质粗提物极易溶于甲醇,而只采用甲醇进行溶解时,由于甲醇易挥发且抑制了抑菌物质的活性,使得抑菌物质并不能发挥到最好的抑菌效果,因此选择添加PBS,目的是为抑菌物质提供了缓冲环境,提高了抑菌活性。由图5可知,随着甲醇含量的减少,抑菌圈的直径逐渐增加,表明更多的抑菌物质发挥了作用,当甲醇∶PBS=1∶3(V/V)时,抑菌圈直径达到最大,为14.3 mm。因此,选用甲醇∶PBS=1∶3(V/V)。
2.4 薄层色谱法分析抑菌物质
菌株P9的抑菌物质粗提物的层析分析结果如图6所示。
对a板采取只点样不展开的方法,对b、c板使用展开剂进行展开,只对c板进行原位酸水解,最后对a、b、c板均匀喷洒茚三酮溶液,置于110 ℃烘箱20 min后取出观察。由图6可知,对a板进行分析,喷洒茚三酮后样品颜色呈现蓝紫色,表明所提取的抑菌物质中含有氨基酸或短肽类物质,结合抑菌物质提取方法可知,抑菌物质为脂肽类物质[26]。对b板分析可得出,粗提物中至少存在5种以上的含肽类物质,而将b、c板对比分析可得,c板上并未出现更多的条带,初步判断抑菌物质不存在闭合的环状肽[27]。
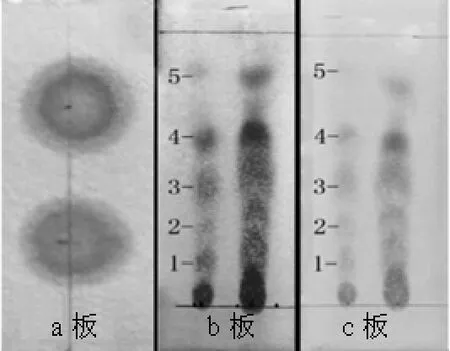
图6 薄层色谱法分析抑菌物质粗提物成分的结果Fig.6 Results of crude extracts of bacteriostatic substances by thin layer chromatography analysis
2.5 抑菌物质稳定性分析
2.5.1 温度稳定性分析
改变菌株P9抑菌物质粗提物的温度处理条件,采用牛津杯法进行抑菌活性的测定。得粗提物对温度变化的稳定性结果如图7所示。

图7 温度对抑菌物质稳定性的影响Fig.7 Effect of temperature on the stability of bacteriostatic substances
由图7可知,菌株P9发酵上清液提取的脂肽类粗提物受温度变化影响较大,当温度为0~50 ℃时,随着温度的升高,脂肽粗提物抑菌圈直径保持相对稳定;当温度高于50 ℃时,随着温度的升高,脂肽类粗提物的稳定性逐渐降低,但依然对病害菌有一定的抑制性。结果表明,该粗提物的温度保持在25 ℃时活性最大,0~50 ℃稳定性最好。
2.5.2 金属离子稳定性分析
分别向抑菌物质粗提液中添加各种金属离子,选用不添加金属离子的粗提液为对照。采用牛津杯法进行抑菌活性的测定。金属离子对抑菌物质稳定性的结果如图8所示。
由图8可知,所使用的金属离子对拮抗物都有一定的影响,但影响都不大,与对照组相比,Cu2+和Mn2+对脂肽粗提物的稳定性几乎无影响,而Mg2+、Ca2+、Zn2+和Fe2+对其有一定的影响。可能是这些金属离子会抑制脂肽类的抑菌物质活性,导致抑菌效果有所降低,表现为抑菌圈直径变小。
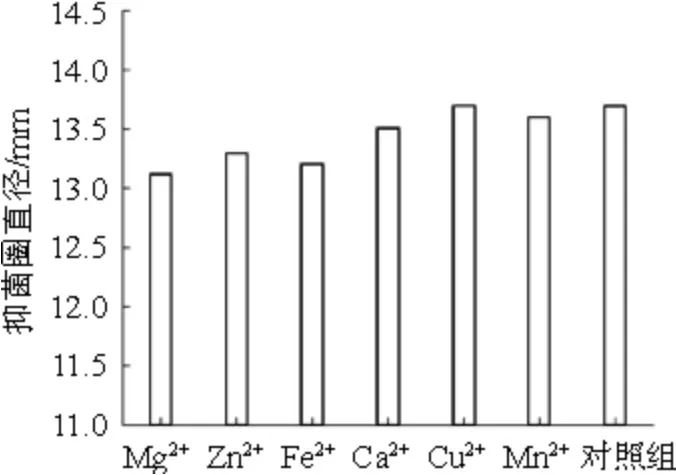
图8 金属离子对抑菌物质稳定性的影响Fig.8 Effect of metal ions on the stability of bacteriostatic substances
3 结论
本实验选用贝莱斯芽孢杆菌(B.velezensis)P9为研究对象,通过接种P9于不同的产酶培养基进行培养,结果表明,贝莱斯芽孢杆菌P9具有分泌纤维素酶、淀粉酶、蛋白酶、β-葡聚糖酶的能力,但在CMC-Na培养基及β-葡聚糖酶选择培养基上生长比较缓慢。对菌株P9的抑菌物质进行提取结果发现,使用酸沉淀提取出的抑菌物质最多,表现为抑菌圈直径最大;通过优化酸沉淀时的pH值结果发现,pH=2.0时酸沉淀的效果最好,其表现为抑菌圈直径可达14.3 mm。而对沉淀进行重悬时,用甲醇∶PBS=1∶3(V/V),可以使抑菌物质活性最大化,表现为抑菌圈直径最大。TLC法分析抑菌物质粗提物时发现,提取出的抑菌物质可能为脂肽类物质。对抑菌物质的稳定性分析发现,抑菌物质对温度较为敏感,在温度高于50 ℃后,抑菌效果逐渐下降;而受金属离子的影响较小。因此,本实验将为致病性尖孢镰刀菌的生物防治提供有利实验参考。

