α-平滑肌肌动蛋白在结直肠癌组织中的表达及临床意义
孙昭,李哲,谷俊杰,杨莹,白春梅,管梅
中国医学科学院北京协和医院肿瘤内科,北京 100730
结直肠癌是常见的消化系统恶性肿瘤,目前,中国每年新发病例数约37万,其起病隐匿,中国人群的内镜检查率相对较低,导致25%的患者明确诊断时已经发生远处转移,且约50%可切除的结直肠癌患者会出现复发转移,因此,结直肠癌每年死亡病例数约20万。肿瘤微环境中的非肿瘤细胞对肿瘤的进展和预后均具有重要影响,其中,肿瘤相关成纤维细胞(cancer-associated fibroblast,CAF)在肿瘤微环境中起重要作用,其主要特征为表达α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)。CAF高表达白细胞介素(interleukin,IL)-4、IL-6、IL-8、IL-10、肿瘤坏死因子(tumor necrosis factor,TNF)-α、TGF-β、γ干扰素(interferon-γ,IFN-γ)、基质细胞衍生因子1(stromal cell-derived factor 1,SDF-1)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和趋化因子受体2(C-C motif chemokine receptor 2,CCR2)等炎性因子,可募集多种免疫抑制细胞,形成肿瘤免疫抑制微环境,促进肿瘤细胞的免疫逃逸;也可通过促进肿瘤细胞发生上皮-间充质转化,从而促进肿瘤细胞的转移。α-SMA的高表达与乳腺癌、肺癌和口腔癌患者的预后不良均有关[1-3]。结直肠癌组织中也存在大量的CAF,可能与结直肠癌的进展有关,因此,本研究探讨α-SMA在结直肠癌组织中的表达情况及其与结直肠癌患者临床特征和预后的关系,现报道如下。
1 资料与方法
1.1 一般资料
选取2014年11月至2015年12月于中国医学科学院北京协和医院接受手术治疗的结直肠癌患者。所有患者均经病理证实为结直肠癌,且均有详细的临床资料,均行R0切除术;术后均采用氟尿嘧啶联合奥沙利铂的化疗方案进行辅助治疗;有完整的影像学资料供肿瘤分期评价;有足够的组织标本供免疫组织化学检测。本研究共纳入103例结直肠癌患者。根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)颁布的肿瘤TNM分期标准[4]进行分期:Ⅱ期66例,Ⅲ期37例;男49例,女54例;>60岁76例,≤60岁27例;肿瘤部位:左半结直肠癌25例,右半结直肠癌78例;病理类型:高分化腺癌22例,中分化腺癌70例,低分化腺癌5例,黏液细胞癌5例,印戒细胞癌1例;微卫星不稳定(microsatellite instability,MSI)患者 27例,微卫星稳定(microsatellite stability,MSS)患者67例,无微卫星稳定情况数据患者9例。收集103例结直肠癌患者经手术切除的结直肠癌组织标本。
1.2 免疫组化染色法检测结直肠癌组织中α-SMA的表达
采用10%的甲醛溶液固定结直肠癌组织,常规进行结直肠癌组织的取材、脱水和石蜡包埋,制作厚度为4 μm的石蜡包埋组织块。石蜡切片均常规脱蜡至水,0.01 mol/L柠檬酸缓冲液进行微波抗原修复,阻断内源性过氧化物酶的活性,山羊血清封闭15 min;加入鼠抗人α-SMA抗体(1∶200稀释,购自武汉塞维尔生物科技有限公司),4℃冰箱过夜;滴加山羊抗鼠通用抗体(购自丹麦DAKO公司),室温孵育2 h,采用磷酸盐缓冲液(phosphate buffered saline,PBS)代替一抗作为阴性对照,以血管平滑肌作为阳性对照;然后切片常规脱水至二甲苯,树脂封片,在显微镜下观察。
1.3 免疫组化染色结果判定标准
所有石蜡切片的免疫组化检测结果由2名病理科医师采用双盲方法独立判读。α-SMA主要表达于结直肠癌中CAF的细胞浆中,阳性染色呈棕色颗粒。随机选择5个高倍视野,根据染色强度与阳性细胞所占百分比进行评分。染色强度评分标准:无色为0分,淡棕色为1分,深棕色为2分;阳性细胞所占百分比评分标准:在5个高倍视野下计算染色细胞占视野细胞总数的百分比,阳性细胞<10%为0分,10%~39%为1分,40%~69%为2分,≥70%为3分。染色强度评分与阳性细胞所占百分比评分相加,总分0~2分为α-SMA低表达,3~5分为α-SMA高表达。
1.4 随访
随访截止到患者进展,随访方式为门诊随访和电话随访,无进展结直肠癌患者的末次随访日期为2018年1月。无病生存期指从手术后R0切除开始至有影像学资料证明疾病复发的时间。
1.5 统计学方法
采用SPSS 19.0软件对数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验。采用Kaplan-Meier法绘制生存曲线,生存分析采用Log-rank检验;以P<0.05为差异有统计学意义。
2 结果
2.1 不同临床特征结直肠癌患者结直肠癌组织中α-SMA 蛋白的表达情况
103例结直肠癌患者中有25例患者α-SMA高表达,78例患者α-SMA低表达。不同性别、年龄、肿瘤部位、病理类型、TNM分期、微卫星稳定性情况结直肠癌患者结直肠癌组织中α-SMA的表达情况比较,差异均无统计学意义(P>0.05)。(图1、表1)

图1 α-SMA 在结直肠癌组织CAF 中的表达情况(免疫组化染色,×400)

表1 不同临床特征结直肠癌患者结直肠癌组织中α-SMA蛋白的表达情况(n=103)
2.2 α-SMA 蛋白表达与结直肠癌患者无病生存情况的关系
截至随访结束,78例α-SMA低表达患者中有25例患者进展,3年累积无病生存率为74.4%;25例α-SMA高表达的患者中有12例患者进展,3年累积无病生存率为52.0%。α-SMA低表达结直肠癌患者的无病生存结局优于α-SMA高表达的患者(χ2=4.513,P<0.05)(图2)。
截至随访结束,亚组分析结果显示,TNM分期为Ⅱ期的结直肠癌患者中,α-SMA高表达患者的3年累积无病生存率为74.1%,α-SMA低表达患者的3年累积无病生存率为75.0%,差异无统计学意义(P>0.05)(图3)。TNM分期为Ⅲ期的结直肠癌患者中,α-SMA高表达患者的3年累积无病生存率为30.8%,低于α-SMA低表达患者的75.0%,差异有统计学意义(χ2=6.714,P<0.05)(图4)。

图2 α-SMA高表达(n=78)和低表达(n=25)结直肠癌患者的无病生存曲线
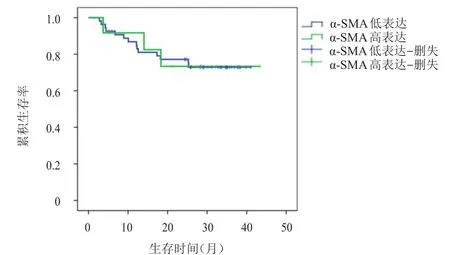
图3 α-SMA高表达Ⅱ期(n=12)和低表达Ⅱ期(n=54)结直肠癌患者的无病生存曲线

图4 α-SMA高表达Ⅲ期(n=13)和低表达Ⅲ期(n=24)结直肠癌患者的无病生存曲线
3 讨论
肿瘤组织中CAF的来源并不十分清楚,可能来源于肿瘤周围正常组织中固有的成纤维细胞,也可能来源于循环组织或周围组织中的间充质干细胞[5-6]。结直肠癌组织中存在大量的CAF,CAF可分泌大量的生长因子,如上皮生长因子、肝细胞生长因子和VEGF等,从而激活促分裂原活化的蛋白激酶(mitogen-activated protein kinase,MAPK)和磷酸肌醇 3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶 B(protein kinase B,PKB,又称AKT)信号通路,从而促进结直肠癌细胞的增殖,提供结直肠癌细胞生长代谢所需要的物质,诱导肿瘤血管生成和抑制性免疫细胞归巢,形成有利于肿瘤生长的微环境,促进结直肠癌细胞的侵袭、转移等[7-12]。因此,CAF与结直肠癌的进展和转移关系密切,可能成为结直肠癌治疗的新靶点。
α-SMA高表达是CAF的主要特征之一,与实体瘤患者的预后不良有关[13]。Tsujino等[14]研究发现,α-SMA高表达、淋巴结转移均是结直肠癌患者术后复发的独立危险因素。Valcz等[15]研究发现,肿瘤细胞中E-钙黏蛋白与α-SMA的表达呈负相关[15],E-钙黏蛋白是上皮细胞的重要标志物,其表达下调可能是CAF促进了肿瘤细胞从上皮样细胞向间质样细胞转化的结果。肿瘤细胞发生上皮间充质转化是肿瘤转移的重要因素,因此,CAF可能通过促进肿瘤上皮间充质转化,从而促进肿瘤细胞的转移。Ikuta等[16]研究发现,α-SMA高表达、胶原沉积是Ⅲ期结直肠癌患者预后较差的分子生物学标志。上述研究结果均与本研究结果存在类似之处。本研究结果显示,在手术可切除的结直肠癌患者中,α-SMA低表达结直肠癌患者的无病生存结局优于α-SMA高表达的患者(P<0.05),且α-SMA高表达Ⅲ期结直肠癌患者的3年累积无病生存率低于α-SMA低表达的Ⅲ期结直肠癌患者。α-SMA的表达水平与Ⅱ期结直肠癌患者的无病生存情况无关,这可能是因为Ⅱ期结直肠癌患者的预后本来就好的缘故。另外,结直肠癌组织中α-SMA的表达水平与患者的性别、年龄、肿瘤部位、病理类型、TNM分期和微卫星稳定性情况均可能无关,从而证明CAF的存在在不同结直肠癌患者群体中可能无明显差异。但是,α-SMA在Ⅲ期结直肠癌患者中的高表达率为35.1%,高于Ⅱ期结直肠癌患者的18.2%,但差异无统计学意义(P>0.05),分析其原因可能与本研究纳入的病例数较少有关。CAF在恶性肿瘤组织中普遍存在,除了α-SMA是CAF的标志物外,成纤维细胞活化蛋白和波形蛋白等也是CAF的标志物。本研究仅选择了α-SMA作为CAF的标志物,可能不足以代表全部的CAF群体。另外本研究仅仅说明了在结直肠癌组织中CAF较多的患者的预后更差,但是对CAF促进结直肠癌进展的机制并未揭示,且CAF和结直肠癌细胞之间的相互作用仍需进一步研究。
综上所述,α-SMA低表达结直肠癌患者的无病生存结局优于α-SMA高表达的患者,且不同α-SMA表达情况的Ⅲ期结直肠癌患者无病生存结局的差异更为显著,而不同α-SMA表达情况的Ⅱ期结直肠癌患者的无病生存结局无差异。α-SMA可能作为结直肠癌治疗选择和预后预测的分子生物学标志物,而CAF有可能成为结直肠癌治疗的新靶点。

