HLA-G 在卵巢癌中的表达及对卵巢癌细胞生物学行为的影响
唐努尔·阿不力米提,帕提曼·米吉提,张璐,古扎丽努尔·阿布力孜
新疆医科大学附属肿瘤医院妇外科五科,乌鲁木齐 830054
卵巢癌是常见的妇科恶性肿瘤之一,发病率呈逐年上升趋势。目前由于卵巢癌发病隐匿,又缺乏有效的早期诊断技术,导致卵巢癌患者病死率居高不下[1-3]。由于卵巢癌恶性程度高、早期易转移,超过70%患者就诊时均已处于晚期,导致手术后复发率高,5年生存率低[2,4-5]。因此探寻卵巢癌的发病机制,寻找有效的治疗方案和提高患者生活质已成为医务工作者面临的重大挑战。人类白细胞抗原-G(human leukocyte antigen-G,HLA-G)是机体内一个重要的免疫耐受分子。HLA-G可通过与受体结合直接抑制多种免疫活性细胞的生物学功能,或通过诱导产生免疫调节细胞间接抑制机体的免疫应答。HLA-G在恶性肿瘤患者血浆中表达水平明显升高,肿瘤细胞表达HLA-G被认为是其逃避宿主细胞免疫监视策略的主要途径[6-8]。研究显示,HLA-G在卵巢癌及卵巢癌细胞中高表达[6,9-11],但HLA-G在卵巢癌的发生发展过程中的作用机制研究较少,本研究探讨HLA-G在卵巢癌中的表达及对卵巢癌细胞生物学行为的影响,以期为临床中及时筛查卵巢癌发挥重要作用,现报道如下。
1 资料与方法
1.1 一般资料
选取2010年1月至2014年12月新疆医科大学附属肿瘤医院收治的卵巢癌患者。所有患者术前均未进行放、化疗及生物治疗等。本研究共纳入70例卵巢癌患者,≤50岁36例,>50岁34例;病理类型:浆液性卵巢癌25例,黏液性卵巢癌17例,卵巢子宫内膜样癌15例,透明细胞癌13例;分化程度:高分化20例,中分化17例,低分化33例。按2009年国际妇产科联盟分期[12]:Ⅰ期17例,Ⅱ期15例,Ⅲ期20例,Ⅳ期18例;淋巴结转移33例。收集卵巢癌患者的上皮性卵巢癌组织70例。另外,选取同期于新疆医科大学附属肿瘤医院因子宫肌瘤行全子宫及双附件手术治疗的40例正常卵巢组织。所有标本均经病理及影像学确诊。
1.2 细胞、试剂及仪器
鼠抗人HLA-G单克隆抗体购自英国Serotec公司,ElivisionTM plus免疫组织化学试剂盒购自上海堃吉实业有限公司。卵巢癌SKOV-3细胞购自中国科学院上海细胞库。四甲基偶氮唑盐(MTT)、胎牛血清(FBS)、DMEM培养基均购自美国Gibco公司;LipofectamineTM3000购自美国Invitrogen公司;pcDNA3.1 HLA-G真核表达载体及空白质粒pcDNA3.1购自广州锐博生物技术有限公司;MK3酶标仪购自美国Thermo公司;Chemi-DocTM XRS凝胶成像系统购自美国伯乐公司。
1.3 免疫组织化学法检测及结果评价
采用免疫组织化学法检测HLA-G的表达情况。取上皮性卵巢癌组织和正常卵巢组织切片后行常规脱水,于二甲苯Ⅰ,二甲苯Ⅱ各浸泡10 min,置于枸橼酸钠缓冲液中热修复抗原。3%H2O2溶液中消除内源性的过氧化物酶。一抗孵育4℃过夜,二抗37℃孵育。二氨基联苯胺显色,并用蒸馏水冲洗终止显色。苏木素复染,梯度乙醇脱水、二甲苯透明,中性树胶封片并镜检。
光镜下观察结果,在细胞膜上和细胞浆内出现棕黄色或黄色颗粒样反应物为HLA-G阳性结果。每张切片随机选择10个视野,根据着色强度及范围综合评分。根据着色强度进行评分:0分,无着色;1分,淡黄色;2分,棕黄色;3分,棕褐色。根据阳性细胞所占比例进行评分:<10%为0分,10%~24%为1分,25%~49%为2分,50%~74%为3分,≥75%为4分。着色强度与阳性细胞所占比例得分之积≥3分为阳性,0~2分为阴性。所有标本均经一位病理副主任医师诊断和一位病理主任医师审核。
1.4 细胞培养及转染
将SKOV-3细胞接种于含10%FBS的高糖DMEM培养基中,于37℃、5%CO2培养箱中培养。
当SKOV-3细胞融合度达到50%时候,利用LipofectamineTM3000脂质体将pcDNA3.1 HLA-G真核表达载体及空白质粒pcDNA3.1转染到SKOV-3细胞中,分别记为过表达组和对照组,同时设立不转染任何物质的空白组,6 h后换液。
1.5 蛋白质印迹法(Western blot)
采用Western blot法检测过表达组、对照组和空白组细胞的HLA-G表达。裂解液提取3组细胞的总蛋白,参照标准裂解蛋白曲线来测定蛋白的浓度。取3组变性蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,湿法转膜后2%牛血清白蛋白室温下孵育1 h。加入鼠抗人HLA-G单克隆抗体4℃过夜,加入二抗工作液,室温下摇床中孵育2 h后,加入碱性磷酸酶显色剂20 min。扫描仪扫描条带的灰度,自动图像分析系统进行定量分析,以空白组细胞蛋白的光密度值为参考标准1,过表达组和对照组细胞中目的蛋白与空白组细胞蛋白光密度值比值作为各蛋白的相对表达量。
1.6 MTT 法检测细胞活力
将过表达组、对照组和空白组细胞接种到96孔板,于37℃、5%CO2培养箱培养24 h后,加入MTT孵育4 h,舍弃上清液,再加入150 μl的二甲基亚砜,振荡使结晶物溶解,于酶标仪上测定OD560nm值。
1.7 Transwell法检测细胞迁移和侵袭能力
将Transwell小室放入6孔板中,将过表达组、对照组和空白组细胞用胰蛋白酶消化成单细胞悬液接种于Transwell小室上,6孔板中不接种细胞加入10%FBS的高糖DMEM培养基,培养48 h后,将小室取出来,多聚甲醛固定细胞,结晶紫染色,最后在倒置显微镜下观察并取5个视野中的细胞进行计数,取平均值。
将Transwell小室放入6孔板中,Matrigel胶平铺于Transwell小室上,将过表达组、对照组和空白组细胞接种于平铺Matrigel胶的Transwell小室上,于37℃、5%CO2培养箱培养24 h后,加入MTT孵育4 h,舍弃上清液,再加入150 μl的二甲基亚砜,振荡使结晶物溶解,在倒置显微镜下观察并取5个视野中的细胞进行计数,取平均值。
1.8 统计学方法
采用SPSS 17.0统计软件对数据进行分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;组间比较采用独立样本t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 HLA-G阳性表达率比较
上皮性卵巢癌组织中HLA-G阳性表达率为82.86%(58/70),明显高于正常卵巢组织的10.00%(4/40),差异有统计学意义(χ2=54.937,P<0.01)。
2.2 不同临床特征卵巢癌患者上皮性卵巢癌组织中HLA-G表达水平的比较
低分化、Ⅲ~Ⅳ期和有淋巴结转移卵巢癌患者的上皮性卵巢癌组织中HLA-G阳性表达率分别明显高于中高分化、Ⅰ~Ⅱ期和无淋巴结转移的患者,差异均有统计学意义(P<0.01)。不同年龄和病理类型的卵巢癌患者上皮性卵巢癌组织中HLA-G阳性表达率比较,差异均无统计学意义(P>0.05)。(表1)
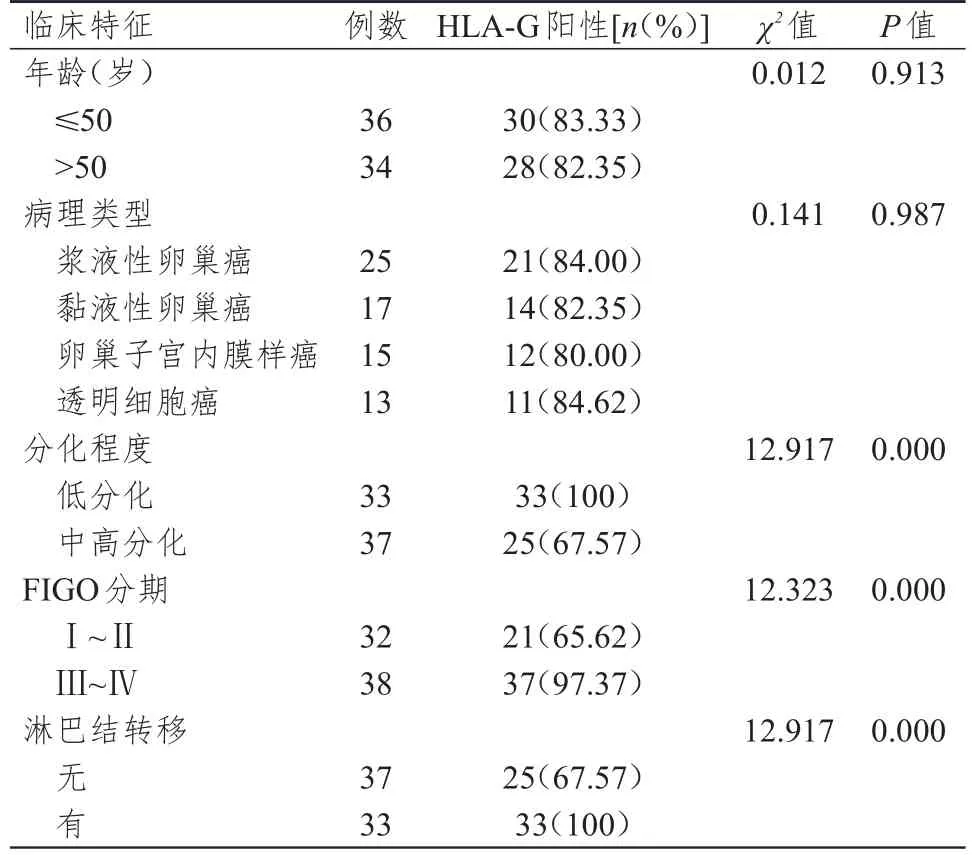
表1 不同临床特征卵巢癌患者上皮性卵巢癌组织中HLA-G表达水平的比较
2.3 HLA-G蛋白相对表达量的比较
过表达组细胞的HLA-G蛋白相对表达量为(2.48±0.25),明显高于对照组和空白组细胞的(0.88±0.09)和(0.89±0.09),差异有统计学意义(F=323.266,P<0.01)。
2.4 细胞活力、细胞迁移及侵袭数目的比较
过表达组、对照组及空白组细胞的细胞活力、细胞迁移及侵袭数目的比较,差异均有统计学意义(P<0.01);过表达组细胞的细胞活力、细胞迁移及侵袭数目均明显高于对照组和空白组细胞,差异均有统计学意义(P<0.01)。(表2)
表2 3组细胞的细胞活力、细胞迁移及侵袭数目的比较(±s)

表2 3组细胞的细胞活力、细胞迁移及侵袭数目的比较(±s)
注:a与空白组比较,P<0.01;b与对照组比较,P<0.01
组别 细胞活力 细胞迁移数目 细胞侵袭数目空白组对照组过表达组F值P值0.55±0.06 0.55±0.06 0.75±0.08a b 31.819 0.000 125.35±12.39 126.49±13.27 165.34±16.45a b 25.908 0.000 185.32±19.23 186.24±18.97 253.21±25.32a b 33.175 0.000
3 讨论
HLA-G主要分布于胎盘滋养细胞、血管内皮、角膜、胸腺等健康组织或细胞表面。目前,研究认为HLA-G与自然杀伤细胞(natural killer cell,NK)及细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)的抑制性受体结合,抑制NK及CTL细胞的杀伤作用;也可通过提高肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)及白细胞介素-10(interleukin-10,IL-10)等细胞因子表达进而调控细胞免疫应答作用,从而使肿瘤细胞免受宿主免疫细胞的识别,从而逃逸抗肿瘤免疫反应[6,8]。自1998年在黑色素瘤中发现了HLA-G的存在后,随着研究的进展发现HLA-G在宫颈癌、胃癌、乳腺癌、卵巢癌等十几种肿瘤组织中高表达[6,8]。Singer等[10]研究发现74例卵巢癌晚期患者中有45例患者中表达HLA-G抗原,进一步研究发现有45例患者腹腔积液、33例患者原发灶、59例患者实体转移灶均检测到HLA-G的表达。本研究免疫组化法结果显示,上皮性卵巢癌组织中HLA-G阳性表达率明显高于正常卵巢组织(P<0.01),与以往研究一致结果[3,10]。低分化、Ⅲ~Ⅳ期和有淋巴结转移卵巢癌患者的上皮性卵巢癌组织中HLA-G阳性表达率分别高于中高分化、Ⅰ~Ⅱ期和无淋巴结转移的患者(P<0.01),与卵巢癌患者的年龄及病理类型无关。Jung等[13]采用免疫组织化学法、Western blot及逆转录-聚合酶链式反应检测了41例卵巢癌组织及8例正常卵巢组织中HLA-G的表达,研究表明晚期卵巢癌组织中HLAG蛋白相对表达量明显高于正常卵巢组织及早期卵巢癌组织,而且HLA-G阳性患者具有较差的预后。Andersson等[14]研究表明HLA-G在转移性肿瘤细胞中的表达量高于原发性肿瘤。从而说明HLA-G相对表达量越高的上皮性卵巢癌组织的恶性程度越高,并伴有转移性,患者预后较差。
本研究进一步探讨HLA-G对卵巢癌细胞的增殖、迁移及侵袭能力的影响,通过脂质体转染pcDNA3.1 HLA-G到SKOV-3细胞中记为过表达组,同时设立对照组和空白组细胞,通过Western blot结果表明过表达组细胞的HLA-G蛋白相对表达量明显高于对照组和空白组细胞(P<0.01),提示细胞转染成功。进一步对3组细胞进行细胞活力、细胞迁移及侵袭能力的比较,结果表明过表达组细胞的细胞活力、细胞迁移及侵袭数目均明显高于对照组和空白组细胞(P<0.01),表明HLA-G可促进卵巢癌细胞增殖、迁移和侵袭的能力。
综上所述,HLA-G在上皮性卵巢癌组织中高表达提示卵巢癌分化程度低、FIGO分期高及有淋巴结转移,HLA-G的高表达能促进卵巢癌细胞的增殖、迁移及侵袭能力。

