阿帕替尼联合S-TACE 治疗中晚期原发性肝癌的疗效及安全性评价△
翁志成,彭建扬,吴伟达,张春生,林群,潘喜鹏
福建莆田学院附属医院介入科,福建 莆田 351100
近年来,原发性肝癌的发病率及病死率均呈逐年上升趋势,原发性肝癌的病死率较高,已高居肿瘤死因的第二位。作为肝病高发国家,中国每年的肝癌新发病例数和死亡病例数均占全球50%以上,并且呈年轻化趋势[1]。中晚期原发性肝癌患者多已失去手术切除的机会,局部疗法是目前临床治疗中晚期原发性肝癌的主要手段,其中以超选择性肝动脉化疗栓塞术(super-selection transcatheter arterial chemoembolization,S-TACE)最为多见[2]。S-TACE不仅安全性高,而且创伤小,但S-TACE术后会形成缺氧环境,促使肿瘤细胞因子、肿瘤刺激因子、血管内皮生长因子表达异常增加,导致内皮细胞增殖、血管新生,可使代偿性侧支循环出现,导致病灶组织转移风险、复发概率增加,不利于患者术后病情转归,因此如果在栓塞治疗的同时加用抗血管生成药物治疗,可以为患者带来良好的治疗效果[3]。阿帕替尼为小分子类型的抗血管生成靶向药物,具有抗癌范围广的特征。因此,本研究分析了阿帕替尼联合S-TACE治疗中晚期原发性肝癌患者的疗效、安全性及对血清基质金属蛋白酶(matrix metalloproteinase,MMP)表达水平的影响,现报道如下。
1 对象与方法
1.1 研究对象
选取2015年12月至2017年2月福建莆田学院附属医院收治的70例中晚期原发性肝癌患者。纳入标准:①处于疾病中晚期,经检查后确诊;②预计生存期>3个月;③入组前未曾接受过介入治疗、放射治疗或化学治疗等抗肿瘤治疗;④意识及精神状态均正常。排除标准:①存在化疗禁忌或S-TACE禁忌;②合并凝血功能障碍;③存在活动性出血问题;④合并其他类型肿瘤;⑤过敏体质。根据随机数字表法将患者随机分为观察组和对照组,每组35例。对照组中,男25例,女10例;年龄36~75岁,平均(52.26±3.19)岁;肿瘤直径4.0~7.9 cm,平均(5.63±0.50)cm;巴塞罗那分期:B期23例,C期12例。观察组中,男26例,女9例;年龄35~74岁,平均(51.77±2.90)岁;肿瘤直径4.0~8.1 cm,平均(5.70±0.49)cm;巴塞罗那分期:B期24例,C期11例。两组患者的性别、年龄、肿瘤直径、巴塞罗那分期比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审核批准,患者及其家属均对本研究知情并签署知情同意书。
1.2 治疗方法
对照组给予S-TACE治疗,具体方法:①建立静脉通路,患者取仰卧位,定位右股动脉后,以改良Seldinger法予以穿刺。②将动脉鞘、导管妥善置入,予以肝动脉造影、侧支供血动脉造影,通过造影观察病灶组织位置、数量、血管特征以及病灶组织大小等信息。③于微导丝的引导下,将2.3 F型微导管超选择性置入患者病灶动脉中,将适量碘化油乳剂缓慢注入,碘化油乳剂包含碘化油、奥沙利铂、5-氟尿嘧啶及吡柔比星,再结合造影结果选择适合患者的栓塞剂。④以明胶海绵颗粒进行栓塞,对门静脉的小分支进行观察,达到局部显影状态时,表明栓塞已结束,于结束前给予再次造影,重点观察肿瘤组织中是否存在血供,确定无血供后,可结束栓塞。⑤给予穿刺点常规包扎,以防持续出血。
观察组患者在对照组S-TACE治疗的基础上联合阿帕替尼治疗,阿帕替尼治疗方法:①于术后1天起服用500 mg阿帕替尼,每天1次,餐后30 min用药,观察周期为1个周期,28天为1个周期。②用药期间,若患者出现手足综合征、白细胞计数降低、蛋白尿、粒细胞降低、高血压或血小板降低等不良反应,需暂停用药,待患者不适症状消失、缓解后,再以原剂量继续用药,暂停用药时间通常在14天内,如果停药14天后不适症状仍然存在,需将阿帕替尼口服剂量调整至250 mg,每天1次,若不适症状始终未能消失,酌情停药。
1.3 观察指标及评价标准
采用修正的实体瘤疗效评价标准(modified response evaluation criteria in solid tumor,mRECIST)[4]对两组患者治疗1个周期后的临床疗效进行评价:完全缓解(CR),经影像学专业检查,结果显示动脉期未出现靶病灶强化征;部分缓解(PR),经影像学专业检查,结果显示动脉期的靶病灶组织无强化,病灶直径之和已缩小30%及以上;疾病稳定(SD),经影像学专业检查,结果显示病灶直径之和的缩小程度不足30%;疾病进展(PD),经影像学专业检查,结果显示出现新病灶组织。临床获益率=(CR+PR+SD)例数/总例数×100%。
不良反应:治疗后,记录两组患者皮疹、高血压、手足综合征、瘙痒、蛋白尿、发热、乏力、腹痛、腹泻及恶心呕吐的发生情况。
血清学指标:抽取两组患者治疗前及疗程结束后次日的空腹静脉血4 ml,常规离心后提取上清液;采用酶联免疫吸附法对MMP-2、MMP-9、MMP-11、血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)的表达水平进行检测。
1.4 统计学分析
采用SPSS 18.0软件对数据进行分析;计数资料以例数和率(%)表示,组间比较采用χ2检验;符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效的比较
观察组患者治疗后的临床获益率为65.71%(23/35),明显高于对照组的34.29%(12/35),差异有统计学意义(χ2=6.914,P<0.01)。(表1)
2.2 不良反应发生率的比较
治疗后,观察组患者皮疹、高血压、手足综合征、蛋白尿的发生率均高于对照组,差异均有统计学意义(P<0.05);两组患者瘙痒、发热、乏力、腹痛、腹泻、恶心呕吐的发生率比较,差异均无统计学意义(P>0.05);两组患者的上述不良反应均在给予对症处理后得到缓解。(表2)
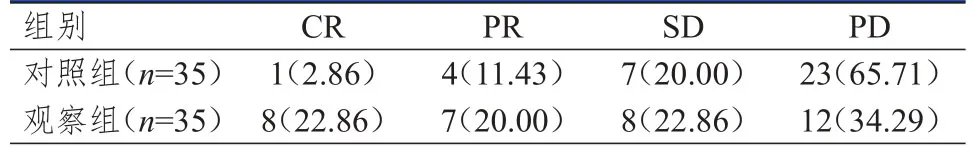
表1 两组患者的临床疗效[n(%)]*
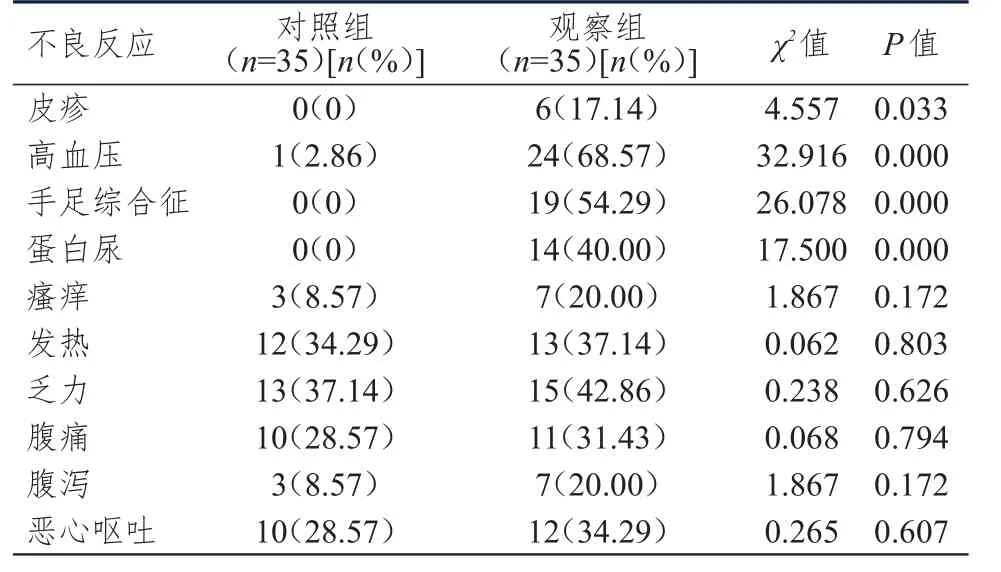
表2 两组患者不良反应发生情况的比较
2.3 血清学指标的比较
治疗前,两组患者的血清MMP-2、MMP-9、MMP-11、VEGFR2表达水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者的血清MMP-2、MMP-9、MMP-11、VEGFR2表达水平均较本组治疗前降低,且观察组患者的血清MMP-2、MMP-9、MMP-11、VEGFR2表达水平均低于对照组,差异均有统计学意义(P<0.05)。(表3)
表3 两组患者治疗前后血清MMP、VEGFR2表达水平的比较(±s)
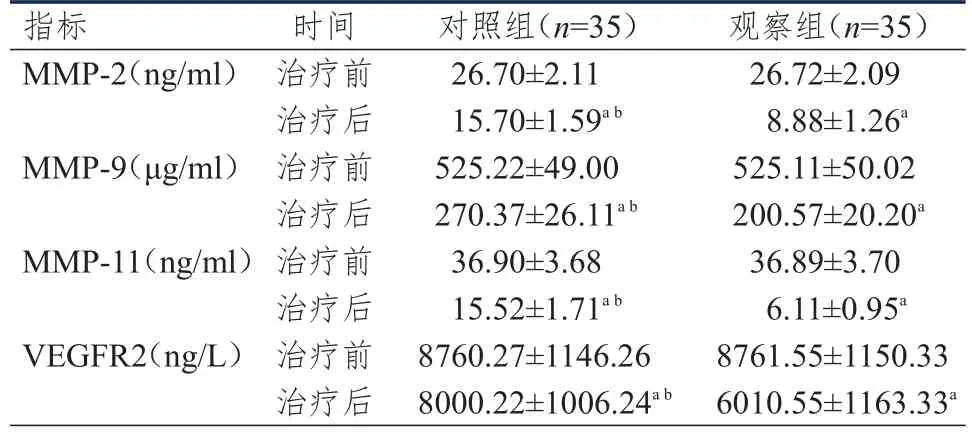
表3 两组患者治疗前后血清MMP、VEGFR2表达水平的比较(±s)
注:a与本组治疗前比较,P<0.05;b与观察组治疗后比较,P<0.05
指标MMP-2(ng/ml)MMP-9(μg/ml)MMP-11(ng/ml)VEGFR2(ng/L)时间治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后对照组(n=35)26.70±2.11 15.70±1.59a b 525.22±49.00 270.37±26.11a b 36.90±3.68 15.52±1.71a b 8760.27±1146.26 8000.22±1006.24a b观察组(n=35)26.72±2.09 8.88±1.26a 525.11±50.02 200.57±20.20a 36.89±3.70 6.11±0.95a 8761.55±1150.33 6010.55±1163.33a
3 讨论
原发性肝癌具有治疗难度大、转归难度大等特征,其发病机制、发病原因等均未能确定,且疾病确诊时,多已处于中晚期阶段,加大了治疗难度[5]。S-TACE属于微创治疗疗法,术后患者病灶组织微环境会长时间处于缺氧、缺血状态,受MMP因子、血管内皮生长因子影响,肿瘤组织新生血管出现风险升高,致使病灶组织出现进展问题和复发现象[6-7]。阿帕替尼属于酪氨酸激酶抑制剂,已在多种恶性肿瘤专业治疗中得到应用。
薄雪萍等[8]以S-TACE联合热疗的形式治疗原发性肝癌,结果发现患者的卡氏功能状态评分升高,不良反应减少。宋锦添等[9]采用阿帕替尼治疗晚期原发性肝癌患者,结果发现患者的客观缓解率为18.86%,疾病控制率为56.6%,尽管有不良反应出现,但患者多能耐受。本研究结果显示,观察组患者的临床获益率为65.71%,高于对照组患者的34.29%(P<0.05),提示与单纯S-TACE治疗相比,联合阿帕替尼可进一步提升患者临床获益率。针对阿帕替尼的安全性,本研究结果显示,观察组患者皮疹、高血压、手足综合征、蛋白尿的发生率均高于对照组(P<0.05),但对症处理后所有不良反应均缓解,提示阿帕替尼联合S-TACE治疗中晚期原发性肝癌可能会出现不良反应,但是患者的耐受性强。本研究结果还发现,治疗后,观察组患者血清MMP-2、MMP-9、MMP-11、VEGFR2的表达水平均低于对照组,提示阿帕替尼联合STACE治疗可降低患者血清MMP、VEGFR2的表达水平。
阿帕替尼为当前中晚期胃癌患者接受标准化疗且失败后进行治疗的靶向药物,为口服制剂类药物;相关研究表明,阿帕替尼对于中晚期胃癌患者生存质量起着改善作用,还能延长患者的生存时间,通过对VEGFR2的活性产生高度抑制作用,防止与血管内皮细胞生长因子受体大量结合,以控制新生血管出现[10-11]。S-TACE法通过对栓塞剂以及化疗药物进行混合形成乳剂形式,以S-TACE为途径注入中晚期原发性肝癌患者病灶组织供血动脉中,使病灶组织供血受阻,形成缺氧、缺血状态,从而有效杀灭病灶组织,防止其持续生长。张雄杰和丁佑铭[12]研究发现,MMP参与了原发性肝癌患者肿瘤细胞的侵袭、转移过程,且血清MMP表达与患者病灶组织的恶性程度呈正相关。而阿帕替尼联合S-TACE治疗中晚期原发性肝癌时,通过发挥协同作用对术后缺氧、缺血环境产生改善作用,在防止血管新生的基础上,促使患者疗效提升,从而提高其临床获益率[13-14]。不仅如此,尽管阿帕替尼会对患者肾小球的通透性、血管的舒张能力产生影响,致使皮疹、高血压、手足综合征以及蛋白尿等不良反应出现,但上述症状较轻,且对其进行对症处理后,相关症状消失,表明阿帕替尼联合S-TACE治疗的安全性有保障[15]。同时,阿帕替尼联合S-TACE治疗可对病灶组织产生抑制作用,通过对胃癌细胞中血管内皮生长因子自分泌进行充分抑制,防止肺癌移植瘤持续生长,从而降低血清MMP表达。此外,阿帕替尼联合S-TACE治疗可对VEGFR2的ATP结合位点产生高度竞争性的抑制作用,并对c-SRC、c-KIT及Ret信号转导产生阻断作用,在防止肿瘤血管持续生成的基础上,降低VEGFR2水平。
综上所述,阿帕替尼联合S-TACE治疗中晚期原发性肝癌有助于提高临床获益率,降低血清MMP及VEGFR2的表达水平,且安全性有保障。但本研究缺乏大样本数据,且随访时间短,因此尚需进一步扩大样本量并延长随访时间,以探讨阿帕替尼联合S-TACE治疗中晚期原发性肝癌的临床价值。
——评《卵巢恶性肿瘤诊疗手册》

