4种常见消化道肿瘤术后感染的危险因素分析
贾启明,刘畅,周东民,张涛
1郑州大学附属肿瘤医院ICU,郑州 450000
2郑州市中心医院心血管内科,郑州 450000
多年来,消化道肿瘤一直在世界范围内呈高发态势,十大高发病率肿瘤中有5种来自消化道[1]。中国每年消化道肿瘤新发病例约150万例,死亡病例约100万例[2]。目前消化道肿瘤的主要治疗方法仍是手术治疗。有研究指出,肿瘤患者术后感染可导致二次住院治疗甚至二次手术,严重的感染甚至会直接导致患者死亡[3-4]。Jenks等[5]研究指出,肿瘤患者术后感染会增加较多的医疗费用。然而,国内综合报道和分析消化道肿瘤患者术后感染的文献较少。本研究分析了4种常见消化道肿瘤(食管癌、胃癌、结肠癌及直肠癌)患者的术后感染情况及其危险因素,以期为消化道肿瘤患者的临床治疗和术后护理提供参考,现报道如下。
1 资料与方法
1.1 一般资料
选择2017年7月至2018年4月在郑州大学附属肿瘤医院接受手术治疗的消化道肿瘤患者。纳入标准:经术后病理检查确诊为食管癌、胃癌、结肠癌或直肠癌。排除标准:①入院时已发生未能控制的严重感染;②卡氏功能状态评分<70分;③合并其他未能控制的严重疾病。根据纳入和排除标准,本研究共纳入512例患者,其中,食管癌患者192例,胃癌患者109例,结肠癌患者116例,直肠癌患者95例;男305例,女207例;年龄为37~79岁,平均年龄为(58.25±12.76)岁。食管癌患者中,Ⅰ期36例,Ⅱ期59例,Ⅲ期62例,Ⅳ期35例;胃癌患者中,Ⅰ期13例,Ⅱ期15例,Ⅲ期39例,Ⅳ期42例;结肠癌患者中,Ⅰ期19例,Ⅱ期41例,Ⅲ期39例,Ⅳ期17例;直肠癌患者中,Ⅰ期23例,Ⅱ期23例,Ⅲ期36例,Ⅳ期13例。
1.2 观察指标
观察患者的临床资料,包括感染部位、性别、年龄、肿瘤部位、TNM分期、体重指数(body mass index,BMI)、手术方式、手术时间、住院时间、术前血清白蛋白(albumin,ALB)水平、合并糖尿病情况、美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级及合并糖尿病患者围手术期血糖控制情况。
1.3 诊断标准
感染的诊断标准参考《基层医疗机构医院感染管理基本要求》[6]。ASA分级标准[7]:Ⅰ级为体格健康,发育、营养良好,各器官功能正常;Ⅱ级为除肿瘤外,有轻度并存病,功能代偿健全;Ⅲ级为并存病较严重,体力活动受限,但尚能应付日常活动。卡氏功能状态评分[8]:无症状和体征为100分;能进行正常活动,有轻微症状和体征为90分;可勉强进行正常活动,有一些症状或体征为80分;生活能自理,但不能维持正常生活和工作为70分;生活可大部分自理,但偶尔需要别人帮助为60分;生活不能完全自理,常需要人照顾和帮助为50分;生活不能自理,需要特别照顾和帮助为40分;生活严重不能自理为30分;病重,需要住院和积极的支持治疗为20分;病危,临近死亡为10分。BMI=体重(kg)/身高(m)2。合并糖尿病患者围手术期空腹血糖水平控制目标为<10.0 mmol/L,围手术期每次空腹血糖均<10.0 mmol/L即为围手术期血糖控制达标,否则为不达标。
1.4 统计学方法
采用SPSS 19.0软件对数据进行统计分析,符合正态分布的计量资料以均数±标准差(±s)表示;计数资料以例数和率(%)表示,组间比较采用χ2检验;采用Logistic回归模型分析肿瘤患者术后感染的影响因素。以P<0.05为差异有统计学意义。
2 结果
2.1 各类型肿瘤患者的感染情况
所有肿瘤患者的术后感染率为13.48%(69/512),其中食管癌、胃癌、结肠癌和直肠癌患者的术后感染率分别为 12.50%(24/192)、11.01%(12/109)、13.79%(16/116)和17.89%(17/95)。手术部位感染率和肺部感染率分别为6.05%(31/512)和4.30%(22/512),均高于其他感染的发生率。(表1)
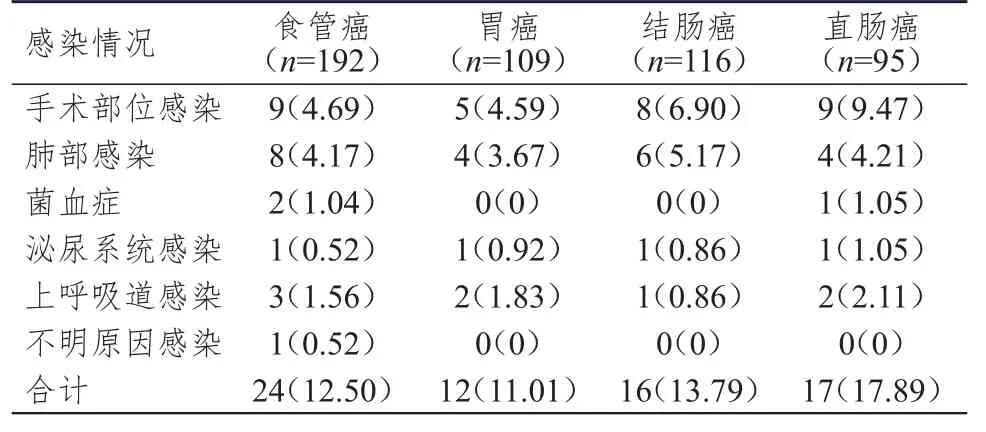
表1 各类型肿瘤患者的感染情况[n=512,n(%)]
2.2 消化道肿瘤患者术后感染率影响因素的单因素分析
不同性别、年龄、肿瘤部位、手术方式、住院时间的消化道肿瘤患者的术后感染率比较,差异均无统计学意义(P>0.05);TNM分期为Ⅲ~Ⅳ期、BMI≥24 kg/m2、手术时间≥3 h、术前血清 ALB<35 g/L、合并糖尿病、ASA分级为Ⅱ~Ⅲ级的消化道肿瘤患者的术后感染率均高于TNM分期为Ⅰ~Ⅱ期、BMI<24 kg/m2、手术时间<3 h、术前血清ALB≥35 g/L、未合并糖尿病、ASA分级为Ⅰ级的患者,差异均有统计学意义(P<0.05)。(表2)
2.3 消化道肿瘤患者术后感染率影响因素的多因素分析
Logistic回归分析结果显示,BMI≥24 kg/m2、手术时间≥3 h、术前血清ALB<35 g/L及合并糖尿病均是消化道肿瘤患者术后感染的独立危险因素(P<0.05)。(表3)
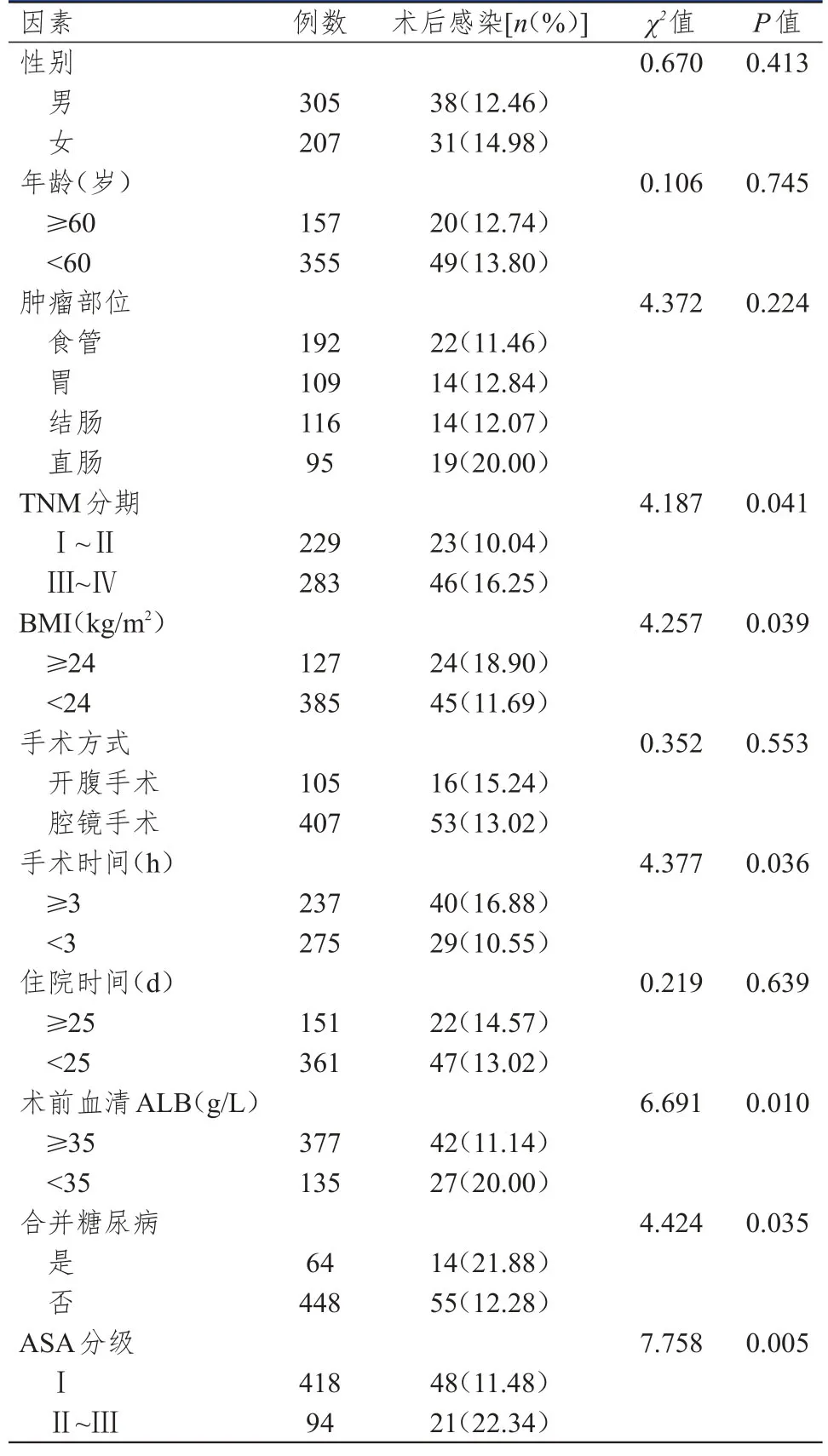
表2 消化道肿瘤患者术后感染率影响因素的单因素分析(n=512)
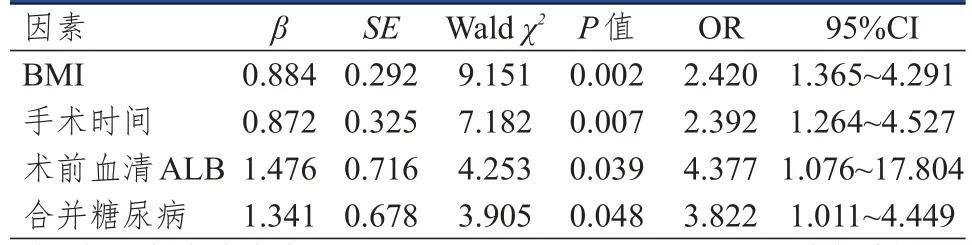
表3 消化道肿瘤患者术后感染率影响因素的多因素分析(n=512)
2.4 围手术期空腹血糖控制情况与术后感染的关系
64例消化道肿瘤患者合并糖尿病,均于围手术期控制空腹血糖。空腹血糖控制不达标患者的术后感染率为33.33%(11/33),明显高于空腹血糖控制达标患者的9.68%(3/31),差异有统计学意义(χ2=5.234,P<0.01)。
3 讨论
术后感染不仅是肿瘤患者进行后续放化疗的严重障碍,还是导致住院时间延长和治疗费用增加的重要原因[9-10]。因此,预防术后感染一直是外科医师重点关注的问题之一。消化道肿瘤的发病率较高,但中国关于消化道肿瘤术后感染影响因素的研究较少[11]。
Lee等[12]研究指出,肿瘤患者术后感染主要为手术部位感染,与本研究结果一致。本研究的512例消化道肿瘤患者中,69例发生术后感染,术后感染率为13.48%,其中手术部位感染率和肺部感染率分别为6.05%和4.30%,均高于其他感染的发生率,与既往文献报道结果基本一致[13-14]。本研究还统计了不同肿瘤不同感染部位的感染率,发现不同消化道肿瘤各部位感染率均以手术部位感染和肺部感染居多。
有研究指出,空气中平均每小时有5×104个细菌落到手术区域[15]。因此,手术时间越长,手术部位沾染的细菌越多,理论上感染的风险也越大。本研究仅选取了4种最常见、手术时间较接近的肿瘤(食管癌、胃癌、结肠癌、直肠癌)作为研究对象。结果显示,512例患者中,237例患者的手术时间≥3 h,其感染率为16.88%(40/237),高于手术时间<3 h患者的10.55%(29/275),差异有统计学意义(P<0.05);进一步的Logistic回归分析结果显示,手术时间≥3 h是消化道肿瘤患者术后感染的独立危险因素(P<0.05)。笔者认为,手术室环境管理应长期、持续加强,一是要尽量使用缩短手术时间的术式和器械,二是要严格限制进入手术室的人员数量,三是要强化感染控制科的职能,加强对手术室医务人员无菌操作技术的检查和管理,四是要鼓励减少手术污染的创新手段和管理方法[16]。
众所周知,机体健康和免疫力正常是抵御外界感染的关键,当皮肤切开后,正常活化的免疫细胞才能有效吞噬致病菌[17]。研究表明,血清ALB是单核细胞进入组织间隙后正常活化的必要条件,营养不良时,血清ALB水平较低,可诱导单核细胞过早凋亡,减少其进入组织间隙的数量,降低巨噬细胞的活力[18]。本研究结果表明,术前血清ALB<35 g/L是消化道肿瘤患者术后感染的独立危险因素(P<0.05)。因此,为降低消化道肿瘤患者的感染风险,纠正患者营养不良,必要时可给予静脉ALB输注[19]。
《外科手术部位感染的预防指南(2017)》明确了糖尿病患者围手术期血糖控制在10.0 mmol/L以下即可降低术后感染的可能[20]。本研究中,64例消化道肿瘤患者合并糖尿病,均于围手术期控制空腹血糖,其中33例患者的空腹血糖控制不达标,其术后感染率为33.33%(11/33),明显高于空腹血糖控制达标患者的9.68%(3/31),差异有统计学意义(P<0.01)。可能是由于高糖环境更有利于细菌生长繁殖,而长期的血糖未控制者,其物质代谢紊乱,蛋白质合成减少,分解增加,导致免疫细胞活力下降,免疫力降低[21]。本研究的Logistic回归分析结果显示,合并糖尿病是消化道肿瘤患者术后感染的独立危险因素(P<0.05)。提示消化道肿瘤患者合并糖尿病时,围手术期血糖控制在10.0 mmol/L以下仍是十分必要的。
研究表明,肥胖患者的皮下脂肪厚度增加,手术切口部位常发生脂肪液化,形成空腔,造成局部细菌繁殖,延迟伤口愈合[22]。本研究结果显示,BMI≥24 kg/m2是消化道肿瘤患者术后感染的独立危险因素(P<0.05),与上述研究报道一致。本研究的单因素分析结果显示,TNM分期为Ⅲ~Ⅳ期、ASA分级为Ⅱ~Ⅲ级的消化道肿瘤患者的术后感染率高于TNM分期为Ⅰ~Ⅱ期、ASA分级为Ⅰ级的患者(P<0.05),而Logistic回归分析中未将其纳入分析,是由于TNM分期较高及ASA分级较高患者的一般情况较其他患者差,其感染风险本身就较高[23]。
综上所述,BMI高、手术时间长、合并糖尿病、血清ALB水平低的消化道肿瘤患者术后感染的风险较高,临床医师应重点从以上4个方面降低其术后感染率。

