胃癌组织中HTRA1的表达水平及临床意义
王腾,金琳芳,华东
无锡市第四人民医院肿瘤内科,江苏 无锡 214062
胃癌是消化系统常见的一种恶性肿瘤,早期胃癌缺乏特异性临床表现,容易与胃溃疡、胃炎等疾病混淆,具有较高的发病率和病死率,严重威胁着患者的生命安全[1]。尽管目前胃癌的综合治疗方案已不断完善,但是患者的病死率仍未得到明显改善,而复发、转移是导致胃癌患者死亡的重要原因之一。相关研究表明,淋巴结转移和TNM分期等病理特征均能够一定程度反映肿瘤的进展情况,评估患者预后,但是目前临床尚缺乏对胃癌高危人群筛选、诊治的典型标志物[2]。细胞癌变是一个多因素及多阶段过程;近年来研究发现,蛋白酶在细胞癌变过程中具有重要作用,其可以通过降解细胞外基质,参与细胞的迁移及侵袭过程[3]。丝氨酸蛋白酶1(high temperature requirement factor 1,HTRA1)广泛表达于机体组织中;研究表明,HTRA1在宫颈癌等肿瘤中表达缺失或下调,提示其可能具有抑瘤作用[4]。Miyamoto等[5]研究发现,丝氨酸蛋白酶表达降低能够影响卵巢癌患者对化疗药物的细胞毒性作用,引起细胞化疗耐受。还有研究报道,HTRA1表达下调可能与肿瘤患者的不良预后有关[6]。但是,目前关于HTRA1与胃癌关系的系统研究尚缺乏,因而本研究探讨了胃癌组织中HTRA1的表达情况及其临床意义,旨在为胃癌的临床诊治提供参考依据。
1 对象与方法
1.1 研究对象
选取2012年1月至2014年7月于无锡市第四人民医院行根治性手术的胃癌患者。纳入标准:①经临床表现、血液肿瘤标志物检测、影像学检查、病理组织学检查等确诊为胃癌[7];②术前未行放化疗、靶向治疗等抗肿瘤治疗;③未合并其他部位恶性肿瘤;④病历资料完整。排除标准:①合并严重肝肾功能不全;②胃癌复发患者。根据纳入和排除标准,本研究共纳入胃癌患者87例。其中,男52例,女35例;年龄41~72岁,平均(57.85±6.94)岁;肿瘤部位:幽门51例,胃体部25例,贲门11例;分化程度:低分化40例,中高分化47例;幽门螺杆菌(Helicobacter pylori,HP)感染阳性 31例,HP感染阴性 56例;浸润深度:T1~229例,T3~458 例;肿瘤直径:P<5 cm 36例,≥5 cm 51例;有淋巴结转移62例,无淋巴结转移25例;TNM分期:Ⅰ~Ⅱ期18例,Ⅲ期69例。收集所有患者的胃癌组织和癌旁组织(距离肿瘤病灶5 cm以外的正常胃组织)标本,本研究经过医院伦理委员会审核批准。
1.2 免疫组织化学染色法检测不同组织中HTRA1的表达情况
取胃癌患者的胃癌组织和癌旁组织,置于液氮中并转移至-80℃低温箱中保存待用。采用免疫组织化学染色法检测不同组织中HTRA1的表达情况,石蜡标本进行4 μm层厚连续切片,放置70℃KD-PIII型生物组织摊烤片机(购自苏州景通仪器有限公司)中烘烤1.5 h。将切片进行二甲苯脱蜡,并予以100%、90%、80%、70%的梯度乙醇水化。于蒸馏水中漂洗3 min,以磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗3次。于切片中加入3%H2O2去离子水孵育10 min,抑制内源性过氧化物酶活性。以PBS冲洗3次,予以热抗原修复,PBS冲洗3次。于切片中加入适当比例稀释小鼠抗人HTRA1单克隆抗体,放置于4℃冰箱中过夜。以PBS冲洗3次,加入通用性免疫球蛋白G(immunoglobulin G,IgG)抗体-辣根过氧化物酶(horseradish peroxidase,HRP)多聚体,于室温环境下放置30 min。以PBS冲洗3次,于每个切片中加入2滴刚配制的二氨基联苯胺(diaminobenzine,DAB)溶液进行显色,于CX-40显微镜(购自日本Olympus公司)下调控显色时间至阳性物质出现棕黄色时,以自来水冲洗并终止显色反应。取苏木素进行复染,以自来水再次返蓝,梯度乙醇以脱水干燥,二甲苯透明,中性树脂进行封片。免疫组化染色具体步骤参照链霉菌抗生物素蛋白-过氧化酶试剂盒说明书进行。
1.3 免疫组织化学染色法结果判定
HTRA1蛋白表达于细胞核中,阳性表达为细胞内出现棕褐色颗粒。采用双评分半定量法对染色结果进行评价,依据染色强度进行评分:无色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;根据阳性细胞所占比例进行评分:随机选取每张切片的5个高倍镜视野(×400),每个视野计数500个细胞,阳性细胞所占比例≤5%计0分,6%~25%计1分,26%~50%计2分,51%~75%计3分,≥76%计4分。将染色强度评分和阳性细胞所占比例评分的乘积作为最后评分,0分为阴性表达(-),1~4分为弱阳性表达(+),5~8分为中度阳性表达(++),9~12分为强阳性表达(+++)[8],本研究将弱阳性、中度阳性和强阳性表达均归为阳性表达。
1.4 随访
所有胃癌患者均以门诊复诊、电话等方式进行为期5年的随访,以2019年7月30日为截止日期,删失值为研究对象因其他原因死亡或失访,记录随访期间患者的生存情况。
1.5 统计学分析
采用SPSS 18.0软件进行数据分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;采用Kaplan-Meier法绘制生存曲线,生存率的比较采用Log-rank检验;采用Cox风险比例回归模型对胃癌根治术后患者预后的影响因素进行分析。以P<0.05为差异有统计学意义。
2 结果
2.1 HTRA1表达情况的比较
胃癌组织中HTRA1蛋白的阳性表达率为16.1%(14/87),明显低于癌旁组织的85.1%(74/87),差异有统计学意义(χ2=82.770,P<0.01)。(表1)

表1 HTRA1在胃癌组织和癌旁组织中的表达情况[n(%)]
2.2 胃癌组织中HTRA1表达与胃癌患者临床特征的关系
不同性别、年龄、肿瘤部位、分化程度、HP感染情况胃癌患者胃癌组织中HTRA1的阳性表达率比较,差异均无统计学意义(P>0.05);浸润深度为T3~4、肿瘤直径≥5 cm、有淋巴结转移、TNM分期为Ⅲ期胃癌患者胃癌组织中HTRA1的阳性表达率分别低于浸润深度为T1~2、肿瘤直径<5 cm、无淋巴结转移、TNM分期为Ⅰ~Ⅱ期的患者,差异均有统计学意义(P<0.05)。(表2)
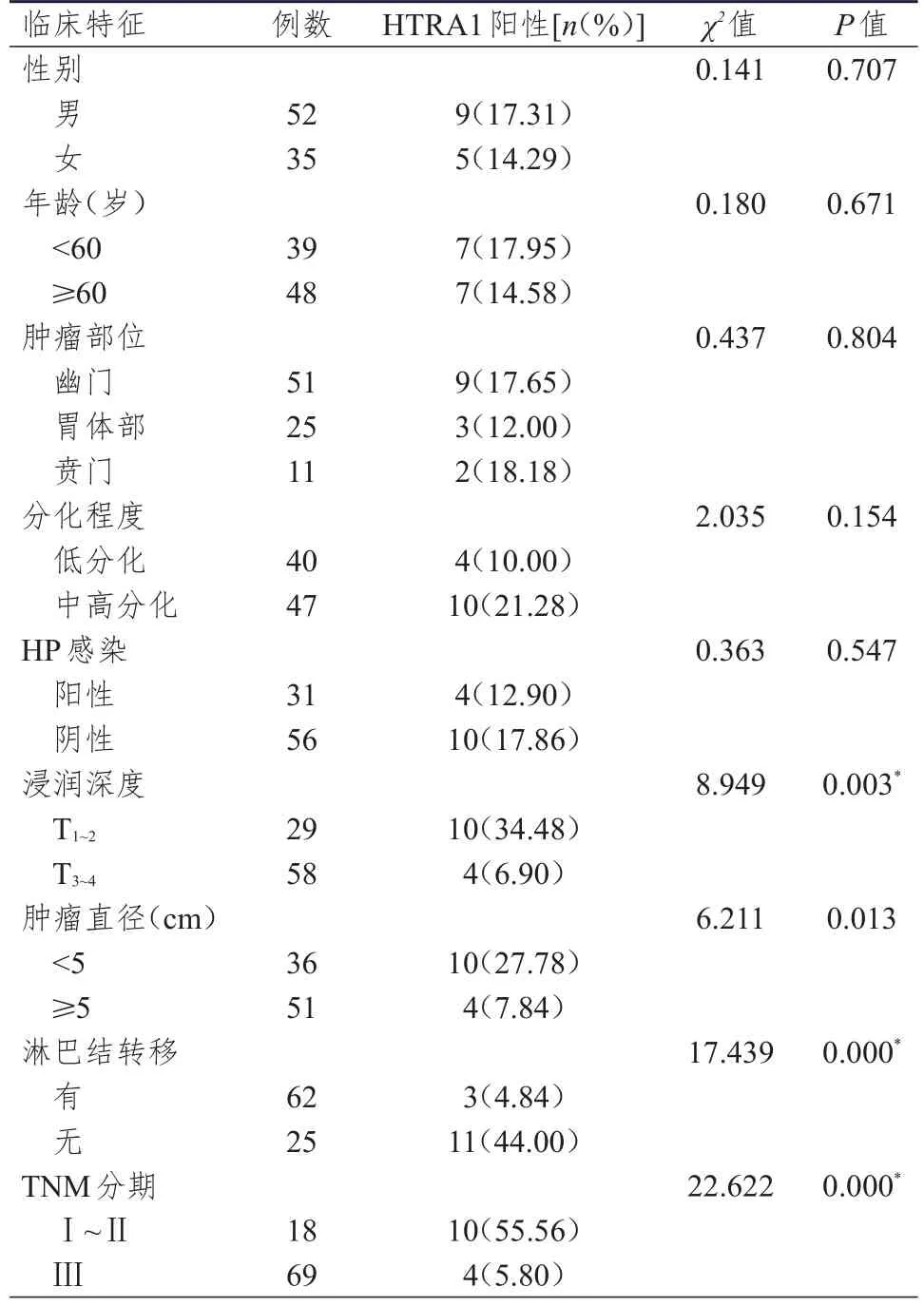
表2 不同临床特征胃癌患者胃癌组织中HTRA1阳性表达情况的比较(n=87)
2.3 胃癌组织中HTRA1表达与胃癌患者预后的关系
截至随访结束,87例胃癌患者中,27例患者死亡。其中,14例HTRA1阳性患者中,1例患者死亡,平均生存时间为57(95%CI:56~60)个月;73例HTRA1阴性患者中,26例患者死亡,平均生存时间为 51(95%CI:48~54)个月;HTRA1 阳性胃癌患者的生存结局优于HTRA1阴性患者,差异有统计学意义(χ2=4.016,P=0.045)。(图1)
2.4 胃癌根治术后患者预后影响因素的多因素分析
以随访结束时患者是否死亡为因变量(死亡=1、生存=0),以浸润深度、肿瘤直径、淋巴结转移情况、TNM分期、HTRA1表达情况作为自变量,Cox比例风险回归模型结果显示,浸润深度为T3~4、肿瘤直径≥5 cm、有淋巴结转移、TNM分期为Ⅲ期、HTRA1阴性是胃癌根治术后患者预后的独立危险因素。(表3)
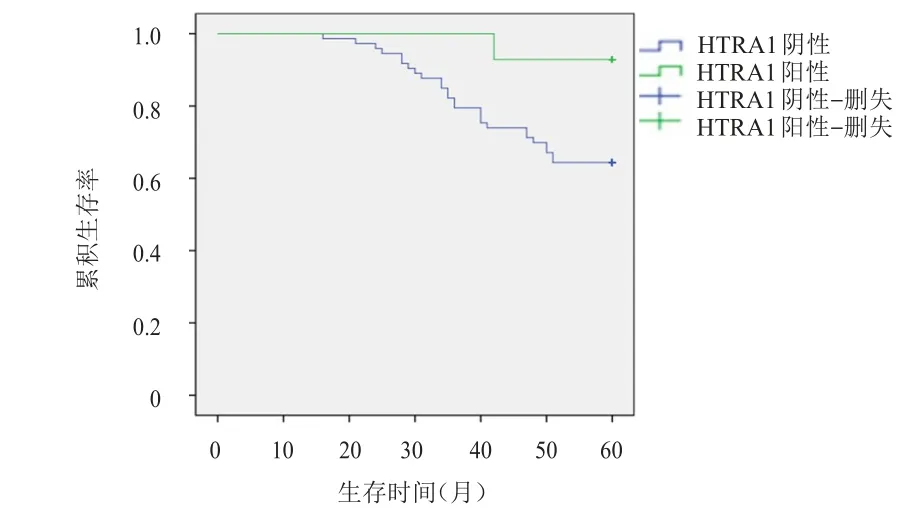
图1 HTRA1阳性(n=14)和HTRA1阴性(n=73)表达胃癌患者的总生存曲线
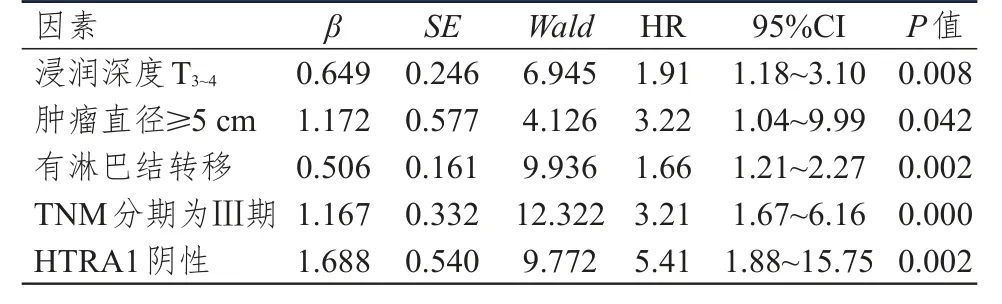
表3 87例胃癌根治术后患者预后影响因素的多因素分析
3 讨论
胃癌是临床常见的一种恶性肿瘤,具有较高的发病率和病死率,严重危及患者的生命安全,已成为重要的公共卫生问题[9-10]。了解胃癌的发病机制,从而对胃癌进行早期干预,对提高患者的疗效,延长患者的生存期具有重要作用。近年来,随着对胃癌分子生物学研究的不断深入,研究发现,胃癌的发生与多种基因和信号通路有关[11]。
HTRA1属于人丝氨酸蛋白酶家族成员,广泛存在于动物、植物及微生物体内,可以参与细胞抵御热休克、炎性反应、氧化性应激等生理病理过程[12]。已有研究发现,HTRA1可以参与肿瘤细胞的侵袭、迁移等过程,且其表达水平增高时可以明显抑制肿瘤的生长[13]。相关研究表明,HTRA1表达下调能够加快肿瘤细胞的增殖,促进肿瘤细胞的迁移[14]。近年来研究发现,HTRA1表达下调后能够增强细胞外基质与细胞间连接的能力,促进细胞的重构[15]。陈欢等[16]研究报道,上皮-间质转化可以促进肿瘤细胞转移,导致肿瘤细胞对化疗药物产生耐药性;抑制上皮-间质转化能够抑制肿瘤细胞增殖,促进肿瘤细胞凋亡。相关研究显示,HTRA1表达下调所致乳腺癌进展,可能与其诱导肿瘤上皮-间质转化有关,抑制HTRA1表达能够促进间质细胞表型转变,产生侵袭和转移能力[17]。还有研究表明,下调HTRA1表达可以通过诱导转化生长因子β表达,激活调控转化生长因子β信号转导通路,进而参与细胞的增殖和分化过程[18]。既往研究已证实,活化的HTRA1能够通过丝氨酸蛋白酶依赖方式促进肿瘤细胞的凋亡,而下调HTRA1表达能够减少细胞毒性作用,导致肿瘤细胞化疗耐受[19]。Zhao等[20]研究表明,HTRA1在对顺铂耐受的肺癌细胞中呈低表达。HTRA1在子宫内膜癌、黑色素瘤等多种肿瘤组织中表达下调或缺失,且肿瘤进展患者的HTRA1下调更为明显,提示HTRA1下调与肿瘤进展有一定相关性[21]。本研究结果显示,胃癌组织中HTRA1蛋白的阳性表达率明显低于癌旁组织(P<0.01),表明HTRA1表达可能与胃癌的发生有关。
既往研究显示,HRTA1和肿瘤生物学行为有关[22]。本研究结果显示,浸润深度为T3~4、肿瘤直径≥5 cm、有淋巴结转移、TNM分期为Ⅲ期胃癌患者胃癌组织中HTRA1阳性表达率分别低于浸润深度为T1~2、肿瘤直径<5 cm、无淋巴结转移、TNM分期为Ⅰ~Ⅱ期患者(P<0.05),提示随着肿瘤恶性程度的上升,HRTA1的表达有所下调。Miyamoto等[5]研究发现,HTRA1表达水平降低与恶性肿瘤患者的总生存情况有关。本研究结果显示,HTRA1阳性胃癌患者的生存结局优于HTRA1阴性表达患者,提示HRTA1可能与胃癌患者的生存预后有关,考虑与HTRA1在胃癌细胞中表达增强,可以促进胃癌细胞凋亡,及抑制胃癌细胞增殖有关。本研究结果还显示,浸润深度为T3~4、肿瘤直径≥5 cm、有淋巴结转移、TNM分期为Ⅲ期是胃癌根治术后患者预后的独立危险因素,提示HRTA1在胃癌组织中的表达与胃癌患者的多种生物学行为可能有关,可作为胃癌患者预后的预测指标之一。
综上所述,胃癌组织中HTRA1的阳性表达率较低,且其表达水平与胃癌患者的浸润深度、肿瘤直径、淋巴结转移和TNM分期有关,可作为胃癌患者预后预测的参考指标,在临床具有较高的应用价值。但是本研究的样本量少,因而有待更多样本量的深入研究,以减少随机误差,增加结论的可靠性。

