培美曲塞+卡铂联合盐酸埃克替尼治疗EGFR 突变晚期肺癌患者的疗效及生存分析
赵敏,丁平,郑德文
朝阳市第二医院肿瘤内科,辽宁 朝阳 122000
肺癌是世界范围内较为常见的一种恶性肿瘤,其发病率和病死率均较高,且呈快速增长趋势,严重威胁着人们的生命安全[1]。相关数据显示,非小细胞肺癌约占全部肺癌的85%,且早期无明显特异性临床表现,其中80%的非小细胞肺癌患者在确诊时已处于晚期,错失了手术治疗的最佳时机,若不及时控制病情发展,则可能危及患者的生命安全[2-3]。靶向治疗、姑息性化疗等为临床治疗肺癌的主要手段。目前,以铂类药物为基础的化疗方案仍是晚期肺癌患者的标准一线治疗方案,但临床实践发现,部分肺癌患者,尤其是表皮生长因子受体(epidermal growth factor receptor,EGFR)突变的晚期肺癌患者初次使用培美曲塞+卡铂方案治疗后,效果并不理想[4]。盐酸埃克替尼是中国自主研发的小分子靶向药物,可以有效抑制EGFR的表达,针对EGFR突变肺癌患者,其治疗效果显著[5-6]。本研究对培美曲塞+卡铂联合盐酸埃克替尼治疗EGFR突变晚期肺癌的疗效进行研究,现报道如下。
1 资料与方法
1.1 一般资料
选取2015年7月至2016年7月于朝阳市第二医院就诊的晚期肺癌患者。纳入标准:①经病理组织学、影像学检查确诊为不可手术的晚期肺癌;②治疗前行EGFR基因检测,均存在EGFR基因突变。排除标准:①合并肝肾功能不全、心功能衰竭者;②有全身免疫系统疾病者;③既往接受过化疗、放疗等抗肿瘤治疗者;④合并语言障碍、精神疾病者。根据纳入和排除标准,本研究共纳入晚期肺癌患者130例。根据治疗方法不同将患者分为观察组(n=68)和对照组(n=62)。对照组中,男32例,女30例;年龄65~82岁,平均(73.23±2.59)岁。观察组中,男35例,女33例;年龄64~83岁,平均(73.56±2.69)岁。两组患者的性别、年龄比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
两组患者化疗前均接受止吐、保护胃黏膜、补液等常规干预,随时监测患者的病情变化。对照组患者给予培美曲塞+卡铂治疗,具体方法:第1天,500 mg/m2培美曲塞,静脉滴注;第3~4天,75 mg/m2卡铂,静脉滴注,21天为1个周期,连续治疗2~6个周期。观察组患者给予培美曲塞+卡铂联合盐酸埃克替尼治疗,具体方法:培美曲塞和卡铂的用药方法同对照组,同时给予患者口服盐酸埃克替尼,每次125 mg,每天3次,连续治疗2~6个周期。患者肿瘤出现进展或出现药物不耐受时停止用药。
1.3 观察指标和评价标准
比较两组患者治疗后的临床疗效及治疗前后血清癌胚抗原(carcinoembryonic antigen,CEA)、神经元特异性烯醇化酶(neuron specific enolase,NSE)、细胞角质蛋白19片段抗原21-1(cyto-keratin 19 fragment antigen 21-1,CYFRA21-1)水平;记录治疗期间两组患者食欲下降、皮疹、腹泻、恶心呕吐、血小板减少、贫血、白细胞减少等不良反应发生情况;采用电话的方式对所有患者进行为期2年的随访,比较两组患者的生存情况。
参照世界卫生组织(WHO)实体瘤疗效评价标准[7]对两组患者治疗后的临床疗效进行评价:完全缓解(CR),肿瘤完全消失,且超过1个月;部分缓解(PR),肿瘤最大直径及最大垂直直径乘积缩小达50%,且持续超过1个月;疾病稳定(SD):肿瘤最大直径及最大垂直直径乘积缩小不超过50%,增大不超过25%,且持续超过1个月;疾病进展(PD):肿瘤最大直径及最大垂直直径乘积增大超过 25%。总有效率=(CR+PR)例数/总例数×100%。于治疗前和治疗后分别采集两组患者的空腹静脉血 4 ml,3000 r/min离心 10 min,放置于-20℃冰箱中保存待检,采用电化学发光法检测血清CEA、NSE、CYFRA21-1水平,检测步骤严格按照试剂盒说明书进行。
1.4 统计学分析
采用SPSS 16.0软件进行数据分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;等级资料比较采用秩和检验;采用Kaplan-Meier法绘制生存曲线,生存率的比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效的比较
观察组和对照组患者治疗后的临床疗效比较,差异有统计学意义(u=2.642,P=0.008);观察组患者的治疗总有效率为88.2%(60/68),高于对照组患者的71.0%(44/62),差异有统计学意义(χ2=6.044,P=0.014)。(表1)

表1 两组患者的临床疗效[n(%)]*
2.2 血清CEA、NSE、CYFRA21-1水平的比较
治疗前,两组患者的血清CEA、NSE、CYFRA21-1水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者的血清CEA、NSE、CYFRA21-1水平均低于本组治疗前,差异均有统计学意义(P<0.05);治疗后,观察组患者的血清CEA、NSE、CYFRA21-1水平均明显低于对照组,差异均有统计学意义(P<0.01)。(表2)
2.3 不良反应发生情况的比较
治疗期间,两组患者均出现食欲下降、皮疹、腹泻、恶心呕吐、血小板减少、贫血、白细胞减少不良反应;观察组患者各不良反应发生率均低于对照组,差异均有统计学意义(P<0.05)。(表3)
表2 两组患者治疗前后血清CEA、NSE、CYFRA21-1水平的比较(ng/ml,±s)
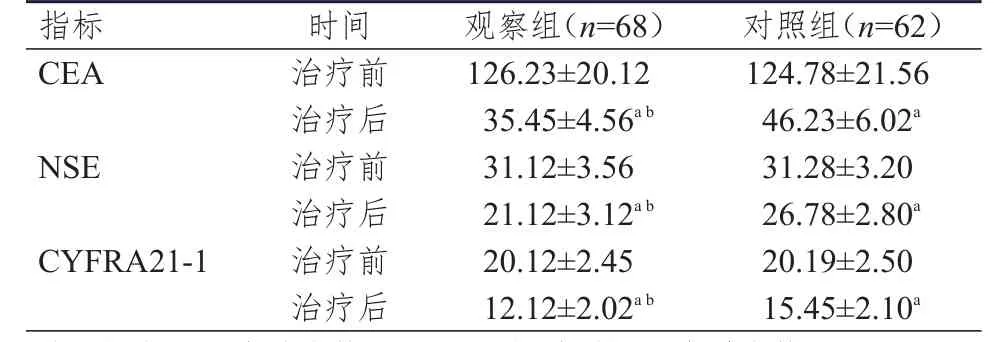
表2 两组患者治疗前后血清CEA、NSE、CYFRA21-1水平的比较(ng/ml,±s)
注:a与本组治疗前比较,P<0.05;b与对照组治疗后比较,P<0.01
指标CEA NSE CYFRA21-1时间治疗前治疗后治疗前治疗后治疗前治疗后观察组(n=68)126.23±20.12 35.45±4.56a b 31.12±3.56 21.12±3.12a b 20.12±2.45 12.12±2.02a b对照组(n=62)124.78±21.56 46.23±6.02a 31.28±3.20 26.78±2.80a 20.19±2.50 15.45±2.10a
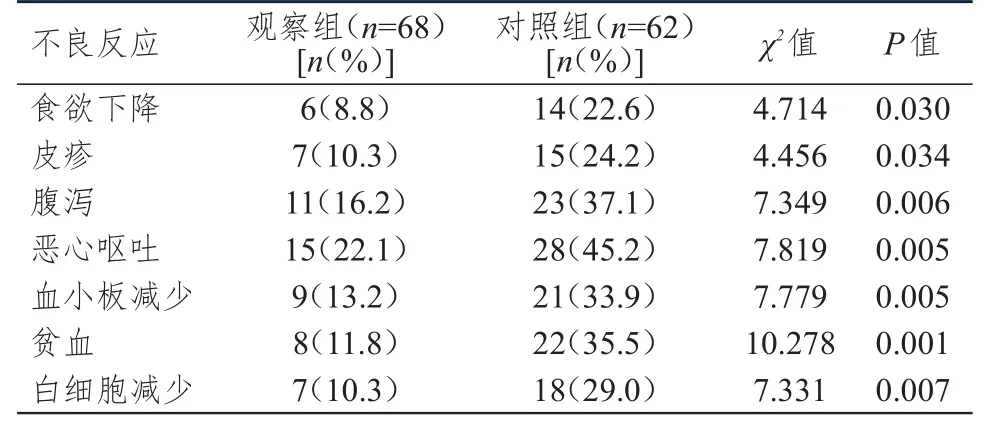
表3 两组患者治疗期间不良反应发生情况的比较
2.4 生存情况的比较
观察组患者的2年累积生存率为77.35%,高于对照组患者的48.71%;观察组患者的生存结局优于对照组,差异有统计学意义(χ2=4.513,P=0.036)。(图 1)

图1 观察组(n=68)和对照组(n=62)患者的总生存曲线
3 讨论
肺癌是全球范围内发病率、病死率均较高的一种恶性肿瘤,因其早期临床症状不明显,多数患者确诊时已经处于晚期,存在淋巴结转移、骨转移等,错过了手术治疗的最佳时机。姑息性化疗是临床治疗晚期肺癌的主要手段,可以有效控制病情进一步发展,延长患者的生存时间[8-9]。目前,临床常用的化疗药物包括培美曲塞、多西他赛、吉西他滨等第三代化疗药物[10]。
培美曲塞属于多靶点抗叶酸代谢药物,其通过还原型叶酸载体进入肿瘤细胞后,在叶酸多谷氨酸合成酶的催化下可以迅速转化为有活性的多聚谷氨酸盐,对多种叶酸依赖酶均有很强的抑制作用,可以从多个途径抑制嘧啶和嘌呤的合成,从而达到抑制肿瘤细胞生长的效果,最终抑制肿瘤细胞增殖[11-12]。Abernethy等[13]研究表明,培美曲塞与卡铂联合化疗治疗EGFR突变晚期肺癌,能够提高患者的生活质量,是治疗EGFR突变晚期肺癌的常用化疗方案,但是化疗过程中患者的不良反应发生率较高,给患者带来了较大的痛苦,因而难以达到临床预期效果。盐酸埃克替尼是继吉非替尼之后在临床中运用较为广泛的治疗EGFR突变晚期肺癌的药物,其安全性高,可以有效控制疾病进展,且对机体组织产生的不良反应小,治疗EGFR突变晚期肺癌的疗效显著,与其他药物联合时能够有效改善EGFR突变晚期肺癌患者的预后[14-15]。李梅等[16]研究结果表明,多种药物联合化疗可能会增加药物相关不良反应的发生率;但Cortellini等[17]报道指出,联合用药可能更加有利于肿瘤缓解。本研究结果显示,观察组患者的治疗总有效率为88.2%,高于对照组患者的71.0%(P<0.05),表明培美曲塞+卡铂联合盐酸埃克替尼治疗EGFR突变晚期肺癌的疗效优于培美曲塞+卡铂化疗,可以有效控制疾病进展。分析其原因可能为观察组增加了口服盐酸埃克替尼治疗,口服用药比较方便,患者的依从性较高,可以严格按照医师叮嘱服药,有效控制疾病进展,与刘相良等[18]研究结果相似。细胞凋亡是机体维持平衡的重要机制,对肿瘤细胞的侵袭、转移具有一定的抑制作用,而血清CEA、NSE、CYFRA21-1均为体内的抗细胞凋亡因子,因而与肿瘤的发生、发展密切相关[19]。本研究结果显示,治疗后,两组患者的血清CEA、NSE、CYFRA21-1水平均较本组治疗前降低(P<0.05),且观察组患者治疗后的血清CEA、NSE、CYFRA21-1水平均明显低于对照组(P<0.01)。表明盐酸埃克替尼能够有效抑制CEA、NSE、CYFRA21-1表达,进而抑制肿瘤细胞增殖,控制病情进展展。
药物相关不良反应是制约化疗药物应用的重要因素[20]。本研究结果显示,治疗期间,观察组患者食欲下降、皮疹、腹泻、恶心呕吐、血小板减少、贫血、白细胞减少的发生率均低于对照组(P<0.05),表明培美曲塞+卡铂与盐酸埃克替尼联合可以发挥协同作用,减轻药物对机体组织造成的损伤,降低EGFR突变晚期肺癌患者的不良反应发生率,且不良反应均可耐受。本研究对患者进行为期2年的随访,结果显示,观察组患者的生存结局优于对照组(P<0.05),表明盐酸埃克替尼能够有效延长EGFR突变晚期肺癌患者的生存期。
综上所述,培美曲塞+卡铂联合盐酸埃克替尼治疗EGFR突变晚期肺癌的临床效果明显,且可以有效抑制CEA、NSE、CYFRA21-1表达,降低不良反应发生率,延长患者的生存时间,值得临床推广使用。

