糖类抗原19-9联合血红蛋白及嗜酸性粒细胞分数对胰腺癌的诊断价值分析
张力,王勇
1陕西省友谊医院检验科,西安 710068
2西安北车医院检验科,西安 710086
胰腺癌是一种消化系统恶性肿瘤,近年来随着人们社会及日常生活不断变化,胰腺癌的发病率逐年升高。胰腺癌起病急,病情进展迅速,预后较差,患者5年生存率小于5%[1],因此需要寻找有效方法早期诊断胰腺癌。目前临床上诊断胰腺癌的方法主要包括病理活检、影像学检查和肿瘤标志物检测[2]。病理活检是诊断胰腺癌的金标准,但活检取材复杂且有创伤性,不利于早期诊断和随时观察。影像学检查难以分辨胰腺肿大、胰管不规则狭窄的胰腺良恶性病变。肿瘤标志物已经成为早期诊断恶性肿瘤的重要方法之一[3],以糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)、癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原50(carbohydrate antigen 50,CA50)等为代表的血清学生物标志物已用于提示消化道肿瘤的发生[4-5],其中血清CA19-9是胰腺癌和直肠癌的标志物,但其单项检测的诊断意义有限,诊断效能有待进一步评估[6]。将已有的肿瘤标志物与常见检测指标进行联合诊断是早期诊断胰腺癌的新探索,因此本研究探讨CA19-9联合血常规中血红蛋白(hemoglobin,Hb)及嗜酸性粒细胞分数(eosinophilic granulocyte,EO)对胰腺癌的诊断价值,现报道如下。
1 对象与方法
1.1 研究对象
选取2015年9月至2018年9月就诊于陕西省友谊医院和西安北车医院的104例胰腺病变患者为研究对象。纳入标准:①均经病理组织检查确诊;②均为首次确诊。排除标准:①未合并消化系统其他脏器占位病变及炎性反应,无其他良恶性肿瘤;②近1个月内未接受放化疗、药物治疗及手术治疗。将经病理组织检查确诊为胰腺癌的56例患者设为胰腺癌组,经病理组织检查确诊为胰腺良性病变的48例患者设为胰腺良性病变组。两组患者基线特征比较,差异均无统计学意义(P>0.05)(表1),具有可比性。本研究经医院伦理委员会批准,且所有患者均签署知情同意书。

表1 两组患者的基线特征
1.2 检测方法
1.2.1 血液标本采集 两组患者均于入院第2天清晨空腹大于8 h后采集两管肘静脉血液标本。其中一管促凝血液标本3 ml,3000 r/min离心10 min,收集上层血清标本,保存于-20℃,用于血清标志物检测;另一管抗凝血液标本2 ml,缓慢颠倒混匀以防止血液标本凝集,于30 min内检测血常规。
1.2.2 血清CA19-9检测 采用美国Abbot(t雅培)公司生产的全自动酶免分析系统IMX及CA19-9测定试剂盒测定CA19-9的含量。测定方法:微粒子酶免疫分析法(microparticle enzyme immunoassay,MEIA)测定CA19-9由相应的TM模块软件控制,执行 0、30、90、180、320、500(kU/L)点定标,IMX自动完成整个操作过程。参考值为0~37 kU/L,超出参考值设为“+”,在参考值内设为“-”。
1.2.3 血常规指标检测 采用XE-2100全自动血液分析仪检测Hb、EO水平,Hb参考值为男性131~172g/L,女性113~151 g/L,EO参考值为0.005~0.050,超出参考值设为“+”,在参考值内设为“-”。
1.2.4 诊断价值分析 采用受试者工作特征(receiver operating characteristic,ROC)曲线对诊断结果进行分析。灵敏度=真阳性例数(/真阳性例数+假阴性例数)×100%,特异度=真阴性例数(/真阴性例数+假阳性例数)×100%,准确度=(真阴性例数+真阳性例数)(/真阳性例数+真阴性例数+假阳性例数+假阴性例数)×100%,误诊率=假阳性例数/(假阳性例数+真阴性例数)×100%,漏诊率=假阴性例数(/假阴性例数+真阳性例数)×100%。
1.3 统计学分析
采用SPSS 20.0统计软件进行数据分析,计数资料以例数及率(%)表示,两组比较采用χ2检验;计量资料以均数±标准差(±s)表示,两组比较采用t检验;同时采用ROC曲线对Hb、EO、CA19-9单独及联合检测诊断胰腺癌的价值进行分析。以P<0.05为差异有统计学意义。
2 结果
2.1 Hb、EO及CA19-9水平的比较
胰腺癌组患者的Hb和CA19-9水平均明显高于胰腺良性病变组,EO明显低于胰腺良性病变组,差异均有统计学意义(P<0.01)。(表2)
表2 两组患者Hb、EO及CA19-9水平的比较(±s)
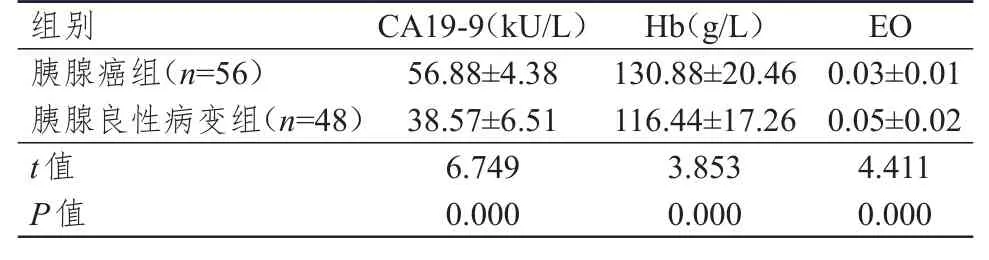
表2 两组患者Hb、EO及CA19-9水平的比较(±s)
组别胰腺癌组(n=56)胰腺良性病变组(n=48)t值P值56.88±4.38 38.57±6.51 6.749 0.000 130.88±20.46 116.44±17.26 3.853 0.000 0.03±0.01 0.05±0.02 4.411 0.000 CA19-9(kU/L)Hb(g/L)EO
2.2 Hb、EO、CA19-9单独及联合检测诊断胰腺癌的价值分析
以病理诊断结果为金标准,Hb、EO、CA19-9联合检测诊断胰腺癌的灵敏度高于各单项检测,漏诊率低于各单项检测,准确度高于Hb、EO单项检测,差异均有统计学意义(P<0.05)。(表3、表4)
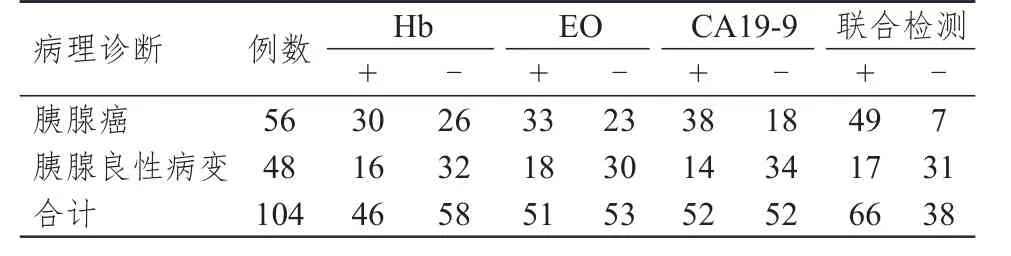
表3 Hb、EO、CA19-9单独及联合检测诊断胰腺癌与病理诊断结果的对照
2.3 Hb、EO、CA19-9单独及联合检测诊断胰腺癌的ROC 曲线分析
Hb、EO、CA19-9单独及联合检测诊断胰腺癌的ROC曲线下面积(areas under the curve,AUC)分别为0.604、0.652、0.723、0.776。Hb的最佳临界值为122.396 g/L,EO的最佳临界值为0.049,CA19-9的最佳临界值为40.430 kU/L。(图1)
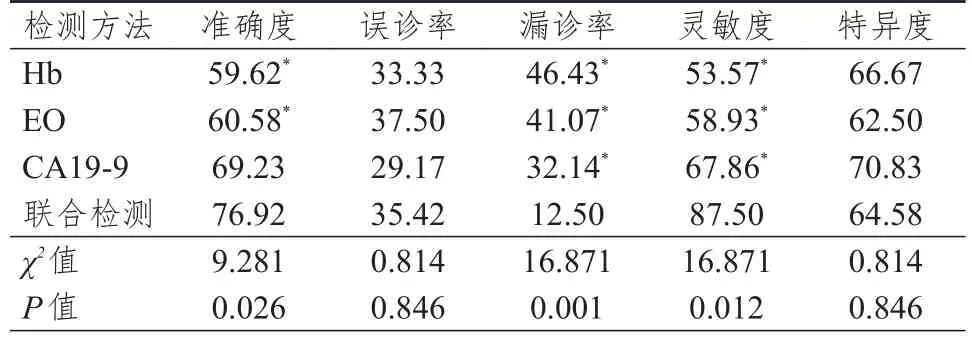
表4 Hb、EO、CA19-9单独及联合检测对胰腺癌的诊断效能(%)

图1 Hb、EO、CA19-9及三者联合检测诊断胰腺癌的ROC曲线
3 讨论
胰腺癌的发病率不断升高,中国胰腺癌发病率上升到恶性肿瘤第十位,病死率居全部恶性肿瘤第六位,部分地区病死率居第五位[7]。胰腺癌的恶性程度高,进展速度快,患者预后差,即使接受手术治疗及放化疗,5年生存率仅为5%[1]。由于人们生活习惯的改变,吸烟和饮酒成为胰腺癌发生的独立危险因素[8]。胰腺癌患者多出现腹痛和体重减轻等不典型症状,因此易误诊为其他消化道及腹腔疾病[9],延误极早期治疗。因此,早期诊断胰腺癌是延缓病程进展、提高预后、延长患者生存期的重要途径。腹腔肿瘤经常通过计算机断层扫描(CT)检查进行排查,但并不适用于胰腺癌的筛查。早期胰腺癌患者CT诊断多出现腺体肿大、胆管狭窄等症状[10],其特征与自身免疫性胰腺炎等胰腺良性疾病相似[11-12],因此难以区分。肿瘤标志物的发现为早期诊断恶性肿瘤提供了希望。CA19-9是早期发现的消化系统肿瘤的血清生物标志物,并已经广泛应用于胰腺癌和直肠癌的临床诊断,但诊断的准确度并不理想。在目前尚无更理想的肿瘤标志物研发应用之前,将已有的肿瘤标志物与常见检测指标进行联合诊断是早期诊断胰腺癌的新探索[13-14]。因此本研究评估了CA19-9和Hb、EO联合检测在临床诊断胰腺癌中的价值。
本研究检测了56例胰腺癌患者和48例胰腺良性病变患者的CA19-9、Hb及EO,发现胰腺癌组患者的CA19-9和Hb水平均明显高于胰腺良性病变组,而EO明显低于胰腺良性病变组,说明全血细胞分析中Hb和EO在胰腺癌和胰腺良性病变中的表达存在差异,有潜力用于胰腺癌的联合诊断。进一步比较了CA19-9、Hb和EO单独及联合诊断的效能,结果发现Hb、EO、CA19-9联合检测诊断胰腺癌的灵敏度高于各单项检测,漏诊率低于各单项检测,准确度高于Hb、EO单项检测(P<0.05)。提示Hb、EO和CA19-9联合诊断能提高Hb、EO、CA19-9单项诊断的效能。本研究绘制了Hb、EO和CA19-9鉴别胰腺癌和胰腺良性病变的ROC曲线,结果显示,三者联合应用的AUC优于单一指标检测,可考虑用于鉴别胰腺癌和胰腺良性病变。
有研究发现自身免疫性胰腺炎患者CA19-9和Hb水平明显低于胰腺癌患者,EO明显高于胰腺癌患者[12,15],这与本研究结果相符。胰腺良性病变多伴随炎性反应,嗜酸性粒细胞聚集增多是消化道发生炎症的主要表现[16-17]。嗜酸性粒细胞脱颗粒产生的酶对胰腺细胞有毒性作用,其过氧化物酶和氧化呼吸链产生的自由基进一步扩大胰腺的炎性反应[18]。肿瘤患者的外周血微环境发生了变化,导致血浆成分存在差异,血浆中游离Hb的种类和含量也相应发生变化,但胰腺癌患者外周血中Hb含量增高的机制目前尚不清楚,需要进一步研究。
综上所述,血清CA19-9联合全血Hb和EO检测能提高单项检测的准确度和灵敏度,有助于诊断胰腺癌。

