IMRT联合HDR-ICBT放射治疗同步多西他赛及顺铂化疗对局部晚期子宫颈癌的疗效
牛励,胡博,张帆
(安徽医科大学第一附属医院 1.肿瘤放射科;2.骨科,合肥 230022)
子宫颈癌是最常见的妇科恶性肿瘤,严重威胁女性的健康[1]。早期子宫颈癌经根治性放射治疗(简称放疗)或手术治疗后,5年总生存率可达90%[2]。然而仍有约50%患者确诊时已处于肿瘤发展的中晚期[3],对于此类患者,单纯手术或放疗都难以有效控制肿瘤的转移与复发。传统子宫颈癌放疗多采用全盆腔等中心照射配合腔内放疗,在此治疗模式下,膀胱、小肠等正常组织不能得到有效保护,从而造成肠道及泌尿系统放疗相关并发症的发生[4]。目前,对于局部晚期子宫颈癌的治疗多采用以放疗为主的综合治疗模式。临床上多采用调强放疗(intensity modulated radiation therapy,IMRT)联合高剂量率腔内后装放疗(high-dose rate intracavitary brachytherapy,HDR-ICBT)的精确放疗模式,在增加肿瘤放疗剂量的同时有效减少了周围正常组织的照射剂量。对于FIGO分期为ⅡB~ⅣA的局部晚期子宫颈癌患者,临床上越来越多采用同步放化疗(concurrent chemoradiotherapy,CCRT)治疗模式。本研究以本院放射治疗科60例局部晚期子宫颈癌患者作为研究对象,探讨IMRT联合HDR-ICBT放疗同步多西他赛及顺铂化疗的临床疗效和安全性。
1 材料与方法
1.1 临床资料与分组
选取2015年3月至11月于安徽医科大学第一附属医院肿瘤放射科就诊的60例局部晚期子宫颈癌患者作为研究对象,随机分成单纯放疗(RT)组(n=30)、CCRT组(n=30)。纳入标准:患者 均经组织病理学证实;KPS评分>70分[5];FIGO分期为ⅡB~ⅣA[6];经医学影像学检查排除远处转移的局部晚期初治子宫颈癌患者;患者均无放疗、化疗禁忌证,肝肾功能无明显异常。本研究经安徽医科大学伦理委员会批准并取得入组患者知情同意。RT组仅进行子宫颈癌根治性放疗一程(IMRT及HDRICBT放疗[7]),CCRT组根治性放疗期间同步多西他赛及顺铂化疗。2组患者年龄、病理类型、临床分期等基本资料比较无统计学差异(均P> 0.05),具有可比性,见表1。
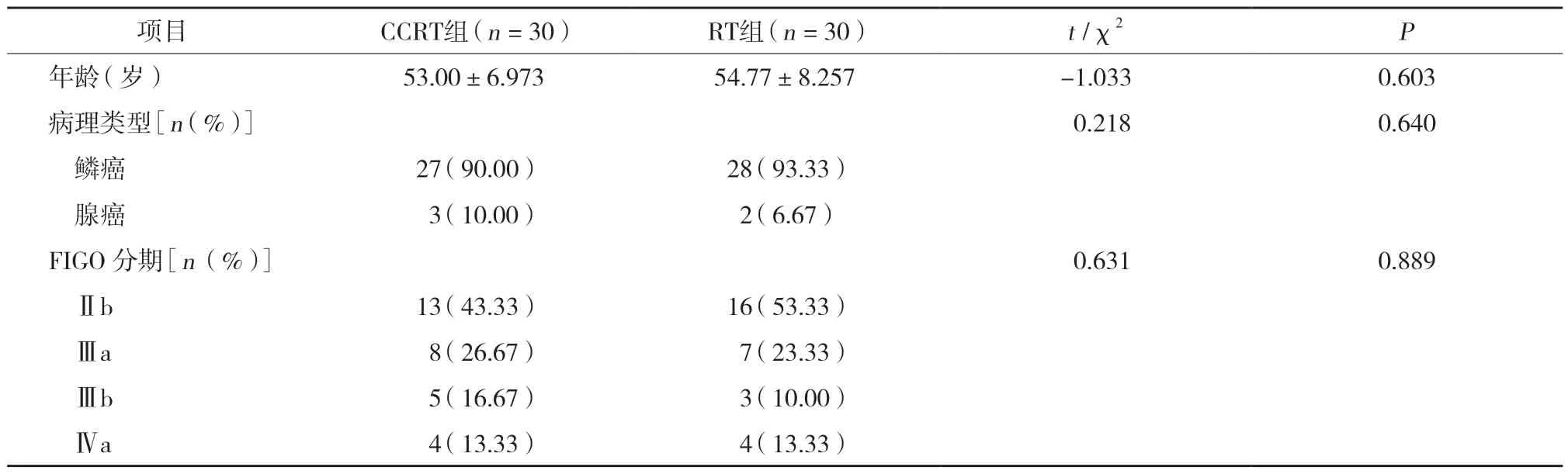
表1 2组一般临床资料比较
1.2 治疗方法
1.2.1 模拟定位扫描:CT扫描前患者需排空膀胱,留置导尿管,膀胱内注射200 mL生理盐水后夹闭尿管,保持膀胱充盈。扫描时,患者仰卧位,热塑体膜固定。以耻骨联合上缘与体中线交点为中心。扫描层距为5 mm,扫描范围为L3椎体上缘至坐骨结节下2 cm水平。
1.2.2 靶区勾画:肿瘤靶区(gross tumor volume,GTV)为CT扫描图像上可见肿瘤侵犯区域及盆腔增大淋巴结。临床靶区(clincal target volume,CTV)为GTV外放0.5 cm,同时包括子宫体、子宫旁、部分阴道及盆腔淋巴结区域(髂内、髂外、髂总、骶前及闭孔)。计划靶区(planning target volume,PTV)为CTV外扩5~7 mm。
1.2.3 放疗计划设计:IMRT95%等剂量曲线包括PTV,总剂量DT 50~50.4 Gy/25~28 f。IMRT放疗PTV剂量达30 Gy后每周穿插HDR-ICBT放疗1次,最终腔内治疗总剂量(dose of target,DT)达 25~30 Gy/5~6 f。所有患者执行7野IMRT计划[8]。周围危及器官(oragan at risk,OAR)包括小肠、直肠、膀胱、左右股骨头。所有计划确保OAR受量在正常耐受剂量以下,小肠V40≤50%、直肠V40≤40%、膀胱V50≤50%、股骨头V50≤50%[7]。PTV内尤其是GTV内无剂量冷点,靶区外危及器官无剂量热点。
1.2.4 化疗疗程设计:CCRT组采用IMRT+HDR-ICBT同步多西他赛及顺铂化疗。于放疗开始1周内静脉滴注多西他赛(75 mg/m2)。用药前口服地塞米松片预防过敏。多西他赛用药同一天开始静脉滴注顺铂(15 mg/m2),连续5 d,用药同时给予患者必要的水化、止吐等处理。化疗3周为1个疗程,连续3~4个疗程。
1.3 疗效判断标准及观察指标
1.3.1 近期疗效:放疗后3个月通过盆腔MRI及子宫颈涂片法,参照有关实体瘤疗效评价标准RECIST1.1[9]对患者近期疗效进行评估,分为:(1)完全缓解(complete response,CR),治疗后所有病灶消失,维持时间超过4周;(2)部分缓解(partial response,PR),治疗后病灶长径总和缩小超过30%;(3)稳定(stable disease,SD),基线病灶长径总和有缩小但未达PR或有增加但未达进展(progressive disease,PD);(4)PD,治疗后,病灶长径总和增加超过20%。有效率(response rate,RR)=(CR+PR)/总数×100%。
1.3.2 远期疗效:通过门诊随访,对患者3年的总生存(overall survival,OS)及无进展生存(disease-free survival,PFS)进行评价。
不良反应包括胃肠道反应、泌尿系统反应及骨髓抑制等。记录随访期间不良反应发生情况,根据美国放射肿瘤学研究组(RTOG)及欧洲放射肿瘤学会(EORTC)发布的放射性损伤评价标准[10]对患者的不良反应进行分级判定。
1.4 统计学分析
采用SPSS 23.0统计软件进行统计分析,计量资料采用±s表示,组间比较采用t检验;计数资料组间比较采用χ2检验,P< 0.05为差异有统计学意义。
2 结果
2.1 2组不良反应情况比较
结果显示,2组均出现了不同程度急慢性放射性肠炎、放射性膀胱炎及骨髓抑制。CCRT组急性骨髓抑制的发生率明显高于RT组(P< 0.05)。见表2。
2.2 2组近期疗效比较
结果显示,CCRT组近期RR显著高于RT组(χ2=4.320,P=0.038)。见表3。
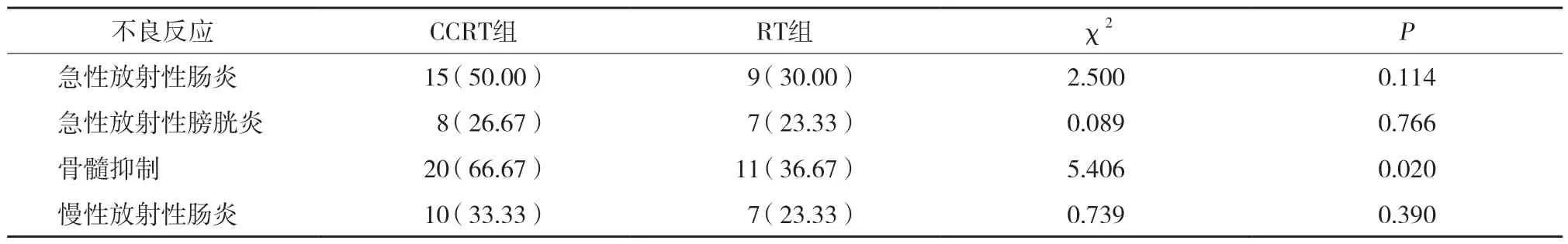
表2 2组放化疗不良反应发生情况比较 [n(%)]

表3 2组近期疗效比较
2.3 2组远期疗效比较
结果显示,CCRT组2年和3年PFS率均显著优于RT组(P< 0.05)。见表4。
3 讨论
子宫颈癌发病率位居我国女性生殖系统恶性肿瘤首位[11],IMRT作为子宫颈癌治疗的重要手段已在临床广泛开展[12]。2015年美国国立综合癌症网络(NCCN)指南提出对于未能切除且伴有中心性病变的子宫颈癌患者应选择近距离照射与IMRT结合的治疗模式[13]。然而,研究[14]显示与传统放疗比较,IMRT未能有效延长局部晚期子宫颈癌患者的生存期,治疗失败的主要原因为淋巴结转移和远处血行转移。另外也与肿瘤体积、子宫周围浸润病灶对放疗敏感性差以及未能对照射野外病灶加以有效控制有关。因此外照射放疗联合腔内近距离放疗及小剂量化疗越来越多地应用于临床[2],以期通过化疗使放疗增敏,进而提高患者放疗疗效,延长生存期。
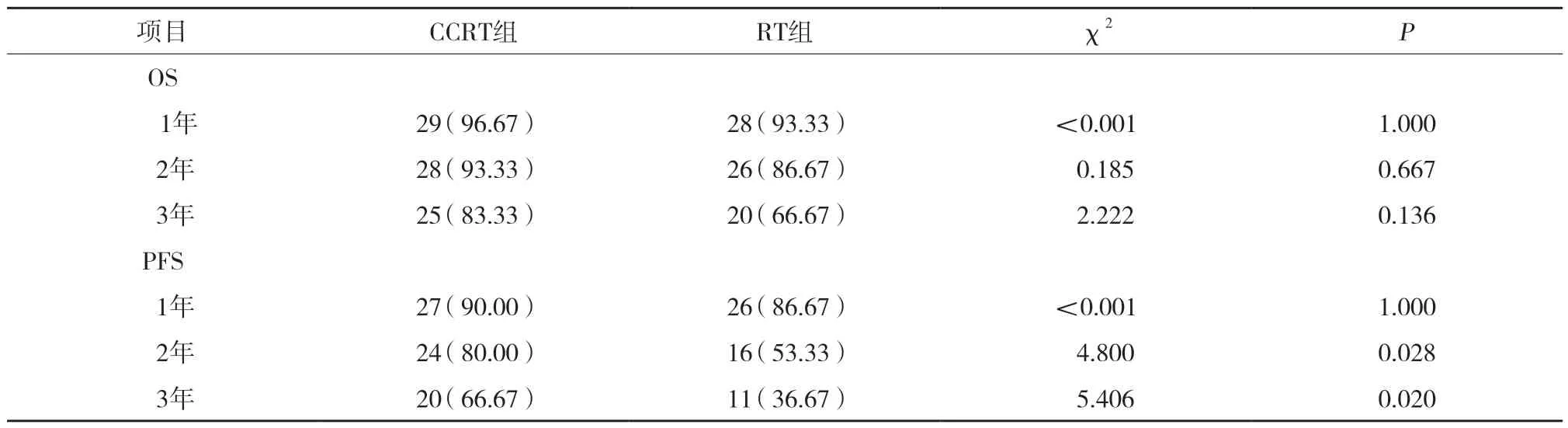
表4 2组远期生存情况比较 [n(%)]
既往研究[15]证实顺铂对子宫颈癌的放疗增敏作用一方面是通过与细胞内DNA嘌呤及嘧啶碱基结合干扰DNA复制,从而影响细胞分裂周期;另一方面是干扰肿瘤细胞的放射损伤修复。而多西他赛是紫杉烷类抗肿瘤药物,它通过干扰细胞有丝分裂和维持分裂间期细胞功能所必需的微管网络而发挥抗肿瘤作用。多西他赛可与游离的微管蛋白结合,促进微管蛋白装配成稳定的微管,同时抑制其解聚,使丧失了正常功能的微管束产生以及微管固定,进而抑制细胞有丝分裂。紫杉醇是细胞周期特异性药物,它将细胞周期阻断于G2/M期,以此提高放射敏感性。对于乏氧肿瘤细胞,多西他赛亦可通过细胞周期再氧合及协同抗血管生成等作用达到放疗增敏作用[16]。
本研究结果显示CCRT组临床有效率显著优于RT组(P< 0.05),提示多西他赛及顺铂同步化疗有放射增敏作用,可提高肿瘤的局部控制力,从而提升近期疗效,与以往研究[15,17]结果一致。FU等[18]关于比较放疗联合不同化疗方案治疗局部晚期子宫颈癌的meta分析研究中亦提示放疗同步多西他赛及顺铂较其他同步化疗方案临床有效率更高。本研究结果显示与RT组比较,CCRT组骨髓抑制的发生率明显增加(P< 0.05),但骨髓抑制大多数患者耐受良好且对症处理后症状改善明显。近期关于紫杉醇联合顺铂同步IMRT放疗治疗晚期子宫颈癌的研究[19]显示,同步放化疗较单纯放疗明显提高患者1年及3年OS率。而本研究结果显示CCRT组仅PFS改善而并未延长OS。分析其差异可能是因为入组患者组成不同所致,本研究对象约50%是Ⅱb期患者,而以往研究[19]的研究对象多为Ⅲa和Ⅲb期患者。同步化疗可能对分期较晚的患者有更大的生存期获益,今后需扩大样本量进一步进行分层比较。
综上所述,IMRT联合HDR-ICBT同步多西他赛及顺铂化疗治疗局部晚期子宫颈癌患者疗效显著,且耐受良好,延长了患者无进展生存期,值得临床推广应用。

