漫谈高考电化学中的“另类”试题
李宗来 李小娟
(江苏省响水中学 224600)
电化学是高中化学的重要知识点,是高考必考的考点,经过对比发现高考中不同与常规“另类”的电化学试题,在准确而深刻理解知识原理上,着力考查考生的创新思维、发散思维及迁移贯通等能力,同时“另类”的电化学试题也体现了高考试题一直是稳中有变,在传承中变化创新理念。本文例析相关“另类”试题,以期能对电化学原理更深入的认识与理解,把握知识的本质,达到 “以不变应万变”之目的.
一、电解质溶液中存在金属导体
例1(2016北京卷)用石墨电极完成下列电解实验.
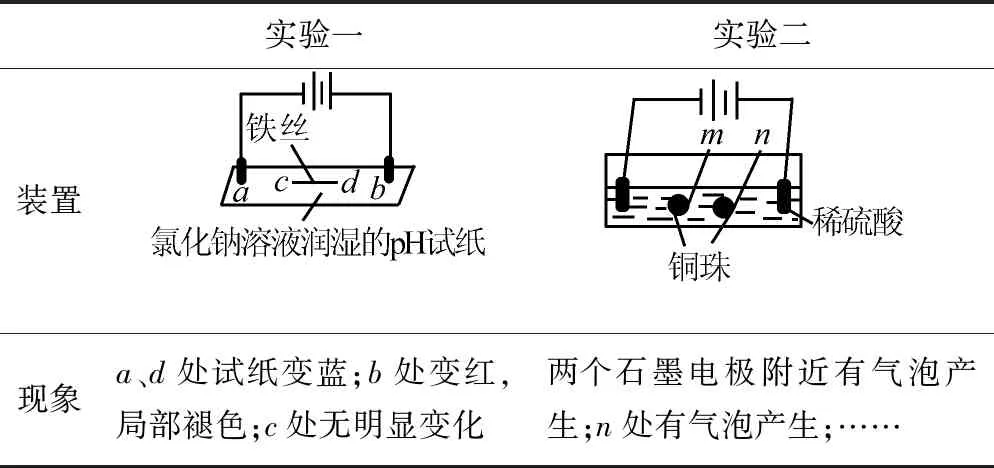
实验一实验二装置现象a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化两个石墨电极附近有气泡产生;n处有气泡产生;……
下列对实验现象的解释或推测不合理的是( ).



D.根据实验一的原理,实验二中m处能析出铜

点评本题考查电化学的有关知识的实验探究题,“另类”的题目呈现打破常规,在电解质溶液中存在金属导体串联的电解池装置非常新颖,在以往的电化学试题中是极少出现,对学生根据实验现象进行分析的能力、知识应用的能力、理解变通的能力要求非常高.对装置分析时结合现象、把握原理、分清两极,正确书写电极反应式是解题的关键.
总结提升装置中电解质溶液中存在金属导体,实际相当于多个原电池、电解池的串联,所以分析时根据装置图分清两极及物质的变化至关重要,然后应用电化学知识,依据电解质溶液的组成,书写电极反应式得出两极现象及变化,也可根据两极现象及变化辅助写出电极反应式做出正确的判断,注意在分析一个装置时其它的可以统统当作导线,准确判断出正、负、阴、阳极,即使是金属球体,也要一分为二的判断电极,一个球两面为不同的电极,如背靠电池正极的一面为电解时阳极(面朝的一面此时可以当做导线),同理面向正极为电解时的阴极,而且金属球体朝向相同的电极类型也相同.
二、电流电子方向在过程中发生改变



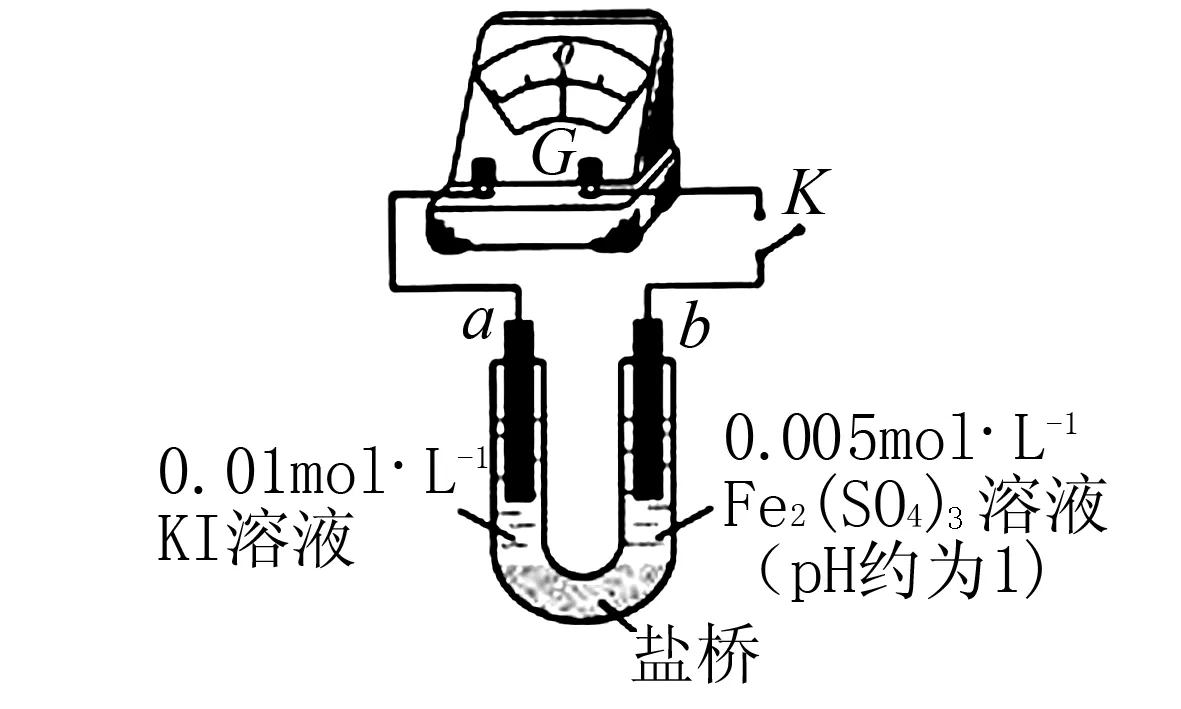
①K闭合时,指针向右偏转,b作____极.
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01 mol/L AgNO3溶液,产生的现象证实了其推测,该现象是____.
(2)按照(1)的原理,该同学用上图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因.
①转化原因是____.
②与(1)实验对比,不同的操作是____.

(2)①Fe2+随浓度增大,还原性增强 ,使Fe2+还原性强于I-
②向U型管右管中滴加1 mol/L FeSO4溶液.
例3 (2015年安徽卷)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生.

0-t1时,原电池的负极是Al片,此时,正极的电极反应式是____,溶液中的H+向____极移动,t1时,原电池中电子流动方向发生改变,其原因是____.

点评这两道高考中的“另类”的电化学试题,选材新颖,不落窠臼,力求达到对原理深入而透彻的考查,试题综合了引起原电池中电流方向改变的两种特殊情况:(1)可逆反应设计的特殊原电池,特点是平衡时电压为0,当外界条件打破平衡,引发平衡移动时,电极反应会发生互换改变,电流的方向随之改变以至达到新的平衡时,电压重新为0,不再向外输出电流.(2)Al (s)︱NaOH (aq)︱Mg (s)、和上例中Al / Fe (s)︱浓HNO3(aq)︱Cu(s)等原电池都是因活泼金属与电解质不反应或者不能继续反应而充当正极,它颠覆了活泼金属一定作负极的片面认识,这些都是在放电过程中反应机理发生了改变从而引发电流方向的改变.体现了高考试题在传承中变化,在变化中创新的理念.
总结提升近年高考中电化学的试题以另类新颖的形式与题材呈现,体现了高考命题在加强基本知识考查的同时,更加注重了试题的情景化、生活化、实用化,强化知识点的相互渗透与融合.深化了对原电池、电解池工作原理的准确理解及应用的考查,内容涉及构成条件、两极反应及变化、电解质中离子的移动、离子膜的选择和使用等.同时注意对一些特殊的新型原电池和不同用途电解装置的关注.在能正确书写电极反应的前提条件下,透彻理解原理,回答才能击中要点、得心应手,预测依然会对“另类”特殊的电化学装置及原理、变化及现象等细节的考查.
三、原电池、电解池的串联考查
1.原电池与电解池的在同一体系中
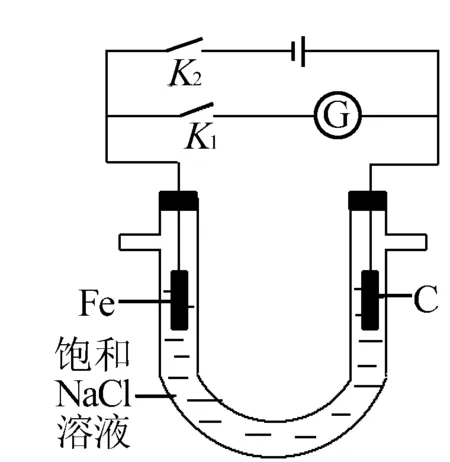
例4(2014上海卷)如右图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( ).
A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001 mol气体

点评融合原电池与电解池的在同一装置体系中,上例中是两个独立的体系,只要分别分析研究即可,但由于在同一体系中,要注意电极材料及电解质溶液是相同的,但反应原理完全不同,如例题中的Fe电极电解时作阴极而不被腐蚀,原电池为负极失电子,构成电化学腐蚀加快腐蚀的速度;有时也要注意它们先后的关联性,如先电解,然后通过开关的闭合,运用电解的产物、电解质又组成原电池,所以分析装置的先后顺序及发生的反应、变化,条理清晰至关重要.
变式练习

1.(2014广东卷)某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其它均为Cu,则( ).
A.电流方向:电极Ⅳ→A→电极Ⅰ
B.电极Ⅰ发生还原反应
C.电极Ⅱ逐渐溶解


2.原电池与电解池互换串联
例5(2014天津卷)已知:
锂离子电池的总反应为
有关上述两种电池说法正确的是( ).
A.锂离子电池放电时, Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.下图表示用锂离子电池给锂硫电池充电


点评由于上例中锂离子电池、锂硫电池都是二次电池,是特殊“另类”的原电池与电解池互换的串联装置,特点是:电动势大的充电原电解池对电动势小的(充电电解池),随着过程中电动势的变化,原电池与电解池发生角色互换,充放电实现电极反应物的再生与消耗,实现电能与化学能间的互换;原则是,一个作原电池时对另一装置即为电解池充电时,原电池的负极要与电解池的阴极相连,正极与阳极相连.
3. 原电池的串联再与电解池串联
例6(2012海南卷)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示.

(1)甲烷燃料电池正极、负极的电极反应分别为____、____.
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是____,电解氯化钠溶液的总反应方程式为____;
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为____(法拉第常数F=9.65×104C·mol-1列式计算),最多能产生的氯气体积为____L(标准状况).



点评本题以原电池串联再与电解池组合的装置形式,考查学生运用所学知识对电化学装置的判断,原电池、电解池的构成条件的电极反应及反应类型、电子、电流方向、原理应用等综合考查,解题时分清装置及连接情况,正确书写电极反应是解答问题的关键所在.例题中正接串联的相同原电池会使电压增大,在电阻不变时,电流增大,会加快电解NaCl饱和溶液的速率,在工业上可提高生产的产率,但要注意电量(电子)的计算,虽然是两个相同的燃料电池装置,通过电解池的电量(电子)只能用一个燃料电池的某电极反应物消耗的量来计算,假若不是相同的原电池串联,通过的电量(电子)以反应物消耗量小的计算,而且通过各个装置的电量(电子)均相等.
总结提升判断装置类型的方法:一看装置中是否存在外加电源,然后再去判断是原电池还是电解池,还是二者的组合,一般情况下无外电源的装置是原电池,若存在外加电源,则是电解池装置或是串联的电解池装置;二是根据装置的两极材料或发生的反应及类型判断原电池、电解池.一般原电池中的电极材料是不同的(燃料电池除外),而电解池电极材料可以是相同的(也可以不同),把握一般规律的同时,也要具体问题具体分析.原电池与电解池串联,把握原则是原电池的负极与电解池的阴极相连,原电池的负极反应式将生成物与反应物颠倒,失去电子变为得到电子,就转变为被电解时阴极的电极反应式,负极与阳极发生的是氧化反应,正极与阴极发生的是还原反应.串联电池的另一特点就是通过每个电极的电子是守恒的(相等),可以建立这种关系进行相互求解,正接串联的相同原电池的通过电子的电量只能依据一个原电池装置消耗的量来计算.
四、吸氧与析氢电化学腐蚀同时存在
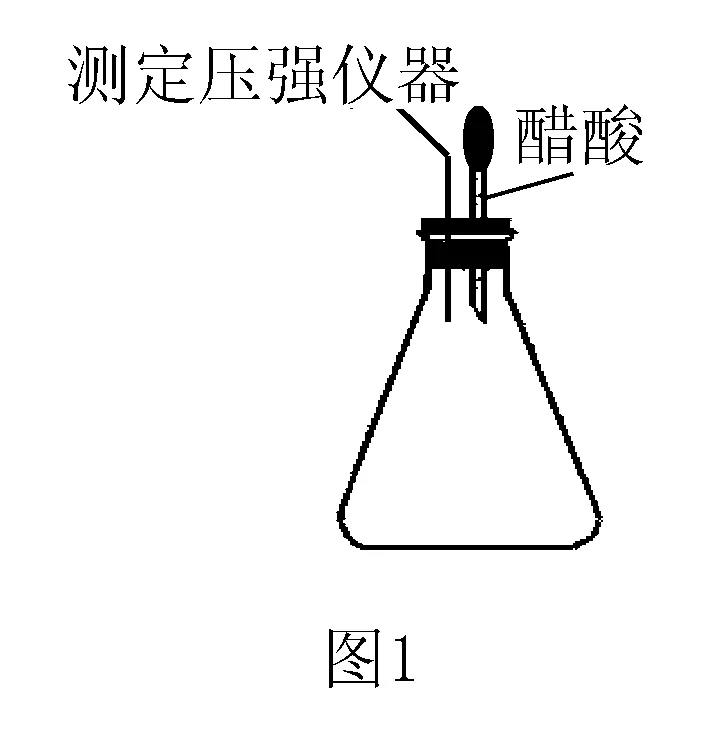
例7(2014年安徽卷)某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
(1)请完成以下实验设计表(表中不要留空格)

编号实验目的碳粉/g铁粉/g醋酸/g①为以下实验作参照0.52.090.0②醋酸浓度的影响0.536.0③0.22.090.0
(2)编号①实验测得容器中压强随时间变化如图2.t2时,容器中压强明显小于起始压强,其原因是铁发生了____腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动的方向;此时,碳粉表面发生了____(填“氧化”或“还原”)反应,其电极反应式为____.

(3)该小组对图2中的0 ~t1时压强变大的原因提出如下假设.请你完成假设二:
假设一:发生析氢腐蚀产生气体;
假设二:____;
……
解析(1)对比实验①和②,结合表格信息可得②是探究醋酸浓度的影响,因此要控制实验②中铁粉的质量要与①相同,即为2.0g.实验探究外界多种因素的影响时,要采取控制变量法,即每次只能改变一个变量加以对比分析.同理,实验③和实验①对比,只有碳粉的质量发生了变化,所以探究的碳粉的质量的影响.

答案:(1)

编号实验目的碳粉/g铁粉/g醋酸/g②2.0③碳粉含量的影响
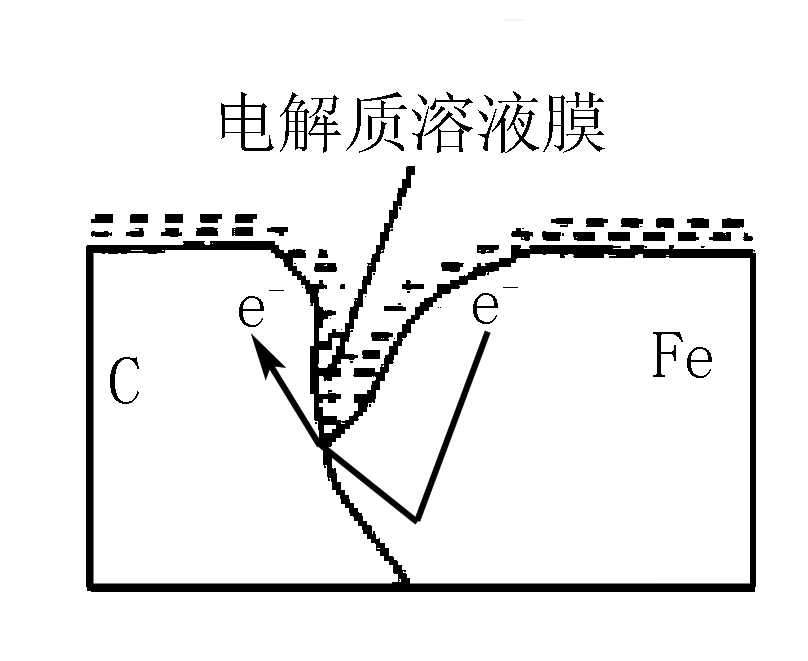
(3)放热反应,温度升高
总结提升本题源于苏教版《化学反应原理》教材的实验探究,体现了高考试题源于课本但高于课本,以基本原理为基础,以真实的实验事实为准绳,本题“另类”考查的情境是在对电化学腐蚀原理深度探究中发现的,真实的实验探究发现析氢腐蚀与吸氧腐蚀是同时存在,只不过在酸性较强的环境中主要以析氢为主,但也存在微弱的吸氧腐蚀,随着反应的进行,酸性减弱,吸氧腐蚀将起主导作用,同样在酸性较弱的或者中性环境中主要以吸氧为主,但也存在微弱的析氢腐蚀.因此金属的腐蚀要颠覆以下片面认识:(1)吸氧与析氢腐蚀不是对立关系,而是可并存统一的;(2)其它金属也可发生析氢吸氧腐蚀;教材以钢铁为例,以点带面来探讨其腐蚀的原理、危害及防护,高考试题曾涉及过锌铜等其它金属的吸氧腐蚀;(3)腐蚀最严重的区域并不是生锈最多,由于微粒是不停地运动的,产生沉淀和锈迹的位置与离子的迁移速度以及介质的浓度、位置等有关.因此要把握自然中量变引起质变,对立与统一规律,用化学学科核心素养中“动态变化观念”思考分析化学问题.
五、有悖于放电顺序的离子在电极上的放电
例8 (2018全国Ⅱ卷)我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
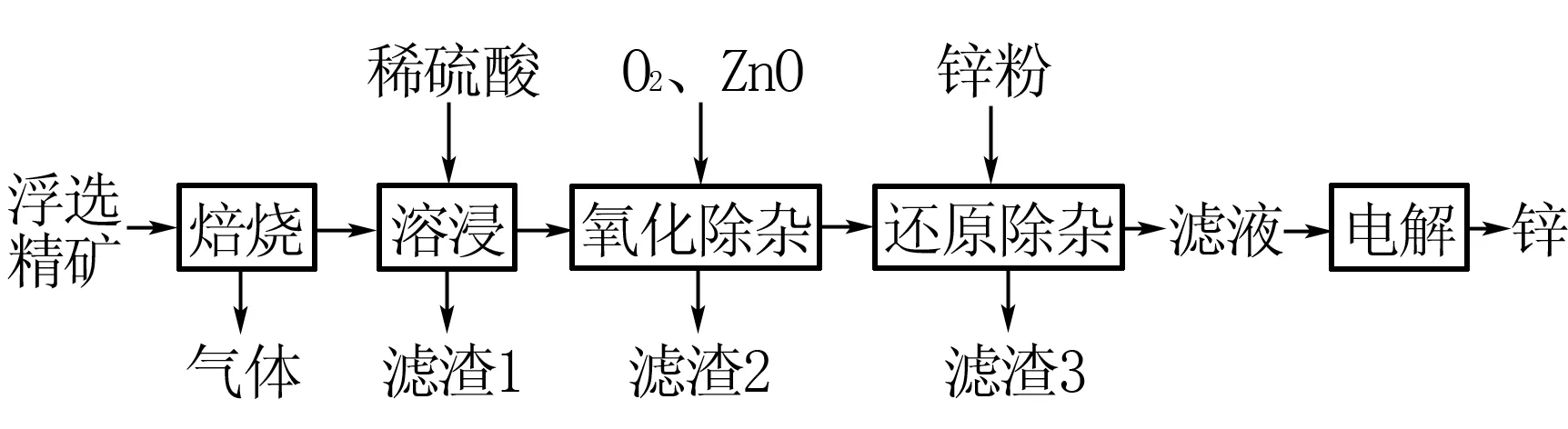
电解硫酸锌溶液制备单质锌时,阴极的电极反应式为____;沉积锌后的电解液可返回____工序继续使用.

点评酸性环境中放电顺序是H+>Zn2+,但由于析氢过电位的存在,使H+得电子生产H2变得困难,而且不同金属电极上的析氢过电位差异也很大,如果具有较低的析氢过电位,则产生H2越容易,反之越难.所以在电解硫酸锌溶液制备单质锌时,通过选择析氢过电位高的电极材料致使H+难以放电,同时Zn2+浓度较大也使其优先放电,说明放电的情况受到析氢过电位、离子浓度等因素的影响.



例10(2014北京卷)用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol·L-1FeCl2溶液,研究废液再生机理.记录如下(a、b、c代表电压值:)

序号电压/V阳极现象检验阳极产物Ⅰx≥a电极附近出现黄色,有气泡产生有Fe3+、有Cl2Ⅱa>x≥b电极附近出现黄色,无气泡产生有Fe3+、无Cl2Ⅲb>x>0无明显变化无Fe3+、无Cl2
(1)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出有关反应的离子方程式____.
(2)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有____性.
(3)Ⅱ中虽未检测出Cl2,但Cl-在阳极是否放电仍需进一步验证.电解pH=1的NaCl溶液做对照实验,记录如下:

序号电压/V阳极现象检验阳极产物Ⅳa>x≥c无明显变化有Cl2Ⅴc>x≥b无明显变化无Cl2
①NaCl溶液的浓度是____mol·L-1.
②Ⅳ中检测Cl2的实验方法:____.
③与Ⅱ对比,得出的结论(写出两点):____.

(2)由Ⅱ推测,Fe2+化合价可升高,具有还原性.可能是Fe2+在阳极放电产生Fe3+的原因;
(3)①电解pH=1的NaCl溶液与电解pH=1的0.1 mol·L-1FeCl2溶液做对照试验,探究Cl-是否放电,需要控制相同的条件下进行,所以NaCl溶液的浓度为0.2 mol·L-1;②检验Cl2:取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,若试纸变蓝色则生成Cl2,否则无Cl2生成;③电解pH=1的NaCl溶液做对照试验与Ⅱ对比可知,通过控制电压证明了Fe2+还原性大于Cl-优先放电,说明生成铁离子的两种可能,一是Fe2+在阳极放电产生Fe3+,二是Cl-阳极放电产生Cl2,Cl2氧化Fe2+生成Fe3+,实验Ⅳ的电压高,Cl-放电,实验Ⅴ电压低,Cl-不放电,因此与Ⅱ对比得出的结论为:通过控制电压,证实了产生Fe3+的两种原因;通过控制电压,验证了Fe2+先于Cl-放电.
点评电解质溶液中发生的电极反应的实质依据是氧化性、还原性强弱,而氧化性还原性的强弱受到浓度、温度等诸多因素的影响,因此电解的离子的放电顺序受到电解所处的环境的温度、电解质的浓度、性质、电极材料、电流密度等影响,例题中就Cl-和OH-而言,在酸性或中性条件下,Cl-浓度较大时或者电压(电流密度)较小时,Cl-优先放电(实验IV),在碱性条件下,Cl-浓度较小时或者电压(电流密度)较大时,OH-优先放电(实验V),在特定条件下还会出现同时放电的情况;例题中Fe2+、Cl-的放电顺序同样如此,电压较大时Cl-先于Fe2+放电产生Cl2,电压较小时Fe2+先于Cl-放电,特定条件下也会出现同时放电,因此所谓的放电顺序只是一般规律,要具体问题具体分析,随机应变,融会贯通才会将知识学“活”.

综上所述,高考中以真实的生产情景为背景依据的“另类”电化学试题是对原理的深度挖掘衍生而来的,体现了命题方向由知识立意向能力立意的重要转变,是传承中的变化创新.因此在备考中客观、动态、发展的看待问题,思维不被禁锢,敢于质疑,不唯书、不唯上、只唯实才能符合化学学科素养所提出“创新意识”和“科学态度”的要求.

