质子守恒真正的内涵
尹丽京 尹家林
(1.浙江省嵊州市高级中学 312400;2.辽宁省大连市辽宁师范大学附属中学 116023)
电解质溶液的三大守恒是高考经常考查的知识点,其中质子守恒是个难点,尽管质子守恒的关系可以由电荷守恒与物料守恒推导得到,但是如果能引导学生直接推导出来,可以加深学生对溶液中平衡的理解和运用.本文从三个层次来阐述质子守恒,并不断推进从而揭示质子守恒真正的内涵.
第一层次:水电离守恒,即电解质溶液中,水电离出的H+与OH-总数(浓度)一定是相等的.

水电离产生的部分OH-被NH4+结合生成NH3·H2O,所以质子守恒:c(H+)=c(OH-)+c( NH3·H2O).

第二层次:质子守恒,即电解质溶液中,基准态微粒得到或失去质子(H+)数相等.
借助框图法分析NaHS溶液中得失质子(H+)过程见图1:

由图可得:c(H+)+c(H2S)=c(S2-)+c(OH-),如果移项,也可得c(OH-)=c(H+)+c(H2S)-c(S2-).
但是,有的材料利用该法分析NH4Cl溶液的质子守恒,过程见图2:
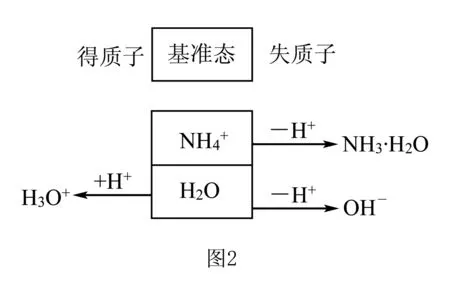
很明显,微粒携带的电荷降低了!电解质溶液呈电中性,有的微粒携带的电荷降低了,必然有的微粒携带的电荷升高了,电荷升高总数和电荷降低总数应该相等,溶液仍维持电中性,因此推进到第三层次.
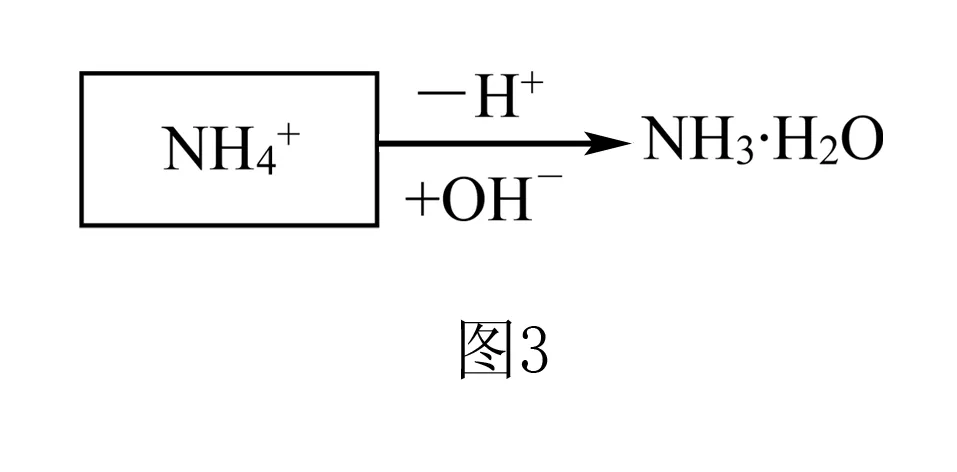
第三层次:电荷守恒,即电解质溶液中,基准态微粒电荷升高总数和电荷降低总数相等,溶液仍维持电中性.则NH4Cl溶液的质子守恒过程见图4:

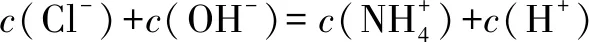
从电荷守恒的角度分析质子守恒有两个优点:
①微粒种类与平衡过程高度契合:直接按照溶液中各平衡过程写出微粒即可,不用解释H2O得到H+形成水合氢离子H3O+,直接把H2O电离出的OH-和H+写在两边即可;

从电荷升降的角度教师很容易切入,学生也容易接受,有点类似化合价升降,同时从电荷守恒的角度,学生也很熟悉.越是本质的,越简单.以上是作者在教学过程中的一点教学体会,不足之处请多批评指导.

