藏母羊妊娠期日粮蛋白水平对初生羔羊GH 基因表达的影响
姜洋洋 侯生珍 王志有
(青海大学农牧学院,青海西宁810000)
GH基因是提高动物的生长发育和生理活动的调节基因,不同的动物或同一种动物在不同生产水平下生长速度有显著差异,这与其生长激素基因的表达水平紧密相关。GH基因生物学功能是促生长,动物通过自己的生长轴内分泌系统,从下丘脑直接分泌生长激素,释放激素和生长抑素到垂体,促进生长激素的分泌,通过血液循环和肝脏表面的生长激素受体结合启动细胞内信号传导机制,通过对二聚体的构象变化,促进肝脏器官的胰岛素生长[1-2]。生长激素是整个生长轴上最重要的激素,是动物生长的关键调控因子,刺激骨骼和软骨的发育,加速脂肪分解代谢,促进动物的生长发育[3-4]。生长激素调节三大营养物质代谢,糖的转化和氧化,蛋白质合成和氨基酸运输,脂肪组织的合成需要酶的协助,生长激素可能会干扰脂肪酶的合成,转录抑制酶的活性,从而降低脂肪组织的合成速度[5]。从分子营养的角度来看,动物个体对营养物质的需求是不同的,动物对营养物质的消化、吸收和利用是否受到基因表达和调控的影响,研究不同蛋白质水平对绵羊生长发育及GH分泌、基因表达的作用,阐明饲料中蛋白质水平对绵羊生长发育及GH分泌、基因表达的影响具有重要意义。
1 材料与方法
1.1 试验时间与地点
试验时间:2018年8月~2019年3月。
试验地点:试验母羊妊娠前期放牧饲养地点在刚察县沙流河镇尕曲村,妊娠后期舍饲饲养地点在海东市乐都金元牧业有限公司。
1.2 试验动物及试验设计
试验选择60 只年龄、胎次、体况相近的藏母羊;对试验母羊同期发情处理,确保在同一时间发情期受胎;母羊妊娠前期(0~85 d)在天然草场放牧饲养;妊娠后期(86~150 d)将母羊随机分为2 组,每组30 只,进行全舍饲饲养,分别饲喂消化能相同而蛋白水平为7.5%和13.5%的日粮。母羊分娩后,每组选取3 只初生羔羊进行屠宰,采集瘤胃、网胃、瓣胃、皱胃、十二指肠、空肠、回肠、心脏、肝脏、肺脏、肾脏、肌肉等组织样,样品液氮保存待测。
1.3 饲养管理
试验母羊采用前列腺醇同期发情处理(1 ml/只,2次,间隔12 d),第二次处理后按1∶10的比例投放种公羊进行集中配种。母羊妊娠前期(0~85 d)然草场放牧饲养,放牧草场为高寒草甸草场,早晨7:00 出牧,晚上20:00归牧。母羊妊娠后期(86~150 d)全舍饲饲养,试验开始之前对圈舍进行消毒处理,试验母羊于每天早上8:00和下午18:00饲喂全混合日粮2次,自由采食,自由饮水;每天对料槽和水槽进行清洗,圈舍每周进行消毒,保持圈舍卫生、干燥、通风;试验羊定期进行接种防疫。
1.4 试验饲粮
参照NRC(2013)绵羊营养需要量标准和我国《肉羊饲养标准》,结合藏羊体重和营养需要特点,进行藏母羊妊娠后期饲粮配方设计,饲粮组成及营养水平见表1。

表1 饲粮组成及营养水平(干物质基础)
1.5 测定指标及方法
1.5.1 总RNA的提取
将采集的组织样品采用液氮研磨的方法充分粉碎,使用北京天根生化科技有限公司的总RNA 提取试剂盒并按照操作步骤提取样品RNA。总RNA浓度和纯度采用核酸定量仪进行检测,确保总RNA 浓度在100 ng/μl 以上,A260/280 和A260/230 的OD 值在2~2.5 之间。1%的琼脂糖凝胶电泳检测RNA 的完整性或是否有蛋白质和DNA污染。
1.5.2 RNA反转录cDNA
利用北京天根生化科技有限公司FastKing RT kit cDNA的第一链合成试剂盒将提取的总RNA进行反转录。所有的操作都是在冰上进行的,实验室设备必须先用RNase固相去除器进行处理。
1.5.3 引物的设计与合成
利用https://www.ncbi.nlm.nih.gov/gene/网站设计定量PCR 引物,确定引物序列,以GAPDH 为内参基因,由上海生工生物工程有限公司进行引物合成引物序列,产物长度及退火温度如表2所示。

表2 引物信息
1.5.4 荧光定量PCR扩增
使用北京天根生化科技有限公司的SuperReal PreMix Color(SYBR Green)试剂盒,利用Rotor-Gene Q 实时定量PCR 仪测定目标基因在羔羊不同部位组织中的mRNA 表达量,每个样品重复3 次,内参基因为GAPDH。反应条件中预变性、变性及退火的循环次数为40。具体反应体系和条件见表3和表4。

表3 PCR反应体系
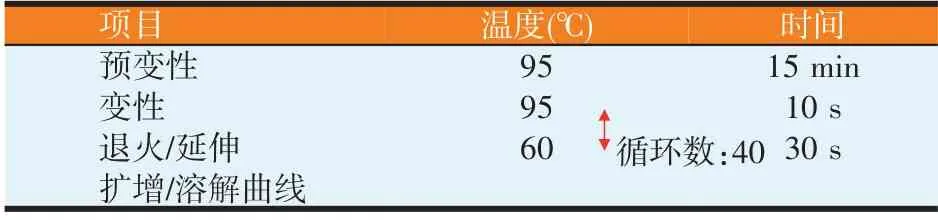
表4 PCR反应条件
1.6 统计分析
将试验所得数据运用SPSS 20.0 软件进行分析,结果采用“平均值±标准差”的形式表示。
2 结果
2.1 GH 基因在羔羊不同内脏器官及肌肉组织中表达量的比较
由表5和图1可见,试验Ⅱ组初生羔羊心脏、肝脏、肺组织中GH基因的表达量明显高于Ⅰ组(P<0.05)。

表5 GH基因在羔羊不同内脏器官及肌肉组织中表达量
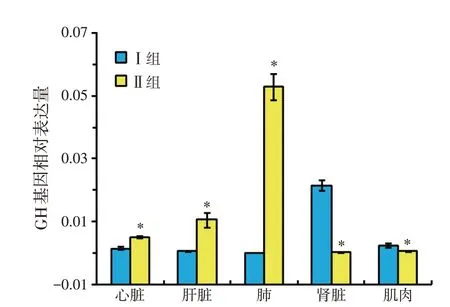
图1 GH基因在羔羊不同内脏器官及肌肉组织中表达量
2.2 GH基因在初生羔羊不同胃肠道中表达量比较
由表6 和图2 可见,初生羔羊瓣胃、皱胃、空肠中GH基因的表达量,试验Ⅱ组显著高于Ⅰ组(P<0.05),而瘤胃、十二指肠和回肠中GH基因的表达量,Ⅰ组和Ⅱ组间无显著差异(P>0.05)。
3 讨论
3.1 藏母羊妊娠后期日粮蛋白水平对初生羔羊内脏器官及肌肉GH基因表达量的影响
GH基因是调节生长和发育过程中生长激素生长和分泌的关键生长因子,具有促进肌肉和骨骼生长,促进动物生长发育,提高饲料报酬的作用。GH 基因存在于羔羊各个内脏器官和胃肠道及肌肉组织,其表达有显著差异。章玲玲等[6]对家禽心脏、肝脏、脾脏、肺、肾脏和肌肉中GH 基因表达量进行了研究,证明GH 基因在肌肉组织表达量最低,肺中的表达量最高。张玲等[7]在研究不同日粮营养水平对番鸭GH基因在肌肉组织中表达情况的实验中发现,在番鸭早期生长发育过程中,GH 基因表达会因日粮营养水平的不同而出现差异。本试验结果表明,在两种蛋白水平下,肾脏和肺中GH基因的表达量分别为最高和最低,这与前人的研究结果有相似之处,具有区别的原因可能是所选试验物种的差异亦或营养水平设置梯度的差异。藏母羊妊娠后期日粮蛋白水平为13.5%时,初生羔羊心、肝、肺组织中GH 基因的表达量明显高于7.5%蛋白组(P<0.05),说明妊娠后期提高藏母羊日粮蛋白水平能显著提高胎儿内脏和肌肉组织的生长发育,此结果与张玲的研究结果一致。

表6 GH基因在羔羊不同胃肠道中表达量

图2 GH基因在羔羊不同胃肠道中表达量
3.2 藏母羊妊娠后期日粮蛋白水平对初生羔羊胃肠道GH基因表达量的影响
肠道的生长发育受多种因素的影响,如遗传、养分、环境和神经内分泌等。肠道具有两方面作用,既作为消化和吸收养分物质的重要器官,又是保持机体内环境稳定的先天性屏障。十二指肠是重要的消化器官,担负着消化和吸收机体所需的大多部分养分物质的功能。因此,十二指肠发育的状况在很大程度上决定动物的生长速度[8]。殷新平[9]对黄颡鱼生长激素基因全长进行克隆测序,分析GH 在组织中的差异性表达,结果表明GH基因只在垂体中特异表达,而在肌肉、脾脏、脂肪、肾脏、胃、盲肠、心脏、头肾、精巢、肠、鳃、肝脏、鱼皮和脑这14 个组织中均未检测到表达。曹运长等研究表明,垂体中GH 表达量与肾脏相比差异极显著,垂体GH 基因表达量较高与蓝太阳鱼表达结果一致,在胃中检测不到表达。胃的生长发育也离不开GH的调节,前人实验已相继表明在大鼠、兔子和人的胃中有GHr 基因的表达[10]。Nagano M(1995)用RT-PCR 结合Southern 杂交的方法也检测出在人、大鼠和兔子胃组织中有GHr 的表达,以上研究结果表明,GH 对胃的生长有重要的调节作用。本试验结果表明,藏母羊妊娠后期日粮蛋白水平为13.5%时,初生羔羊的瓣胃、皱胃、空肠GH基因表达量均显著高于7.5%蛋白组(P<0.05),而瘤胃、十二指肠和回肠中GH基因的表达量,7.5%蛋白组和13.5%蛋白组间无显著差异(P>0.05)。
4 结论
本试验条件下,藏母羊妊娠后期日粮蛋白水平为13.5%时,初生羔羊心脏、肝脏、肺、瓣胃、皱胃、空肠中GH基因的表达量明显高于7.5%蛋白组(P<0.05),妊娠后期提高藏母羊日粮蛋白水平能显著提高胎儿内脏器官、肌肉组织和胃肠道的生长发育。

