经导管栓塞联合射频消融对兔VX2肝肿瘤的干预效果
琚书光,段旭华,韩新巍,任建庄,李 浩,李凤尧,王满周
(郑州大学第一附属医院放射介入科,河南 郑州 450052)
经导管治疗包括经导管动脉栓塞术(transcatheter arterial embolization, TAE)和TACE,已广泛用于治疗无法切除的肝癌[1-2]。射频消融(radiofrequency ablation, RFA)可以根治早期肝癌[3]。TACE或TAE联合RFA能增加消融范围,提高RFA效果[4-5]。本研究对比分析TACE或TAE联合RFA对兔VX2肝肿瘤的干预效果。
1 材料与方法
1.1 实验动物及模型制备 日本大耳白兔63只,由河南省实验动物中心提供,雌雄不限,体质量3.0~3.5 kg,许可证编号:SYXK(豫)2016-0002。VX2肿瘤株移植制备:采用Virmani等[6]的方法,将VX2肿瘤块(由华中科技大学同济医学院动物实验中心惠赠)移植入兔肝左内侧叶,移植15天后MRI观察VX2肿瘤是否形成及其大小[7],测量各组瘤体最大层面的最大长径(a)和短径(b)。
1.2 动物分组及处理 将60只成功建立VX2肝肿瘤模型(图1A)的实验兔随机分为4组,每组15只。对TACE+RFA组以0.4 mg阿霉素+0.4 ml碘油进行TACE治疗15 min后行RFA;TAE+RFA组采用150~250 μm聚乙烯醇(polyvinyl alcohol, PVA)颗粒行TAE治疗15 min后行RFA;RFA组仅给予RFA;TACE组仅给予TACE(图1B、1C)。TACE、TAE均在Siemens Artis Q Zeego DSA机引导下进行,RFA操作过程参照文献[7]。
1.3 相关指标观察
1.3.1 肝功能 分别在术前1天及术后3、7天自兔耳缘静脉采集血液标本,离心后取血清,采用标准酶法测定血清天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase, ALT)水平。
1.3.2 肿瘤生长率、肿瘤坏死率及Suzuki评分 于术后1、3、7天各组分别处死5只兔。TACE+RFA组、TAE+RFA组、RFA组均沿射频消融针主针道切开消融肝组织,每隔3~5 mm分片,测量瘤体最大长径(a)和短径(b);TACE组沿长轴切开肿瘤,于最大切面测量最大长径(a)和短径(b)。分别测量各组瘤体切面坏死区长径(c)和短径(d)。
参照文献[8]方法计算术后7天肿瘤生长率、肿瘤坏死率:肿瘤生长率=肿瘤体积术后/肿瘤体积术前×100%,肿瘤体积=1/2ab2,肿瘤坏死率=cd/ab×100%。将肿瘤组织置于4%多聚甲醛中固定,石蜡包埋后4 μm厚切片,常规HE染色后行Suzuki评分[9],评价坏死区或凝固区周围肝组织损伤程度。
1.3.3 热休克蛋白70(heat shock protein 70, HSP70)表达 参照文献[10]方法对坏死区或凝固区肝组织行HSP70免疫组织化学染色。由2名高年资病理科医师在200倍镜下以盲法进行评价,TACE组在肝脏坏死区周围组织取图,RFA组、TAE+RFA组和TACE+RFA组在肝脏凝固坏死区周围组织取图。Image-Pro Plus Software(version 6.0)软件分析图像,自动计算HSP70累计光密度(integrated optical density, IOD)。
1.3.4 凋亡指数 采用TUNEL法检测坏死区或凝固区周围肝细胞凋亡指数,凋亡指数为每张切片中每100个细胞中阳性细胞数。在200倍镜下计算每个视野阳性细胞数平均值,每个样本评估5个视野,取平均数作为结果。
1.3.5 增殖指数 采用免疫组织化学染色检测坏死区或凝固区周围肝组织Ki-67表达,计数每张切片中6个200倍视野内Ki-67阳性细胞数,计算增殖指数。增殖指数为每个视野中Ki-67阳性细胞数占肝细胞总数的百分比。
1.4 统计学分析 采用SPSS 21.0统计分析软件。符合正态分布的计量资料以±s表示,采用Kruskal-WallisH检验或Mann-WhitneyU检验比较各组间、同组不同时间点间各指标差异。P<0.05为差异有统计学意义。
2 结果
成功建立60只兔VX2肝肿瘤模型,肿瘤最大径11.52~16.91 mm,平均(12.78±3.53)mm。
2.1 血清ALT、AST 4组兔术前1天血清ALT和AST水平差异均无统计学意义(P均>0.05)。术后3、7天TACE+RFA组ALT、AST水平均高于其他3组,术后3天TACE+RFA组、TAE+RFA组、TACE组均高于术前1天及术后7天,术后3、7天TACE组均高于TAE+RFA组、RFA组,术后3天TAE+RFA组均高于RFA组(P均<0.05)。见表1。
2.2 肿瘤生长率、肿瘤坏死率及Suzuki评分 术后7天TACE+RFA组Suzuki评分高于其他3组,TACE+RFA组、TAE+RFA组肿瘤生长率均低于RFA组和TACE组(P均<0.05),肿瘤坏死率均高于RFA组和TACE组(P均<0.05)。见表2。
2.3 HSP70表达 术后1、3、7天4组坏死区或凝固区周围肝组织HSP70表达均逐渐升高(P均<0.01)。术后1、3、7天TACE+RFA组HSP70表达均高于其他3组(P均<0.01);术后1、3天TAE+RFA组HSP70表达均高于TACE组和RFA组(P均<0.05)。见表3。
2.4 凋亡指数 术后1、3、7天4组坏死区或凝固区周围肝细胞凋亡指数均逐渐降低(P均<0.01)。术后1、3、7天TACE+RFA组凋亡指数均高于其他3组(P均<0.01),术后1、3天TACE组均高于TAE+RFA组、RFA组(P均<0.05)。见表4、图2。
2.5 增殖指数 术后3天4组肝细胞增殖指数均高于术后1、7天(P均<0.05)。术后1、3、7天TAE+RFA组增殖指数均高于其他3组(P均<0.05),术后1、3天RFA组均高于TACE+RFA组和TACE组(P均<0.05)。见表5、图3。

图1 TACE组影像学表现 A.植入肿瘤15天后,MR T1WI示兔肝左叶见直径约16 mm低信号区; B.TACE术中肝动脉造影示肝左叶富血供占位性病变; C.以碘油乳化液栓塞病变
表1 各组兔不同时间点血清ALT、AST水平比较(U/L,±s)
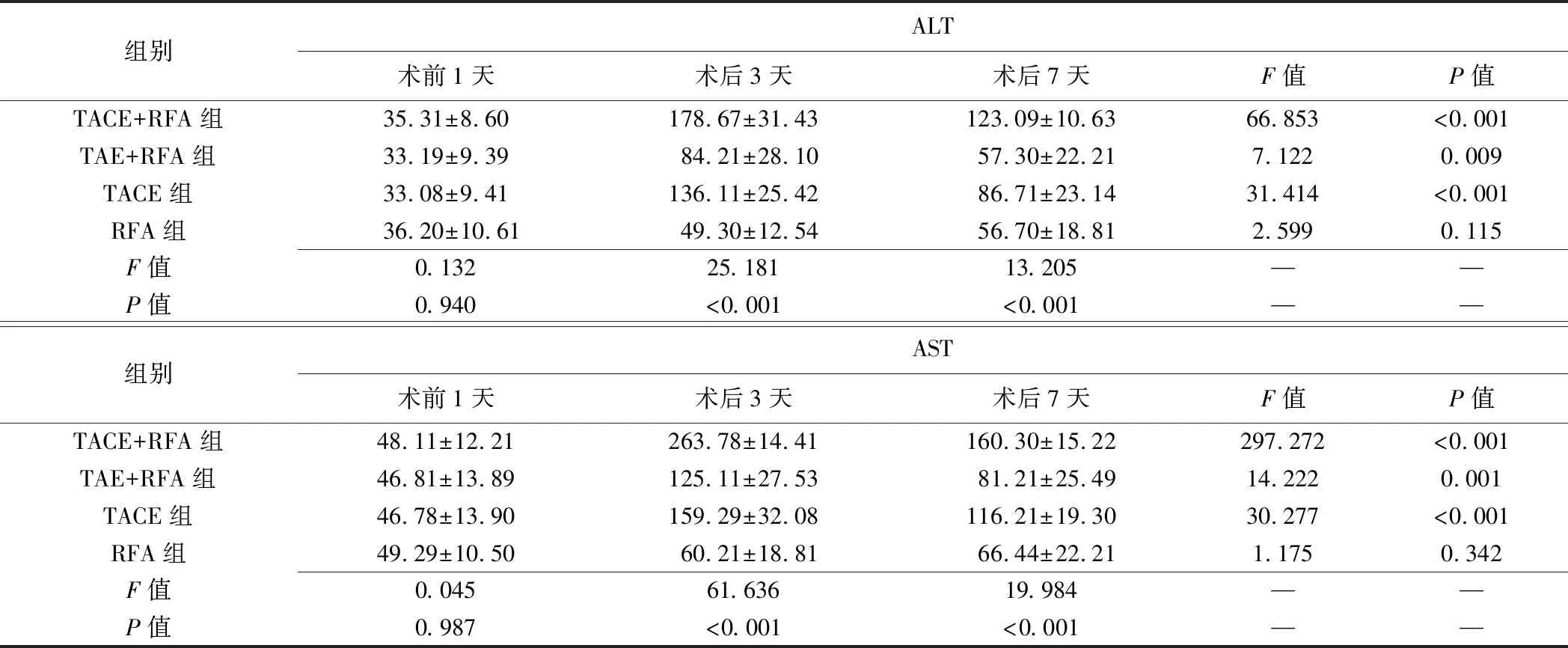
表1 各组兔不同时间点血清ALT、AST水平比较(U/L,±s)
组别ALT术前1天术后3天术后7天F值P值TACE+RFA组35.31±8.60178.67±31.43123.09±10.6366.853<0.001TAE+RFA组33.19±9.3984.21±28.1057.30±22.217.1220.009TACE组33.08±9.41136.11±25.4286.71±23.1431.414<0.001RFA组36.20±10.6149.30±12.5456.70±18.812.5990.115F值0.13225.18113.205——P值0.940<0.001<0.001——组别AST术前1天术后3天术后7天F值P值TACE+RFA组48.11±12.21263.78±14.41160.30±15.22297.272<0.001TAE+RFA组46.81±13.89125.11±27.5381.21±25.4914.2220.001TACE组46.78±13.90159.29±32.08116.21±19.3030.277<0.001RFA组49.29±10.5060.21±18.8166.44±22.211.1750.342F值0.04561.63619.984——P值0.987<0.001<0.001——
表2 各组兔术后7天肿瘤生长率、坏死率及Suzuki评分比较(±s)
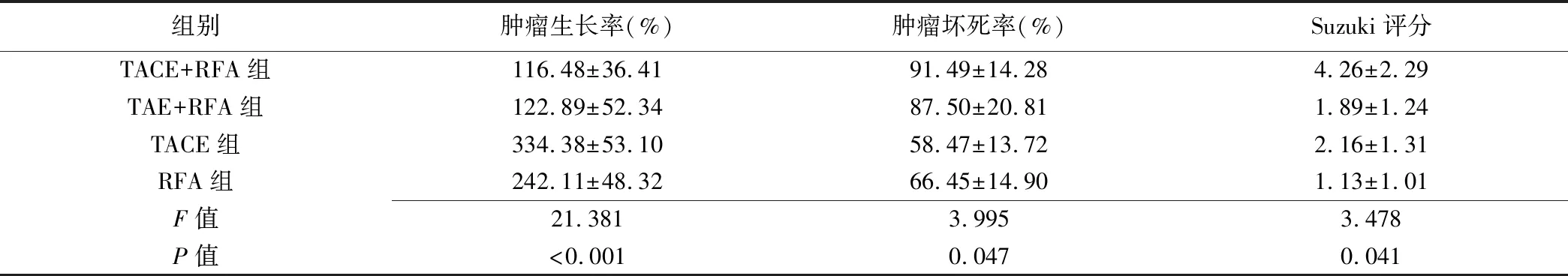
表2 各组兔术后7天肿瘤生长率、坏死率及Suzuki评分比较(±s)
组别肿瘤生长率(%)肿瘤坏死率(%)Suzuki评分TACE+RFA组116.48±36.4191.49±14.284.26±2.29TAE+RFA组122.89±52.3487.50±20.811.89±1.24TACE组334.38±53.1058.47±13.722.16±1.31RFA组242.11±48.3266.45±14.901.13±1.01F值21.3813.9953.478P值<0.0010.0470.041
表3 各组兔术后不同时间点坏死区或凝固区周围肝组织HSP70表达的IOD值比较(±s)

表3 各组兔术后不同时间点坏死区或凝固区周围肝组织HSP70表达的IOD值比较(±s)
组别术后1天术后3天术后7天F值P值TACE+RFA组2 618.12±153.4915 981.20±3 108.2229 750.20±4 121.53103.510<0.001TAE+RFA组2 142.32±330.6112 210.20±3 462.9021 158.29±4 412.2543.004<0.001TACE组1 247.54±191.488 158.15±1 996.7114 526.20±4 468.1527.580<0.001RFA组976.32±341.167 283.90±2 875.2012 304.50±5 673.3211.9130.001F值41.0039.46413.868——P值<0.0010.001<0.001——
表4 各组兔不同时间点坏死区或凝固区周围肝细胞凋亡指数比较(个,±s)

表4 各组兔不同时间点坏死区或凝固区周围肝细胞凋亡指数比较(个,±s)
组别术后1天术后3天术后7天F值P值TACE+RFA组25.67±2.1116.45±3.4211.29±3.8825.512<0.001TAE+RFA组10.32±3.899.80±2.403.32±1.909.3120.004TACE组17.20±1.3112.10±1.565.81±2.2154.049<0.001RFA组7.53±3.196.92±2.511.51±0.589.7960.003F值41.74312.57515.145——P值<0.001<0.001<0.001——
3 讨论
Li等[11]发现TACE治疗过程中适当减少化学治疗药物剂量和次数对近期疗效无影响,且可保护肝功能,有益于长期预后。尹建等[12]认为TACE+RFA治疗肝癌近中期疗效优于单纯RFA治疗,远期疗效无明显差异。Bonomo等[13]采用TAE+RFA治疗不能切除的直径16~59 mm肝癌,获得与TACE+RFA相近疗效。
表5 各组兔不同时间点坏死区或凝固区周围肝细胞增殖指数比较(%,±s)

表5 各组兔不同时间点坏死区或凝固区周围肝细胞增殖指数比较(%,±s)
组别术后1天术后3天术后7天F值P值TACE+RFA组6.67±2.1011.53±3.408.33±3.523.8730.044TAE+RFA组15.30±3.9124.81±2.4212.31±1.8925.856<0.001TACE组5.21±1.328.11±1.586.78±2.214.1580.037RFA组9.53±3.1914.89±2.518.50±2.617.5810.007F值12.58339.7473.998——P值<0.001<0.0010.027——

图2 术后1天肝脏坏死区或凝固区周围见典型TUNEL染色(箭示阳性细胞,×200) A~D.分别为TACE组、RFA组、TACE+RFA组及TAE+RFA组

图3 术后3天肝脏坏死或凝固区周围见Ki-67阳性细胞(箭,×200) A~D.分别为TACE组、RFA组、TACE+RFA组及TAE+RFA组
经导管治疗联合RFA治疗不可切除肝癌临床疗效确切,但肝功能损伤情况罕见报道。本研究对肝肿瘤兔模型分别给予TACE+RFA、TAE+RFA、TACE、RFA治疗,通过肿瘤生长率和坏死率观察肿瘤控制情况,以ALT、AST分析肝功能变化,检测消融坏死区或凝固区周围肝细胞HSP70表达和细胞增殖观察肝细胞恢复能力,以肝细胞凋亡判断肝组织损伤程度,发现TACE+RFA较TAE+RFA、RFA或TACE更能有效地破坏肿瘤,而控制肿瘤效果与TAE+RFA无显著差异,与前期研究[7]结果相符;但TACE+RFA治疗所致肝功能损伤最为严重,而TAE+RFA治疗肝功能损伤相对较轻,可能与后者不存在化学药物所致细胞毒性作用有关[7,14]。
高温、化学药物和缺氧等均可诱导细胞高表达HSP70[15]。RFA动物肝脏后,HSP70是肝组织消融区周围肝细胞内最主要的热休克蛋白[16],具有保护细胞结构、促进细胞存活、促进受损细胞恢复、抑制消融区外周细胞凋亡和坏死等作用[15]。本研究中,术后1、3、7天TACE+RFA组肝组织HSP70表达和肝细胞凋亡均最多,提示TACE联合RFA治疗中消融区周围肝细胞受到的热损伤、缺氧及细胞毒性损伤最大,更多肝细胞需要从可逆细胞损伤状态中恢复;术后7天TAE+RFA组、TACE组和RFA组HSP70表达差异无统计学意义,提示上述3种治疗方式下肝细胞更易修复。4组实验兔术后3天坏死区或凝固区周围肝细胞增殖指数均高于术后1天,术后7天始逐渐回落,提示术后7天内肝脏功能趋于恢复正常。TAE+RFA组术后1、3、7天增殖指数均高于TACE+RFA组及TACE组,提示其肝功能损伤更小,可能是治疗肝癌更有益的方法。但本研究仅观察至术后7天,尚待进一步研究。