变应性鼻炎模型大鼠翼腭神经节和鼻黏膜中垂体腺苷酸环化酶激活多肽的表达观察
汪斌如,杨丽萍,梁耕田,刘莉,吴庭
(武汉市第三医院,武汉43006)
神经肽在变应性炎症网络系统中起着重要的调节作用,人类鼻黏膜的神经肽与其相应位点结合后,可以扩张血管、增加血浆蛋白外渗和促进腺体细胞分泌[1,2]。来源于鼻黏膜及翼腭神经节的神经肽主要是通过免疫反应调节鼻黏膜下微血管流量和腺体分泌而参与变应性鼻炎(AR)的发生。目前较多研究[3,4]显示,血管活性肠肽(VIP)可通过免疫反应调节鼻黏膜下微血管流量和腺体分泌而参与AR的发生。垂体腺苷环化酶激活多肽(PACAP)是VIP家族的新成员,其刺激垂体细胞腺苷酸环化酶活性比VIP强1 000倍以上,具有调节血管舒缩、腺体分泌及炎症细胞免疫活性的功能,对哮喘等下呼吸系统疾病具有强大的调节作用,但目前有关PACAP在AR发病机制中的报道较少[5,6]。我们前期研究[7]结果显示,AR大鼠鼻黏膜中有大量的VIP和PACAP表达。推测翼腭神经节可表达PACAP,并释放于鼻黏膜而对AR起调控作用,为验证此假设,本研究于2017年5月~2018年3月通过AR大鼠模型观察了PACAP在翼腭神经节和鼻黏膜中的分布和含量,并观察了PACAP抑制剂-A型肉毒毒素(BTX-A)鼻腔滴入前后AR大鼠翼腭神经节和鼻黏膜中PACAP表达的变化,同时探讨了PACAP在AR发病中可能的作用机制。
1 材料与方法
1.1 实验动物、仪器与试剂 30只健康SD大鼠(武汉大学同仁医院动物实验中心提供,雌雄不限,出生后6~8周,250~300 g,以下简称大鼠)。SPF级实验用高压鼠饲料(江苏协同生物)。BTX-A(兰州生物制品研究所),PACAP-38(A1439,Sigma),PACAP多克隆抗体(GTX37576,Gene Tex),氢氧化铝(上海化学试剂厂),Ⅴ级卵清蛋白(OVA)(Sigma),组化试剂盒DAB显色剂(HRP标记山羊抗兔鼠通用二抗,DAKO),IL-4及IFN-γ(PharMingen),显微镜(OlympusBH-2)。
1.2 大鼠分组、AR模型制作及BTX-A给予方法 20只大鼠依据赵宇等[8]方法进行AR大鼠造模:大鼠腹腔注射30%OVA和佐剂氢氧化铝30 mg配制的混悬液1 mL,2 d/次,共7 次;鼻腔滴入4%利多卡因(抑制鼻腔纤毛运动,延长过敏原在鼻腔作用)后再滴入5%OVA溶液,每侧鼻孔10 μL,1次/d,共7 d。造模成功标准:末次滴鼻后30 min内,对大鼠鼻溢、喷嚏、搔鼻的行为进行叠加量化积分,积分>5分表示造模成功。记分方法如下:清水涕:流至鼻孔为1分,超出前鼻孔2分,涕流满面3分;喷嚏:1~3个为1分,4~10个为2分,11个以上为3分;鼻痒:轻搔鼻1~2次为1分,剧烈搔抓鼻面四周不止为3分,介于两者之间为2分。20只大鼠经评估后均显示AR模型制作成功(积分>5分);对模型大鼠及正常大鼠进行血清炎症因子检测,20只AR模型大鼠血清IFN-γ、IL-4、IFN-γ/IL-4分别为(4.05±2.76)pg/mL、(14.33±4.21) pg/mL、0.41±1.20,10只正常大鼠血清IFN-γ、IL-4、IFN-γ/IL-4分别为(8.02±2.27)pg/mL、(4.89±4.13)pg/mL、1.82±0.20,二者比较,P均<0.05,进一步提示AR模型制作成功。其中10只大鼠作为AR组,血清炎症因子检测后处死进行组织病理学检查。另外10只大鼠作为干预组,于AR造模成功后第2天,以BTX-A盐水浸润的棉条局部填塞双鼻腔7 d,1 h/d,1次/d,共7 d。对照组大鼠仅鼻腔滴入生理盐水21 d。然后对干预组和对照组大鼠进行大鼠行为学评分、组织病理学检查和血清炎症因子检测。
1.3 各组大鼠鼻黏膜和翼腭神经节中PACAP蛋白检测 采用免疫组化SABC法。常规切片脱蜡,PBS清洗标本3次各5 min;3%H2O2孵育10 min,PBS清洗标本3次各5 min;高压修复、清洗后封闭血清孵育,一抗孵育(GTX37576,1∶100),4 ℃过夜,PBS清洗3次各5 min;二抗孵育20 min,SABC液孵育20 min,PBS洗5次各5 min,DAB显色3 min,冲洗,苏木素复染1 min。对照组PBS代替一抗,其余步骤相同。每个标本随机取3张片,每片任选5个视野,光镜下观察并摄片,200倍镜下计数PACAP免疫反应阳性神经元,取平均数。
1.4 各组大鼠鼻腔黏膜、翼腭神经节的炎症情况观察 采用HE染色法。各组大鼠末次滴鼻后进行1%戊巴比妥钠(40 mg/kg)腹腔麻醉,开胸心脏插管,4%多聚甲醛液灌注固定。取双侧鼻腔呼吸区黏膜和翼腭神经节分别固定,石蜡包埋切片,片厚为6 μm。每个标本随机取3张切片,每张切片任选5个视野,视野面积为0.51 mm×0.40 mm。依据Kim等[9]的方法将鼻黏膜纤毛缺失和腺腔内炎性细胞渗出分别分为轻度(<5%)、中度(5%~20%)和重度(>20%),炎性细胞浸润分为轻度(局限于上皮下层)、重度(超出上皮下层累及大部分上皮层)和中度(介于二者之间)。依据鼻黏膜纤毛缺失、炎性细胞浸润及腺腔内炎性细胞渗出的评分分为:正常(-)、轻度(+)、中度(++)和重度(+++),分别计分0分、1分、2分和3分。
1.5 各组血清炎症因子IFN-γ、IL-4的检测 末次滴鼻后取各组大鼠眼后內眦静脉血约2.5 mL,离心机(3 000 r/min)离心20 min,上层血清-70 ℃保存,ELISA法检测血清中IFN-γ、IL-4,严格按照说明书操作。最后用波长490 nm(IL-4) 和450 nm(INF-γ)的酶标仪读取吸光度值,并计算IFN-γ/IL-4。
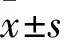
2 结果
AR组10只大鼠均出现大量清涕、连续喷嚏和剧烈抓鼻周等动作,这些动作在2 h后逐渐减轻。干预组大鼠鼻分泌量、喷嚏次数及剧烈抓鼻周动作减少。对照组大鼠无明显鼻腔分泌物,仅出现轻微喷嚏和抓鼻周的动作。AR组大鼠行为学评分(7.1±1.17)高于干预组(1±0.27)和对照组(0.8±0.31) (P均<0.01)。
2.1 各组翼腭神经节、鼻黏膜PACAP阳性细胞表达部位及阳性细胞数比较 AR组翼腭神经节内含有大量PACAP阳性神经元,多为椭圆形,胞质淡黄色,分布有较多棕黄色颗粒,胞核无染色,分布无明显区域特异性,多聚集成群。AR组鼻黏膜内有较多PACAP阳性神经元表达,PACAP主要分布于鼻黏膜上皮细胞、腺体细胞质和血管周围。干预组鼻黏膜有少量PACAP纤维分布于上皮与细胞之间,小血管和腺体周围亦有少量表达。干预组鼻腔上皮固有层及翼腭神经之间均有少量PACAP阳性神经元表达,主要集中于神经节膨大部分。对照组大鼠鼻黏膜及翼腭神经节内少量的PACAP阳性神经元表达。
AR组、干预组、对照组鼻黏膜PACAP阳性细胞数分别为(20.97±2.14)、(8.33±3.04)、(4.63±1.25)个/HP,翼腭神经节黏膜PACAP阳性细胞数分别为(25.25±4.56)、(8.26±2.27)、(7.15±3.64)个/HP,AR组鼻黏膜和翼腭神经节中PACAP阳性细胞数高于对照组和干预组(P均<0.01);干预组鼻黏膜PACAP阳性细胞数高于对照组(P<0.01)。
AR组大鼠鼻黏膜不同程度水肿,大量炎性细胞浸润,基底层增厚、伴有大量的嗜酸性粒细胞,以腺体和小血管周围明显。干预组大鼠鼻黏膜上皮结构基本完整,纤毛无明显脱落,腺泡细胞轻度扩张,无明显炎性渗出,腺管细胞胞质疏松,少见嗜酸性粒细胞浸润。对照组大鼠鼻黏膜纤毛整齐,无脱落,黏膜无水肿,小血管和毛细血管无扩张,少见或不见嗜酸性粒细胞。AR组鼻黏膜纤毛缺失、炎性细胞浸润、腺腔内炎性细胞渗出高于干预组(Z分别为-3.278、-3.411、-3.754,P<0.05或0.01)和对照组(Z分别为-3.894、-4.141、-4.108,P均<0.01),干预组与对照组比较,Z分别为-1.139、-1.826、-1.453,P均>0.05,见表1。

表1 各组大鼠鼻黏膜病理损伤程度 (例)
2.2 各组血清IFN-γ、IL-4、IFN-γ/IL-4水平比较 与干预组和对照组比较,AR组血清IFN-γ降低,IL-4升高、IFN-γ/IL-4降低,干预组与对照组比较,P均>0.05,见表2。
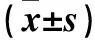
表2 各组血清IFN-γ、IL-4水平及IFN-γ/IL-4比较
3 讨论
Th1/Th2细胞及其细胞因子免疫失衡是AR的免疫学基础,当机体接触变应原后,在INF-γ、IL-4等因素刺激下,Tho细胞选择性地分化,出现Th1细胞功能抑制和Th2细胞功能活化亢进,从而出现IgE介导的免疫应答反应[10~13]。本研究结果显示,AR大鼠血清中Th1类细胞因子IFN-γ显著降低,Th2类细胞因子IL-4显著升高,血清IFN-γ/IL-4比例下降反映Th1/Th2细胞失衡在AR的炎症反应中起着重要作用[14,15]。AR最终会引起的一系列鼻黏膜变态炎性反应,由大鼠的行为学评分、鼻黏膜病理学变化可知,AR组大鼠鼻腔黏膜出现纤毛损伤、炎性细胞浸润和腺腔渗出,导致大鼠出现鼻塞、喷嚏、鼻痒等症状,而BTX-A对AR的炎症具有抑制作用。
VIP可通过调控Th1/Th2表达而在AR中发挥重要作用,对鼻黏膜血管舒张和腺体分泌起重要的调节作用[16,17]。PACAP为神经肽家族重要成员,存在于小支气管平滑肌及相应肺血管和浆液黏液腺周围,可调节血管舒缩、腺体分泌及炎症细胞免疫活性,对哮喘等呼吸系统疾病的免疫活性细胞具有强大的调节作用[5,18]。“同一气道,同一疾病”的共识认为,AR和哮喘是一个呼吸道综合征的不同表现[10,19]。故可推测PACAP在AR中也应该发挥重要作用。我们前期研究[5]也提示,PACAP在AR大鼠鼻黏膜中有表达。本研究结果显示,AR组大鼠鼻黏膜和翼腭神经节中均有大量的PACAP聚集,干预组大鼠鼻黏膜和翼腭神经节中聚集的PACAP减少,对照组大鼠鼻黏膜和翼腭神经节周围仅有少量的PACAP表达,提示PACAP参与了AR的发生。经过BTX-A干预后,AR大鼠鼻腔黏膜周围PACAP表达减少,但仍高于正常水平,AR大鼠翼腭神经节中PACAP表达明显减少,与正常大鼠翼腭神经节中的量基本相等。这说明,BTX-A干预7 d后,AR大鼠翼腭神经节末梢合成和释放PACAP的量明显减少,发挥过敏性反应的作用较弱,而鼻黏膜中仍残留高于正常水平的PACAP表达,仍处于过敏反应的状态。
翼腭神经节,又称蝶腭神经节,分布于上、中、下鼻甲,鼻中隔和鼻咽顶等部位。它除了释放副交感经典递质之外,还可以释放多种神经肽及神经调质,支配节后纤维分布区黏膜下腺体的分泌和血管的舒缩[20]。BTX-A是一种高分子蛋白神经毒素,可阻断和抑制神经-肌肉接头处Ach囊泡表面的膜蛋白,限制钙的释放[5]。本研究结果显示,AR组大鼠鼻黏膜和翼腭神经节中有大量的炎性细胞和嗜酸性粒细胞浸润,干预组大鼠鼻黏膜中仅有少量炎性细胞和嗜酸性粒细胞浸润。干预组大鼠翼腭神经节、对照组大鼠鼻黏膜和翼腭神经节中无明显炎性细胞和嗜酸性粒细胞浸润。AR组、干预组和对照组大鼠鼻黏膜的炎性细胞浸润、腺腔内炎性细胞渗出的病理等级逐渐降低,说明BTX-A可减轻AR大鼠鼻腔黏膜的过敏反应,但其鼻黏膜仍有过敏反应,未完全恢复至正常水平。AR组和干预组纤毛缺失损失程度有差异,是PACAP还是BTX-A,或者其他因素导致大鼠黏膜纤毛缺失的修复,尚需进一步探讨。
本研究结果显示,PACAP主要分布于大鼠翼腭神经节胞质内和鼻黏膜上皮细胞、腺体细胞胞质和血管周围,而且在AR大鼠鼻黏膜和翼腭神经节中的表达明显强于正常大鼠,神经肽抑制剂BTX-A可降低AR大鼠鼻黏膜和翼腭神经节中PACAP的表达。由于鼻黏膜免疫活性神经肽来源于翼腭神经节细胞体,故可推测在变应原的刺激下,翼腭神经节纤维增粗密集并释放大量PACAP于鼻黏膜,导致鼻腔PACAP分泌增加,促进AR的发生,而BTX-A可抑制翼腭神经节中PACAP的分泌,从而减少鼻黏膜中PACAP的表达而减轻AR的症状。本研究中与干预组和对照组比较,AR组血清IFN-γ降低、IL-4升高、IFN-γ/IL-4降低,干预组与对照组比较,P均>0.05,说明PACAP可能通过引起Th1/Th2细胞失衡而参与AR的发生。
总之,AR大鼠翼腭神经节及鼻黏膜组织中PACAP表达均升高,BTX-A鼻腔滴入后PACAP表达均降低,炎症反应减轻,其原因可能是翼腭神经节内的PACAP释放于鼻黏膜、且使Th1/Th2细胞失衡而参与AR的发生。BTX-A可抑制翼腭神经节PACAP的释放,从而使鼻黏膜中PACAP减少而减轻AR的症状,此结果为AR的治疗提供了一种新的方向。但是由于本实验缺乏大样本数据,而且鼻腔神经肽种类繁多、分布广泛,变应性炎症网络系统错综复杂,PACAP在AR大鼠的发病中具体的作用机制尚需进一步研究。

