PAIP1结合RNA测序及整合分析
郑剑锋 ,杨峻 ,李金平 ,杨小洁 ,邵文华 ,秘思思
(1.深圳市宝安区中心医院,深圳大学第五附属医院,广东 深圳 518102;2.桂林医学院,广西 桂林541004)
真核生物的蛋白质翻译调控过程在基因表达调控中发挥重要作用,而其中翻译起始阶段的调控是限速过程,在蛋白质翻译过程中的作用更加重要。翻译起始过程的异常会导致失常的蛋白质组,表现为蛋白质的种类和相对表达量的异常,该过程的异常会导致疾病,包括肿瘤的发生[1-3],因此,了解真核生物翻译起始阶段的调控机理对疾病的靶向治疗具有重要的指导意义。真核生物翻译起始是一个多因素参与、多步骤、动态的反应过程[4]。所有这些步骤涉及翻译起始因子与核糖体和mRNA的相互作用,除翻译起始因子外,Poly(A)结合蛋白相互作用蛋白1(Poly(A)binding protein interacting protein 1,PAIP1)的作用尤为特殊,PAIP1能与真核翻译起始因子3(Eukaryotic translation initiation factor 3,eIF3)和真核翻译起始因子 4A(Eukaryotic translation initiation factor 4A,eIF4A)相互作用,促进了mRNA环形结构的形成,迄今为止,人类中只发现PAIP1参与mRNA环化衔接,因此,PAIP1是蛋白翻译起始必须因子[5]。Sonenberg,N等研究发现,PAIP1可通过结合eIF4A和PABP促进蛋白质翻译,并提出PAIP1可能具有结合mRNA分子的功能[6],然而,该研究没有证实PAIP1能否结合mRNA分子。为了进一步研究PAIP1的功能,尤其证实PAIP1能否结合mRNA分子,即PAIP1的RNA结合功能,本研究通过RNA结合蛋白富集测序分析(RNA Binding Protein Immunoprecipitation sequencing,RIP-Seq)PAIP1 结合 RNA 的 分子 特征并进行富集分析,探讨PAIP1的新功能。
1 资料与方法
1.1 细胞培养与质粒构建 设计PAIP1基因PCR扩增引物,F引物:agcccgggcggatccgaattcATGTCGGACGGTTTCGATC;R 引物:gtcatccttgtagtcctcgagC TGTTTTCGCTTACGCTCTG。依照Invitrogen公司的Trizol试剂操作说明书提取HeLa细胞RNA,根据Promega公司M-MLV操作说明书将RNA逆转录成cDNA,对PAIP1基因进行PCR扩增,用QIAGE N公司的QIAquick PCR Purification Kit纯化PCR产物。使用Vazyme公司的ClonExpressII One Step Cloning Kit将PAIP1-Flag克隆基因连接到pIRES-hrGFP-1a载体上,构建PAIP1过表达和空载体质粒,将构建好的质粒通过脂质体2000转染HeLa细胞,37℃培养48h。使用荧光显微镜观察GFP荧光信号强度来判断质粒转染效率。
1.2 PAIP1蛋白质表达检测 质粒转染成功的HeLa细胞用预冷的1X PBS漂洗3次,弃掉PBS,向细胞培养皿中加入预冷的细胞裂解液 (1×PBS,0.5%脱氧胆酸钠,0.1%SDS,0.5%NP40)对细胞样本进行裂解,收集细胞裂解液,4℃,13000 g离心20min,去除细胞碎片。将5X SDS样品缓冲液进入至细胞裂解液中,在沸水中煮沸10min,10%SDSPAGE分离复合物。用含5%脱脂乳粉的TBST缓冲液(20 mm tris缓冲盐水和0.1%tween-20)在室温下孵育 1h,一抗:Flag 抗体(1:2000)、GAPDH(1:2000)和HRP结合二抗孵膜,ECL发光显影检测相应蛋白水平的表达情况。
1.3 免疫共沉淀 HeLa细胞在含RNA酶抑制剂和蛋白酶抑制剂的预冷细胞裂解缓冲液中裂解5min, 然后剧烈振荡,4℃,13000 g离心 20min,去除细胞碎片。用MNase酶部分降解细胞裂解液中的PAIP1-RNA复合物。之后加入A/G-DynaBeads,anti-flag抗体,或对照IgG抗体4℃孵育过夜。分别用低盐洗涤液、高盐洗涤液和1X PNK缓冲液各洗涤磁珠2次。用50μl洗脱缓冲液 (50mm Tris-Cl(PH=8.0),10mm EDTA(PH=8.0),1%SDS)对样品进行重悬,70℃,1400r/min离心,孵育20min。置磁珠3min,将上清转移至新的EP管中。取40μl样本消解蛋白质,从PAIP1-RNA复合物中提取RNA。剩余10μl样本用于免疫印迹 (western blotting,WB)检测IP效率。
1.4 iRIP-seq文库的制备及序列分析 将1.3得到PAIP1结合 RNA,用 KAPA-RNA Hyper Prep Kit试剂盒(KAPA,KK8541)制备 cDNA 文库,在 illumina XTen平台上对构建的cDNA文库进行150bp双端高通量测序。
1.5 数据分析 用TopHat 2[7]将读段(reads)比对到参考基因组上,将唯一映射读段用于后续分析。Piranha分析策略用于鉴定PAIP1在基因组上的结合区域[8]。根据测序深度和覆盖度选取某一固定长度(xx nt)为单位(bin)将基因组等分,统计每个bin中的reads数目。模拟数据中reads的分布情况,来作为背景噪音,然后基于zero truncated negative binomial(ZTNB)来寻找reads分布显著高于背景的位置。在此过程中每个bin都会获得一个p-value,根据p-value进行显著性筛选,得到真实的结合峰。Input组和IP组样本分别进行模拟分析,去除IP组中与Input组重叠峰。通过peak关联分析PAIP1结合的靶基因,靶基因结合基序用HOMER软件[9]计算获得。
1.6 功能富集分析 利用KOBAS 2.0server对基因进行KEGG聚类分析[10],以确定峰值相关基因(靶基因)的功能类别。采用超几何试验和Benjamini-Hochberg-FDR控制程序确定各项的富集程度[11]。
1.7 统计学分析 采用GraphPad Prism6.0版软件进行数据分析。定量数据以平均数±标准差()记录,采用t检验,定性数据采用Mann-Whitney U非参数检验,以P<0.05为差异有统计学差异意义。
2 结果
2.1 PAIP1-Flag过表达HeLa细胞系构建 使用pIRES-hrGFP-1a载体连接PAIP1-Flag基因构建过表达和空载体质粒,将构建好的质粒通过脂质体2000转染HeLa细胞中。通过荧光显微镜照射观察GFP荧光信号强度来判断质粒转染效率,见图1A。质粒转染成功的细胞用Western blot检测PAIP1蛋白表达量,见图1B。
2.2 免疫共沉淀捕获PAIP1结合的RNA 使用Flag抗体对PAIP1过表达HeLa细胞进行RIP实验,以IgG作为阴性对照。Western blot检测结果分析见图2A,实验所用的Flag抗体能特异性地免疫沉积富集PAIP1-Flag蛋白。对免疫沉淀富集的PAIP1-Flag-RNA复合物和Input样本提取RNA,RNA分子3’端以碱基互补配的方式结合illumina接头,反转录形成cDNA第一链,以链置换的方法连接另一端illumina接头,再使用illumina建库和测序兼容引物PCR扩增,扩增后的cDNA文库使用DNA Clean磁珠纯化,在illumina测序平台上进行双端150bp测序反应,测序cDNA文库片段大小,见图 2B。
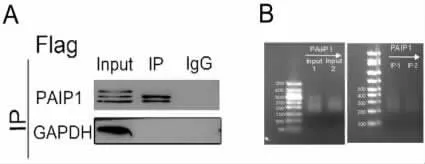
图2 免疫共沉淀捕获PAIP1结合的RNA
2.3 高通量测序及数据基础分析 在illumina-Xten平台中对文库进行双端150bp的测序,获得2千万左右的原始reads数据,见表1A。使用TopHat 2软件将有效测序数据比对到人的参考基因组上,见表1B。在参考基因组上具有唯一定位的非冗余数据(rmdup reads)统计其在基因组各个分区部分情况,见表1C。
2.4 数据高级分析 使用Piranha软件以Input样本为背景对PAIP1-Flag实验样本rmdup reads进行Peak Calling,2次实验样本各分别得到peak数为4096和3308。对实验样本特异性的peak宽度进行统计,80%的peak宽度在200bp左右,见图3A。同时对基因功能区peak分布进行分析,发现PAIP1主要结合位点位于 3’UTR、CDS和 Introns区,见图3B。进一步对peak关联的gene用京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析,以确定与 PAIP1 蛋白结合的RNA参与的主要生化代谢途径、信号传导途径、分子功能、生物过程和细胞组分。分析结果显示,见图3C,PAIP1结合的mRNA分子主要参与了焦点粘连、剪切体、RNA转运、蛋白多糖在癌症中的作用、HIF-1信号通路、PI3K-Akt信号通路等功能。

表1 A原始reads数据统计
3 讨论
RNA 结合蛋白 (RNA binding proteins,RBPs)的定义为能结合RNA的蛋白质,与基因转录后调控有关,包括参与RNA的可变剪接,RNA的空间折叠等,从而导致RNA的表达量的变化,因此,精确确定RBPs在RNA上的结合位置和结合特点至关重要[12,13]。目前研究RBP结合位点的主要方法有CLIP-seq,但是CLIP-seq也存在有缺陷,如实验过程复杂,成功率较低,文库丰富度不够等。与CLIP-seq类似的方法RIP-seq,实验步骤相对简单,而且能获得和CLIP-seq比较类似的实验结果[14]。最近有研究报道,使用DO-RIP-seq技术,也可以成功地获得RBPs的结合位点,这为RIP-seq技术分析RBPs的结合位点提供了方案和依据[15]。

表1 B有效reads数据比对统计

表1 C reads在基因组不同区域上的分布
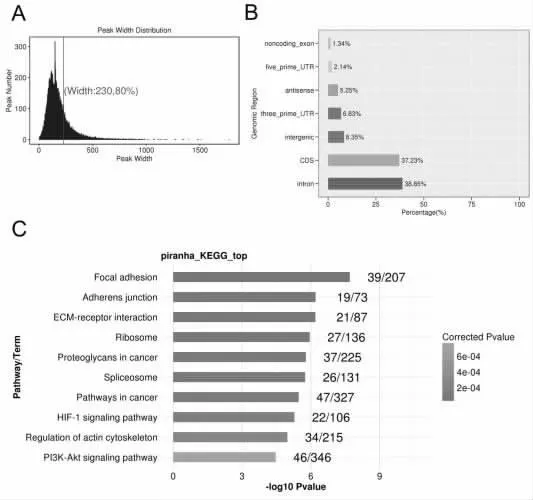
图3 结合峰相关基因聚类分析
本研究在Hela细胞中过表达PAIP1进行iRIP-seq,发现PAIP1具有广泛的RNA结合活性,结合显著富集在CDS和Intron区域,表明PAIP1可能具有调控mRNA可变剪接功能。iRIP-seq数据综合KEGG分析表明,PAIP1结合的RNA分子主要参与了焦点粘连、剪切体、RNA转运、蛋白多糖在癌症中的作用、HIF-1信号通路、PI3K-Akt信号通路。本研究对于PAIP1蛋白质的功能和在癌症中的作用提供了基础大数据和新的研究方向。
PAIP1以前被报道的功能是调控蛋白质翻译[6,16],我们的研究结果显示PAIP1结合的基因和蛋白质翻译起始、延伸、终止相关,表明PAIP1具有新的调控功能,通过调控翻译相关基因的表达从而进一步调控蛋白质翻译。PAIP1作为RNA结合蛋白的功能未见报道,本研究也明确了PAIP1的新功能,即RNA结合功能,进一步证实了Sonenberg,N等的设想[6]。本研究将为PAIP1蛋白质的功能及机制研究提供新的研究方向。
本研究通过高通量测序手段寻找PAIP1结合靶标,发现PAIP1结合的分子参与了肿瘤相关分子通路,但是,这些结果是通过生物信息学分析得出的,其具体功能还未得到验证,为了进一步明确PAIP1的作用,下一步将开展功能验证实验从而验证这些结果。
文章分析得出:PAIP1结合的mRNA分子主要参与了焦点粘连、剪切体、RNA转运、蛋白多糖在癌症中的作用、HIF-1信号通路、PI3K-Akt信号通路等功能。这些猜想是基于信息学分析结果推论得到的,需在讨论中提及后续的验证实验,如果条件允许,请进行下一步的验证实验已验证该猜想。

