胆道闭锁幼鼠肝脏组织中LOXL-2与MMP-7、MMP-9、TGF-β1的关系研究
张向宁,孙欢,侯崇智,施伟栋,张书峰
胆道闭锁(biliary atresia,BA)是一种只在新生儿期发生的特发性疾病,表现为胆道梗阻,是一种进行性、特发性的肝外胆道炎症性纤维化病变[1-3]。越来越多的研究发现,经肝门空肠吻合术(Kasai术)后,BA患儿肝脏基质金属蛋白酶家族(matrix metalloproteinases,MMPs)水平显著升高,不仅随纤维化程度加重而升高,而且参与了BA引起的肝脏病理过程[4-5];而转化生长因子-β1(transforming growth factor-β1,TGF-β1)作为一种促纤维化因子,是导致肝纤维化的重要因子[6-7];赖氨酰氧化酶(lysyl oxidase-like protein,LOXL)作为一种依赖性胺类氧化酶,能够增强细胞迁移能力,其中LOXL-2与胆道上皮损伤有关[8],在BA的病理过程中起着重要的作用[9],因此,本研究通过建立BA幼鼠模型,研究幼鼠肝脏LOXL-2、MMP-7、MMP-9、TGF-β1的表达情况以及LOXL-2与MMP-7、MMP-9和TGF-β1的相关性,旨在探讨LOXL-2与BA肝纤维化的关系以及在BA病理发展中的作用。
1 材料与方法
1.1 胆道闭锁幼鼠模型的建立
选择体质量20~30 g,8周龄Balb/c小鼠,以雄雌比2∶3比例进行配对分笼。待孕鼠生下幼鼠后,将出生幼鼠(n=72)随机平均分为对照组及模型组。对照组幼鼠腹腔注射病毒培养液,模型组小鼠于出生后24 h内腹腔注射20 μL浓度为1×106Pfu/mL恒河猴轮状病毒(Rhesus rotavirus,RRV,购自ATCC)。以幼鼠出现皮肤染黄、小便深黄及大便白色等表现认为造模成功,母鼠拒绝哺乳的幼鼠及出生后72 h内死亡幼鼠不计入统计,最终入组60只,对照组和模型组各30只。
1.2 标本处理
幼鼠注射病毒后,于7 d、15 d及28 d分别取两组幼鼠处死,取肝脏组织,部分放入无RNA酶灭菌EP管,置于液氮中保存,部分进行石蜡包埋,免疫组化染色及切片。
1.3 qPCR检测LOXL-2、MMP-7、MMP-9及TGF-β1 mRNA在肝脏中的水平
Trizol法提取肝脏总RNA,紫外分光光度计定量计算浓度,采用Applied biosystem逆转录试剂盒得到cDNA产物,以TaKaRa SYBR GreenⅠ染料试剂盒进行qPCR定量分析,采用20 μL反应体系,GAPDH为内参,以2-ΔΔCt计算样本各基因相对表达量,引物序列见表1。

表1qPCR引物序列
1.4 Elisa检测肝脏组织中LOXL-2、MMP-7、MMP-9及TGF-β1的表达
无菌操作称取等量肝脏组织进行匀浆,严格按照ELISA检测kit(购自联科生物技术有限公司)操作说明进行LOXL-2、MMP-7、MMP-9及TGF-β1蛋白水平测定,根据标准曲线计算蛋白含量。
1.5 统计学方法

2 结果
2.1 LOXL-2在肝脏的表达情况
造模后7 d,模型组肝脏LOXL-2 mRNA、LOXL-2表达与对照组比较无统计学差异(P>0.05);造模后15 d、28 d表达均较7 d升高,差异有统计学意义(P<0.05),且分别高于同期对照组,差异有统计学意义(P<0.05)。见表2。
2.2 肝脏MMP-7、MMP-9、TGF-β1的表达情况
与对照组比较,模型组幼鼠肝脏MMP-7 mRNA、MMP-7表达均升高,差异有统计学意义(P<0.05),且28 d时,表达均较7 d显著升高,差异有统计学意义(P<0.05)。造模15d后,模型组肝脏MMP-9 mRNA、TGF-β1 mRNA、MMP-9、TGF-β1表达均高于对照组,差异有统计学意义(P<0.05),造模28d,MMP-9 mRNA、MMP-9表达降低且与对照组比较无统计学差异(P>0.05),而TGF-β1 mRNA、TGF-β1表达仍持续升高,差异有统计学意义(P<0.05)。见表3、表4。
2.3 相关性分析
模型组30例肝脏样本中,LOXL-2的表达与MMP-7、TGF-β1的表达呈正相关(r=0.707,P<0.001;r=0.556,P=0.001),与MMP-9的表达无相关性(r=-0.022,P=0.907)。见图1。
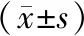
表2胆道闭锁幼鼠肝脏组织中LOXL-2表达水平
注:*与同期对照组比较,P<0.05;#与同组7 d比较,P<0.05
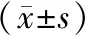
表3各组肝脏组织中MMP-7 mRNA、MMP-9 mRNA、TGF-β1 mRNA表达
注:*与同期对照组比较,P<0.05;#与同组7 d比较,P<0.05
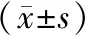
表4各组肝脏组织中MMP-7、MMP-9、TGF-β1的表达水平
注:*与同期对照组比较,P<0.05;#与同组7 d比较,P<0.05
3 讨论
目前关于BA的病理学机制还未完全明确,一般认为与病毒感染、先天胆管发育异常、基因等原因有关[10]。BA的临床表现为持续黄疸、尿色加深、灰白色呈陶土样大便等,严重时可出现肝衰竭表现,如腹水、食道胃底静脉曲张、肝脾肿大等。当BA并发肝脏损害时,其常见病因及病理学特征是病毒感染等造成肝脏损伤和胆管上皮细胞增生,以及由此导致的肝星形细胞激活,并且进而造成细胞外基质降解失衡,导致肝纤维化、甚至肝硬化[11]。而可导致肝纤维化的因子,最常见的有TGF-β1,由胆道上皮细胞生成,不仅是激活肝星形细胞的重要因子,而且是公认的促纤维化因子[6],本研究结果可见模型组幼鼠TGF-β1表达高于对照组,提示模型组可能存在由BA导致的肝星形细胞激活以及肝纤维化。

图1LOXL-2与MMP-7、MMP-9、TGF-β1表达量的相关性
MMPs是肝内参与细胞外基质转换并起到关键作用的因子,不仅参与了细胞外基质的降解,而且在BA导致的肝纤维化过程中起到重要作用[4]。与肝纤维化密切相关的有MMP-1、MMP-2、MMP-9等[8,12],其中,MMP-9可以参与降解正常肝窦基底膜及Ⅳ型胶原,影响并调节细胞外基质合成与降解的动态平衡,继而调控肝纤维化[13]。本研究显示,造模7 d、15 d,模型组幼鼠MMP-9表达水平均高于对照组,15 d时MMP-9 mRNA表达水平高于对照组,且其与MMP-9的表达水平均高于同组7 d时,说明MMP-9参与了BA导致的肝脏纤维化进程。然而,28 d时,MMP-9和MMP-9 mRNA表达均降低且与7 d时无统计学差异,分析其原因,可能是因为MMP-9对肝纤维化具有双向调节作用。因为,有研究显示在肝纤维化的发展后期,机体常通过降解沉积过多的胶原和连接蛋白来反向阻止纤维化[14],因此,也间接提示在本研究中,在造模28 d时,模型组小鼠可能已发生肝硬化以及由此导致的胶原和连接蛋白降解增加,并且MMP-9可能参与了上述过程。
在MMPs家族中,关于MMP-7与BA相互关系的研究相对较少,但已有研究发现MMP-7在BA中可以用于预测术后肝纤维化且具有较高的特异性[15],MMP-7作为多条促纤维化通路过程中重要的调节蛋白及产物[16],被认为是反映肝纤维化程度的有效指标[17]。本研究结果显示,MMP-7在BA模型组幼鼠肝脏表达显著高于对照组,与余晨等的临床研究结果一致[5]。同时随着时间变化,造模28 d时MMP-7、MMP-7 mRNA表达高与7 d、15 d,分析其原因,可能与模型组小鼠肝纤维化程度有关。
LOXL是一类分泌性铜依赖性胺类氧化酶,LOXL-2可导致胆道上皮紧密连接的通透性增加[18]。胆管在胆汁合成、排泄的过程中发挥重要的作用,胆管的完整性是肝功能正常的一个前提条件,正常的胆管分泌功能依赖于正常的上皮屏障功能,胆管疾病通常与胆管细胞的紧密连接相关[19],而已有研究发现LOXL-2与胆道上皮损伤有关[8]。本研究结果显示,15 d、28 d时,LOLX-2在模型组幼鼠肝脏组织中表达高于对照组;相关性分析可见LOXL-2与TGF-β1的表达情况呈正相关(r=0.556),可能的原因是BA的病理生理过程中,LOXL-2、TGF-β1均有促进上皮间质转化(epithelial to mesenchymal transition,EMT)的作用[20]。有研究发现,TGF-β1能上调LOXL-2表达,抑制TGF-β1信号通路后,LOXL-2转录及表达减少,提示TGF-β1可能参与LOXL-2转录、表达的调控环节[21-25];然而,阻断LOXL-2表达后,又可逆转TGF-β1信号通路的转导[25-26],但机制未明,因此,LOXL-2参与的信号通路及在EMT发生中的作用、TGF-β1对LOXL-2的具体调控机制以及相互之间的作用机制,仍需进一步研究。另外,相关性分析还发现LOLX-2与MMP-7也具有相关性(r=0.707),提示在BA所致肝纤维化的病理生理过程中,LOLX-2、TGF-β1、MMP-7可能通过某种作用机制协同促使BA并发肝纤维化的发生,但具体机制仍需研究。
综上所述,本研究揭示了在BA中LOXL-2与MMP-7、MMP-9、TGF-β1的关系,但由于未对肝纤维化进行病理分级,因此,尚不能说明LOXL-2与BA所致肝纤维化程度的关系,因此,LOXL-2参与BA所致肝纤维的具体机制仍需进一步研究。

