直肠癌组织中p53蛋白与Survivin表达水平在判断患者预后中的应用价值分析
石贤清,孙叶英,朱春荣
直肠癌是比较常见的消化道恶性肿瘤,该病发生主要与饮食、生活环境、遗传等因素有关[1]。研究表明对直肠癌患者而言,以p53基因最容易发生异常改变,野生型p53对细胞凋亡有诱导作用,可负性调节细胞周期[2]。Survivin是凋亡抑制蛋白家族的重要组成部分,它对细胞凋亡有抑制作用,有利于细胞增殖[3-4]。有学者发现Survivin在胚胎、肿瘤组织内存在表达,它与癌细胞转移、增殖有关[5]。本研究旨在分析p53蛋白与Survivin蛋白表达对直肠癌患者预后的评估价值,便于了解二者与预后的关系,提出更合理的治疗方案,现报道如下。
1 资料与方法
1.1 一般资料
选取两院2013年12月至2016年12月收治的直肠癌患者90例,所有患者均行直肠癌根治术。其中男48例,女42例,年龄30~76岁,平均(51.29±14.78)岁;临床分期:Ⅰ期17例、Ⅱ期38例、Ⅲ期35例;脉管浸润:有39例,无51例;组织学分型:低分化30例、中分化37例、高分化23例。研究方案获得两院医学伦理委员会批准。
1.2 入选标准
1.2.1 诊断标准 参考卫生部医政司[6]编制的《结直肠癌诊疗规范(2010年版)》诊断:①临床表现为血便、便秘、排便梗阻等;②经直肠指检,可触摸到肿块,质硬;③经腹盆腔CT、盆腔MRI提示有肿瘤;④经病理检查证实为直肠癌。
1.2.2 纳入标准 ①诊断明确;②术前无放疗、化疗史;③未见远处转移;④患者对本研究知情同意。
1.2.3 排除标准 ①有根治性手术禁忌,行保守治疗;②肛门形态、功能异常;③心、脑、肝、肾等脏器损害;④凝血障碍;⑤合并其他恶性肿瘤;⑥重度感染。
1.3 方法
1.3.1 免疫组化检测方法 经免疫组化法测定病灶组织内p53蛋白、Survivin蛋白表达情况。主要试剂包括兔抗Survivin抗体(迈新生物)、鼠抗p53抗体试剂(迈新生物)、DAB显色试剂(迈新生物)。主要仪器包括恒温箱(乐普纳科技)、显微镜(乐普纳科技)、显微成像系统(PARK公司)、低温冰箱(乐普纳科技)、切片机(乐普纳科技)。在开始试验前,反复冲洗盖玻片、载玻片,并浸入浓硫酸内,盖玻片烤3 h,载玻片约烤7 h,待烤干后,将其捞出。经蒸馏水反复漂洗,于95%乙醇内浸泡,过夜。完成上述操作后,将其取出,置于37 ℃烤箱内,确保完全干燥后,将其取出备用。选取标本组织,于切片机上固定,切片厚度约4 μm,在37 ℃环境下过夜。免疫组化过程:①将切片在65 ℃条件下反应45 min。②常规脱蜡,利用二甲苯Ⅰ、Ⅱ分别反应10 min,经无水酒精Ⅰ、Ⅱ分别反应10 min,置于不同浓度的乙醇内(浓度分别为95%、90%、80%、70%),分别反应5 min、2 min、2 min、2 min,经PBS液体完成3次冲洗,3 min/次。③取枸橼酸盐缓冲液经高压锅煮沸,将玻片放置在修复液内反应3 min,将其取出,待冷却后经PBS液体进行3次冲洗,5 min/次。④取过氧化氢(50 μL,浓度为3%)加入切片,孵育10 min,将内源性过氧化物酶活性阻断,经PBS液体进行3次冲洗,3 min/次。⑤通过浸泡将残留的PBS液去除,取第一抗体50 μL加入切片,在室温环境下孵育60 min,将其取出后,经PBS液进行3次冲洗,3 min/次。⑥将残留的PBS液去除,取快捷免疫组化试剂50 μL加入切片,在室温环境下孵育10 min,经PBS液体进行3次冲洗,1 min/次。⑦将残留的PBS液去除,取DAB显色剂加入切片,避光显色。⑧经苏木素进行复染,时间为2 min,盐酸分化,取出后冲洗3次,于温水内返蓝,时间为5 min。⑨脱水、封片。结果判断:当细胞浆内有淡黄色至棕黄色颗粒形成,提示Survivin蛋白为阳性,当胞核内有黄褐色、棕黄色颗粒形成,则提示p53蛋白为阳性[3]。
1.3.2 Western blot检测 取黏膜组织100 mg,加1 mL裂解液、10 mL缓冲液,粉碎组织,匀浆,冰浴30 min,4 ℃离心,取上清液,紫外可见分光度仪检测蛋白浓度(BCA法),蒸馏水稀释样本5 μg/μL,-70 ℃下保存,取样本10 μL、5 μL预染Marker,加上样缓冲液,混合后100 ℃煮沸蛋白,变性5 min,7.5%、12%凝胶电泳分离1、2 h,电转30 min,将硝酸纤维膜取出,染色1 min,标记并用5%脱脂奶粉洗脱若干次,浸入封闭液内1 h,加一抗(兔抗人survivin多克隆抗体)及封闭液均匀滴在聚偏氟乙烯膜表面,4 ℃过夜,二抗1∶50稀释在BSA内,均匀滴于PVDF膜表面,DAB显色、照相。
1.4 观察指标
比较癌灶组织、癌旁组织的p53、Survivin蛋白阳性、阴性表达情况,并记录二者蛋白表达等电点值(PI)。术后通过电话随访2年,根据患者2年内的生存、死亡情况,分成生存组、死亡组,比较两组癌组织的p53与Survivin蛋白表达水平,记录两组PI值,绘制受试者工作特征(ROC)曲线分析二者对患者预后的预测价值,明确曲线下面积、最佳截断值以及相应的敏感度、特异度。
1.5 统计学方法
经SPSS 20.0软件处理数据。计数资料用%表示,组间比较采用2检验,同一患者的癌组织和癌旁组织的计数资料采用配对样本2检验;计量资料用表示,采用t检验;采用ROC曲线分析p53和Survivin蛋白PI值对患者预后的预测价值。P<0.05为差异有统计学意义。
2 结果
2.1 癌灶组织、癌旁组织的p53、Survivin蛋白表达比较
免疫组化显示癌灶组织的p53、Survivin蛋白阳性表达(图1、图2),癌灶和癌旁组织p53蛋白、Survivin蛋白情况见下表1和表2,差异有统计学意义(均P=0.000)。Western blot检测(图3)显示癌灶组织的p53、Survivin蛋白表达灰度值均高于癌旁组织,差异有统计学意义(P<0.05),见表3。
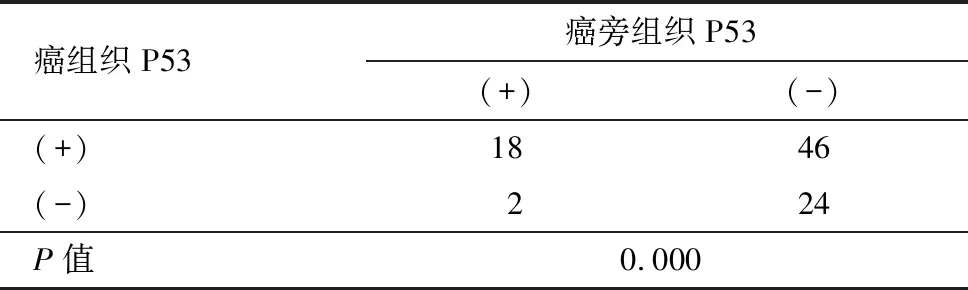
表1不同组织内p53蛋白阳性率
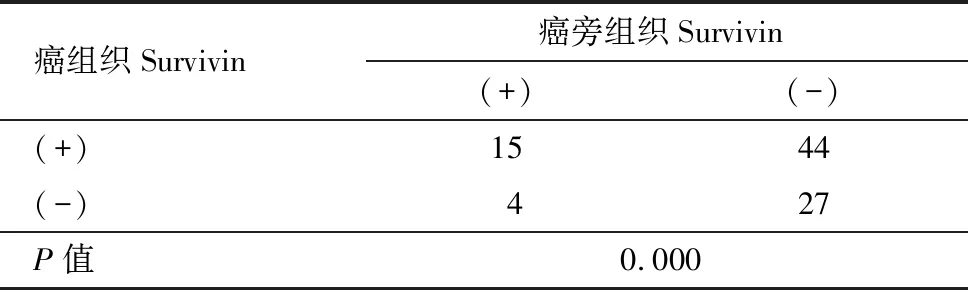
表2不同组织内Survivin蛋白阳性率
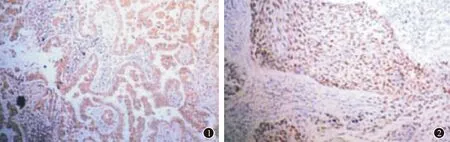
图1Survivin蛋白阳性表达(SP×100)图2p53蛋白阳性表达(SP×100)

图3p53、Survivin蛋白表达(Western blot)

表3癌灶组织和癌旁组织p53、Survivin蛋白的灰度值
2.2 癌灶组织、癌旁组织的p53、Survivin蛋白PI值比较
癌灶组织的p53、Survivin蛋白PI值显著高于癌旁组织(均P<0.05),见表4。
表4癌灶组织、癌旁组织的p53、Survivin蛋白PI值比较
2.3 生存组、死亡组的p53、Survivin蛋白表达比较
通过2年随访,在90例患者中,有29例死亡,占32.22%,61例生存,占67.78%。死亡组p53、Survivin蛋白阳性率高于生存组,组间比较有统计学差异(P<0.05),见表5。
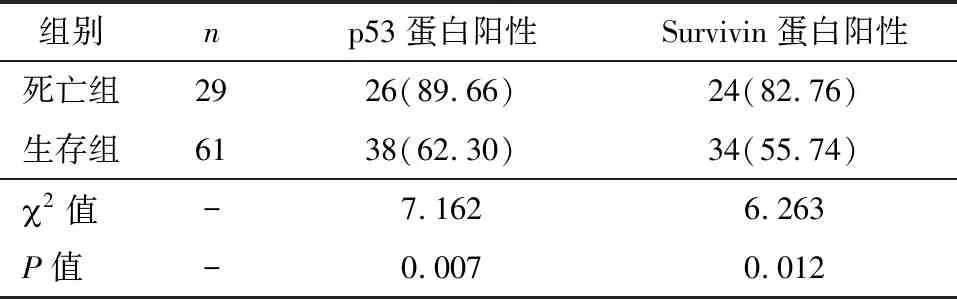
表5生存组、死亡组的p53、Survivin蛋白表达阳性率比较[n(%)]
2.4 生存组、死亡组的p53、Survivin蛋白PI值比较
死亡组的p53、Survivin蛋白PI值高于生存组,两组比较有统计学差异(P<0.05),见表6。
表6生存组、死亡组的p53、Survivin蛋白PI值比较
2.5 p53、Survivin蛋白PI值对患者预后的预测价值
分别以p53、Survivin蛋白PI值为检验变量,以是否发生死亡为状态变量,绘制ROC曲线(图4、图5),结果提示,p53、Survivin蛋白PI值预测直肠癌患者预后的曲线下面积分别为0.892、0.798,以p53蛋白PI>90.12、Survivin蛋白PI>87.72时,患者死亡风险较高,见表7。

表7p53、Survivin蛋白PI值对患者预后的预测价值
3 讨论
本研究发现与癌旁组织相比,癌症组织中的p53、Survivin蛋白阳性率明显增高,且p53、Survivin蛋白PI值上调。Survivin属于凋亡抑制因子,既往有研究证实其在结直肠癌的病灶组织中呈高表达[7],与本研究结论相符。另有研究发现Survivin与结直肠癌患者的T分期、淋巴结转移、组织学分型等病理特征存在关联[8-10]。这可能的机制在于对恶性肿瘤患者而言,会有较多新生血管形成,而在这过程中,血管内皮生因子对Survivin高表达存在诱导作用,这为肿瘤血管生成提供了有利条件[11]。p53蛋白可分成突变型、野生型两类,其中野生型对细胞凋亡、衰老存在促进作用,有利于维持基因稳定性[12-14]。而突变型则不具备抑癌作用,且对野生型p53蛋白活性有抑制功能,可导致细胞转化加强[15]。本研究提示癌症组织内的p53蛋白阳性率高于癌旁组织,这可能是因患者突变型P53基因分布较多,且分布广泛所致。

图4p53蛋白预测患者预后的ROC曲线

图5Survivin蛋白预测患者预后的ROC曲线
通过分析生存组、死亡组患者的p53、Survivin蛋白表达,提示死亡组p53、Survivin蛋白表达阳性率更高,由此可推测,p53和Survivin的表达情况对患者预后影响较大。Survivin影响预后的机制可能如下:①它对半胱氨酸天冬氨酸蛋白酶-7有抑制作用,能将细胞凋亡途径阻断,导致肿瘤病情加重[16];②它能结合于半胱氨酸天冬氨酸蛋白酶-9,对其活性存在抑制功能,可进一步促进细胞异型增殖,加重病情,影响预后[17]。有学者发现p53蛋白具有较多突变位点,且在组织内广泛分布,可促进细胞异型增殖,导致细胞增殖、凋亡处于失衡状态,利于肿瘤生长[18-19],这可能是p53蛋白影响直肠癌患者预后的重要机制。
本研究的创新之处在于绘制了ROC曲线,证实p53、Survivin蛋白PI值对患者预后具有一定预测价值,临床需对此引起重视。研究表明野生型P53可负性调节Survivin的表达,且二者在大肠癌病灶中的表达呈正相关[20]。这表明p53蛋白阳性率越高,则Survivin蛋白阳性风险也越高。尤其对突变型P53基因而言,其原本自带的生物学功能丧失,导致细胞周期蛋白分泌量增加,促使其调控功能下降,有利于受损DNA存活,形成癌症。此外,Survivin蛋白上调则可将抗肿瘤凋亡机制启动,促进癌细胞增殖,二者相互作用,形成恶性循环,增加死亡风险。
综上,与癌旁组织相比,直肠癌组织中p53、Survivin蛋白表达阳性率明显上调,且死亡患者的p53、Survivin蛋白表达阳性率高于生存患者,p53、Survivin蛋白PI值也高于生存患者,临床可将二者作为评估患者预后的重要指标。然而,本研究也有不足,如纳入样本量少,未来将扩大样本量,对此进行探讨。

